SICSI VIII Ciclo A.A. 2008/2009
Corso di Laboratorio di Chimica Analitica
La proteina nella
chimica analitica
Prof. S. Andini
Prerequisiti e finalità
Questo modulo si rivolge a studenti di 4°anno istituto tecnico
industriale
Quello che già sanno
Gli studenti già hanno affrontato la chimica generale e fondamenti
di chimica organica.
Conoscono le proteine grazie al corso di chimica della natura.
Spettroscopia, legge Lambert-Beer
Quello che impareranno
Che si può imitare la natura per quantizzare una sostanza di
interesse in un miscuglio.
La chimica analitica si può avvalere di tutti gli indirizzi della
chimica: inorganica, organica, biologica e fisica.
Le proteine
richiamo ad alcune nozioni
Sono costituite dai 20 L-amminoacidi
Hanno una struttura primaria,
secondaria, terziaria e quaternaria
Hanno diverse funzioni all’interno della
cellula: strutturale o funzionale.
Le proteine come catalizzatori biologici:
gli enzimi
1. alla fine della reazione, le proteine enzimatiche devono
conservare la loro struttura immodificata e pronta per
riprendere l’attività catalitica
2. devono essere efficaci in piccole quantità
3.
non devono influenzare l’equilibrio di una reazione
chimica reversibile: la costante di equilibrio è una
costante termodinamica caratteristica della reazione
4. devono mostrare specificità nella capacità
di accelerare le reazioni chimiche
Schematizzando
Esiste una relazione quantitativa tra la
concentrazione del substrato [S] e la velocità
della reazione enzimatica:
S+E
Equazione di
Michaelis - Menten
K1
K-1
V0
ES
Vmax S
K m S
K2
E+P
1.
Km = (K2 + K-1) / K1
2.
un solo substrato
Come si misura l’attività di un
enzima
Misura della velocità di formazione del
prodotto
O
Misura della velocità di scomparsa del
reagente
Preliminari
Preparare l’enzima
Preparare il substrato
Preparare il mezzo adatto
Procurarsi un metodo per la misura del
parametro “tempo”
Procurarsi un metodo che quantifichi la
formazione del prodotto o la scomparsa del
substrato nell’unità di tempo
tipi di saggi
Saggio discontinuo (stop and sample):
La reazione viene stoppata a tempi
diversi:
A tempo t0, t1, t2,….tn vengono prelevati
delle aliquote e misurate le
concentrazioni di prodotto o reagente
tipi di saggi
Saggio con misura in continuo:
La reazione enzimatica può essere
seguita per via spettroscopica:
Si segue l’aumento o la diminuzione, in
continuo, di un’assorbanza ad una
determinata lunghezza d’onda
Esempio di saggio stop and sample
Reazione dell’esocinasi:
Glucosio + ATP
Glucosio-6P + ADP
Non ci sono composti con cromofori che possono essere
rilevati spettroscopicamente!!!
Reazione dell’esocinasi
saggio stop and sample
A tempo t0, t1, t2,….tn vengono prelevati delle aliquote e
misurate le concentrazioni di prodotto o reagente dopo
averlo separato dalla miscela di reazione, per es per
cromatografia.
Svantaggi:
La quantificazione dei composti separati è laboriosa
(bisogna mettere a punto la tecnica, standardizzare)
Errori di manualità (prelievi a tempi ristretti)
C’è bisogno di notevoli quantità di campione perché il
substrato o il prodotto possano essere dosati
Soluzione:
Si può accoppiare la reazione ad una che
può essere seguita spettroscopicamente:
Per es: la reazione della glucosio 6fosfato deidrogenasi (G6PD)
Saggio in continuo:
esocinasi
Glucosio + ATP
Glucosio-6P + NADP+
G6PD
Glucosio-6P + ADP
6-fosfogluconato + NADPH
Si valuta la comparsa di NADPH a 340nm
La concentrazione di NADPH sarà proporzionale alla concentrazione di
Glucosio-6P prodotto dall’esocinasi
Vantaggi:
•Non c’è bisogno di fare prelievi
•Non bisogna stoppare la reazione
Spettro di assorbimento del NADPH
Forma ridotta
Adenosin
monofosfato
(AMP)
Nicotinammide
Mononucleotide
(NMN)
Forma ossidata
NAD+ (NADP+)
NADH (NADPH)
Una volta calcolata la velocità si può usare uno
dei seguenti parametri nella valutazione
dell’attività di un enzima
Applicazioni per la chimica
analitica
Quantizzazone di un metabolita
Le proteine come selezionatori:
gli anticorpi
Il legame antigene-anticorpo: Nella cellula
serve per riconoscere il “se” o l’estraneo (risposta
immunitaria)
Anticorpo
Antigene
Una tecnica immunologica:
l’ELISA (Enzyme linked immunosorbent assay)
Questa tecnica mima l’interazione fra due proteine
che si riconoscono in modo specifico e
complementare: l’antigene e l’anticorpo
Tipi di ELISA
Cosa serve
Applicazioni per la chimica
analitica
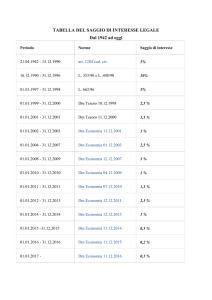
Calcolo della concentrazione di IL-2
in tre campioni biologici
B
7,5 15
30
60
1-Standard
B
7,5 15
30
60
2-Campione
3-Ab coniugato
Retta di taratura
Saggio biorad del 3/10/02
1
0,9
0,865
0,8
0,7
ABS
0,6
0,5
0,433
0,4
0,3
0,221
0,2
0,1 1 1
0,1
0
0
10
20
30
40
CONCENTRAZIONE IN ng
50
60
70