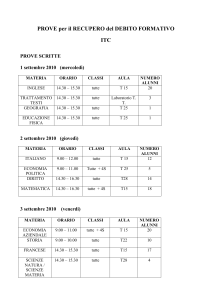
RABDOMIOSARCOMA DEL CUORE. STUDIO
ISTOLOGICO, IMMUNOISTOCHIMICO E
ULTRASTRUTTURALE DI UN CASO.
Fraternali Orcioni G (1), Ravetti JL (1) , Bocca B
(1), Dadati P (1) , Bisceglia M (2).
Struttura Complessa di Anatomia Patologica,
Azienda Ospedaliera Universitaria “San Martino”,
Genova (1); Unità Operativa Complessa di
Anatomia Patologica (2), IRCCS-Ospedale ”Casa
Sollievo della Sofferenza”, San Giovanni Rotondo.
• I sarcomi primitivi del cuore sono rari (prevalenza:
0.001%-0.28%).
• Essi rappresentano solo la minoranza (25%) di tutti
i tumori primitivi di quest’organo, e ne costituiscono
appena una esigua quota di tutti i tumori maligni che
lo possono colpire (frequenza 1:20-40 versus
metastasi) (1).
• Tra tutti i sarcomi, l’angiosarcoma è senza dubbio il
più frequente (35-40%) e il rabdomiosarcoma (RMS)
il più raro ( 5%).
• In assoluto, il numero dei rabdomiosarcomi cardiaci
trattati, nelle più ampie casistiche mondiali, visionate
mediamente per 25 anni, resta sempre per incidenza
globale intorno a 1-2 casi in tutto il periodo considerato
(2-5), e in alcune casistiche risulta persino assente (6-7).
• Peraltro, l’incidenza del RMS negli ultimi anni, a seguito
della applicazione di più rigorosi metodi di indagine per
la sua definizione e diagnosi, appare essersi ancora più
ridotta (nessun caso su 24 sarcomi primitivi in una
casistica di 18 anni revisionata con l’impiego di
metodiche di immunoistochimica (7).
Abbiamo osservato un caso di RMS primitivo del
cuore, studiato con analisi immunoistochimica e
ultrastrutturale.
Descrizione del caso.
Soggetto maschio, giovane, di anni 25, operato
per una neoformazione cardiaca, sospettata
come mixoma alla indagine TAC, delle
dimensioni di cm 7 circa, occupante l’atrio
sinistro, e debordante anche nel ventricolo
sinistro.
Voluminoso espanso intratriale sinistro, ipodenso.
Reperti anatomo-patologici
• All’esame patologico macroscopico, del campione
chirurgico pervenuto a fresco, neoplasia a contorni
policiclici, cm 7.5x5.6x4.8, di consistenza molle-elastica,
al taglio di aspetto fascicolato e colore bianco-grigiastro.
• All’esame citologico per scraping, neoplasia maligna a
cellule fusate con pleomorfismo, non ulteriormente
precisabile.
• All’esame istologico, neoplasia mesenchimale maligna,
di alto grado, composta di cellule fusate, per lo più
monomorfe, disposte in fascicoli, con alto indice mitotico
e focolai di necrosi, miste a una discreta quota di
elementi reattivi infiammatori, in assenza di cellule
tadpole o strap cells.
Striscio citologico da
scraping di frammenti della
neoplasia.
All’analisi immunoistochimica:
• immunoreattività diffusa per actina muscolospecifica/HHF35, desmina e miogenina, e focale
positività per fast-myosin e actina sarcomerica;
• positività citoplasmatica diffusa anche per WT-1
(NH2-terminus);
• debole positività per calponina;
• negatività per alpha-SMA, H-caldesmon, CD34,
EMA, CK-w.s., proteina S-100.
MSA/HHF35
Desmina
Miogenina
WT1/NH2-terminus
Diagnosi finale:
RMS embrionale, a cellule fusate
(varietà leiomiomatosa).
• Alla fine, guidati dai risultati dell’immunofenotipo,
è stato possibile individuare in occasionali
cellule anche la classica striatura trasversale,
marker morfologico di differenziazione
muscolare striata.
• All’esame in microscopia elettronica: reperto
compatibile con diagnosi di RMS con
individuazione di elettrondensità “Z-band-like”.
A
A. Cellule fusate poco differenziate.
N uclei con cromatina a zolle e
nucleoli multipli e compatti.
Citoplasma vacuolizzato per
RER dilatato e segni di endocitosi.
B
B. Interfaccia cellule stroma. Nella
Cellula ammassi di addensamenti
di filamenti contrattili con aspetto
“Z-band-like”.
Follow up
Paziente vivo 8 mesi dopo l’intervento chirurgico.
Terapia sinora effettuata
3 cicli di
doxorubicina liposomiale
(50 mg/m2 – una sola volta)
+
Ifofosfamide
(1.2 g/m2 x 5 giorni).
Discussione.
• Il RMS è per definizione un tumore mesenchimale maligno
con differenziazione muscolare striata, quest’ultima
documentabile in istologia, o in immunoistochimica, o in
microscopia elettronica.
• Il RMS primitivo del cuore colpisce prevalentemente
soggetti in età infantile e giovane.
• Coinvolge sempre il miocardio, pur potendo sporgere e
svilupparsi nelle cavità cardiache.
• Può avere estensione extracardiaca.
• Non ha aspetti distintivi alle indagini radiologiche e viene
spesso sospettato come mixoma.
• E’ pressoché sempre rappresentato dal tipo istologico
embrionale (quello alveolare è stato descritto in questa
sede solo come metastasi).
• La diagnosi è istologica e, tenuto conto della
stringenza dei criteri diagnostici, deve essere
eventualmente supportata da indagini speciali, in
caso di mancata documentazione in morfologia di
rabdomioblasti con striatura trasversale.
• La diagnosi differenziale si pone nei confronti del
fibrosarcoma, leiomiosarcoma, sinovialsarcoma
monofasico, e del sarcoma indifferenziato, ed è
oggigiorno risolta nella maggior parte dei casi grazie
in primo luogo alle indagini di immunoistochimica.
I marcatori di differenziazione muscolare striata più
impiegati sono la desmina, la mioglobina, l’actina
striata, la fast-myosin, il MyoD1, e la miogenina.
La miogenina, fattore di trascrizione nucleare, già
fisiologicamente espresso molto precocemente nella
embriogenesi delle cellule muscolari striate, è
ritenuta il marker più sensibile e altamente specifico
(8-9).
Il WT-1/NH2-terminus a noi venuto positivo (nel
citoplasma) può anch’esso essere considerato un
marcatore aggiuntivo (10).
• L’analisi in ME può risultare molto indaginosa, prima
di individuare aspetti differenziativi ultrastrutturali.
• Nel nostro caso i criteri diagnostici sono soddisfatti,
e la diagnosi di RMS embrionale è pienamente
giustificata.
• Il problema diagnostico differenziale principale è
stato rappresentato dal leiomiosarcoma (morfologia
simile).
• L’etichetta di varietà leiomiomatosa di RMS è
espressione proprio di quest’ultimo aspetto 11.
• E riteniamo che il nostro caso sia il primo di questa
varietà osservato a livello del cuore.
Bibliografia.
1.
Burke A, Virmani R.Tumors of the Heart and Great
Vessels. Atlas of Tumor Pathology. AFIP. 3rd Series.
Fascicle 16. Washington DC, 1996: 127-70.
2. Bear PA, et al. Chest. 1987;92:860-2.
3. Putnam JB Jr, et al. Ann Thorac Surg 1991;51:906-10.
4. Kamiya H, et al. Jpn Circ J 2001;65:315-9.
5. Fernandes F, et al. Arq Bras Cardiol 2001;76:231-7.
6. Tazelaar HD, et al. Mayo Clin Proc 1992;67:957-65.
7. Donsbeck AV, et al. Histopathology 1999;34:295-304.
8. Kumar S, et al. Mod Pathol 2000;13:988-93.
9. Folpe AL. Adv Anat Pathol 2002;9:198-203.
10. Carpentieri DF, et al. Mod Pathol 2002;15:1080-6.
11. Nascimento AF, et al. Am J Surg Pathol 2005;29:1106-13.