I criteri di spontaneità e di
equilibrio nelle reazioni in fase
gassosa
Le reazioni spontanee
Spesso si associa il concetto di
reazione spontanea ad una
reazione che produce calore:
certamente una reazione di
combustione avviene
spontaneamente e produce
calore. Sono le reazioni
spontanee più comuni ma
non le sole. Possono
avvenire spontaneamente
anche reazioni che
assorbono calore purché il
disordine aumenti.
Le reazioni di combustione
L’80% DELL’ENERGIA CONSUMATA DERIVA DALLA COMBUSTIONE
DEI COMBUSTIBILI FOSSILI, CARBONE, PETROLIO, METANO
ORA:
CARBONE + O2(aria)
CO2 + H2O + calore
PETROLIO + O2(aria)
CO2 + H2O + calore
CH4 + 2 O2(aria)
CO2 + 2 H2O + calore
NEL FUTURO (?)
2 H2 + O2
2 H2O + calore
PERCHE’ LE REAZIONI AVVENGONO NEL SENSO SCRITTO E NON
IN SENSO OPPOSTO ?
PIU’ IN GENERALE, E’ POSSIBILE PREVEDERE IN QUALE SENSO
PROCEDE UNA REAZIONE E QUALI SONO LE CONDIZIONI DI T
E P PER CUI UNA REAZIONE AVVIENE IN UN SENSO ?
La combustione del petrolio
PETROLIO + O2(aria)
CO2
+ H2O + calore
La combustione è una reazione
di ossidazione in cui
l’ossidante è l’ossigeno
dell’aria (il comburente, la
specie che si riduce) mentre
il petrolio è il riducente (il
combustibile, la specie che si
ossida). E’ molto veloce e
produce molto calore
Il petrolio è una miscela di
decine di sostanze organiche
diverse: non è un composto
e quindi non si può scrivere
una reazione stechiometrica.
La combustione del metano
CH4 + 2 O2(aria)
CO2 + 2 H2O + calore
Il metano è un composto
e quindi si può scrivere
la reazione
stechiometrica di
ossidazione con
l’ossigeno dell’aria.
La “combustione” dell’idrogeno
NEL FUTURO (?)
2 H2 + O2
2 H2O +
energia elettrica
Nelle celle a combustibile la
reazione di “combustione”
dell’idrogeno è fatta avvenire
in un sistema elettrochimico
in modo tale da produrre
energia elettrica (in
prevalenza).
La combustione dell’idrogeno
NEL FUTURO (?)
2 H2 + O2
calore
2 H2O +
L’idrogeno può essere
usato per alimentare un
motore a combustione
interna.
Stazione di rifornimento di H2 liquido
La combustione dell’idrogeno
NEL PRESENTE:
2 H2 + O2
calore
2 H2O +
I razzi di spinta della
navicella spaziale
Challenger sono
alimentati da idrogeno
ed ossigeno liquido
La reversibilità delle reazioni
Le reazioni possono avvenire in ambedue i sensi, da
sinistra a destra e, viceversa, da destra a sinistra.
PERCHE’ LE REAZIONI PRECEDENTI AVVENGONO NEL
SENSO SCRITTO E NON IN SENSO OPPOSTO ?
PIU’ IN GENERALE, E’ POSSIBILE PREVEDERE IN
QUALE SENSO PROCEDE UNA REAZIONE E QUALI
SONO LE CONDIZIONI DI T E P PER CUI UNA
REAZIONE AVVIENE IN UN SENSO ?
Le costanti di equilibrio di una reazione
La reazioni di sintesi dell’ammoniaca dalle sostanze elementari è:
N2 + 3 H2
2 NH3
Alla fine della reazione si stabilisce un equilibrio fra reagenti e
prodotti; le concentrazioni molari o le pressioni di ciascuna specie
all’equilibrio sono legate fra loro dalle relazioni:
[NH3]2
P2 (NH3)
[N2][H2]3
P(N2)P 3(H2)
Questi rapporti sono le costanti di equilibrio della reazione
espresse mediante le concentrazioni molari (Kc) e le pressioni
parziali (Kp).
Le costanti di equilibrio di una reazione
Le due costanti di equilibrio della reazione
N2 + 3 H2
2 NH3
hanno i valori: Kc(298) = 5.108; Kp (298)= 6.105 e dipendono
soltanto dalla temperatura.
Un valore grande della costante di equilibrio (>> 1) significa che la
reazione è spostata a destra.
Per la reazione fra azoto ed ossigeno:
N2 + O2
2 NO
le costanti di equilibrio (dipendono solo dalla temperatura) sono:
[NO]2
P 2 (NO)
Kc =
= Kp =
= 1.10-30 (298)
[N2][O2]
P (N2)P (O2)
Un valore piccolo (<< 1) della costante di equilibrio significa che la
reazione è spostata a sinistra.
Reazioni spostate a destra e a sinistra
La reazione dell’ammoniaca
N2 + 3 H2
2 NH3
spostata a destra significa che all’equilibrio, quando la
reazione è finita, i prodotti sono in prevalenza rispetto
ai reagenti, cioè dalla reazione si è formata l’ammoniaca.
La reazione dell’ossido di azoto
N2 + O2
2 NO
spostata a sinistra significa che alla fine della reazione,
all’equilibrio, l’ossido di azoto si è formato in quantità trascurabili.
In concreto, la reazione dell’ammoniaca avviene, quella dell’ossido
di azoto non avviene a 298 K. Nulla si può dire sul tempo
necessario ad avvenire.
La costante di equilibrio dipende solo da T
L’idrogeno viene prodotto mediante la reazione:
CH4 + 2 H2O
CO2 + 4 H2
P 4(H2)P(CO2)
Kp =
= 1,6.10-23 (298)
P(CH4)
La reazione è completamente spostata a sinistra a temperatura
ambiente (l’acqua è liquida a 298 K e non compare nella costante
di equilibrio).
P 4(H2)P(CO2)
Kp =
= 3,5.102 (700)
P(CH4)P 2(H2O)
La reazione è spostata a destra ad alta temperatura (H2O è
un gas a 700 K e quindi vi compare).
La variazione di entalpia, di entropia e di
energia libera delle reazioni
La costante di equilibrio di una reazione è utile per
sapere se una reazione è spostata a destra o a
sinistra all’equilibrio, cioè alla fine della reazione
(alla temperatura a cui è riferita Kc o Kp).
Le variazioni di entalpia ( H° ), di entropia ( S° ) e di
energia libera ( G° ) di una reazione fanno
prevedere in che senso procede una reazione per
arrivare all’equilibrio e definiscono le condizioni di
spontaneità e di equilibrio di una reazioni per
qualunque valore di T e di P.
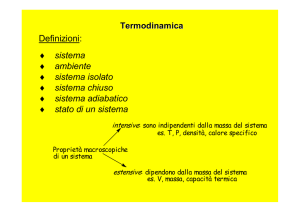
Lo scambio di calore fra un sistema e
l’ambiente
L’acqua acquistando calore si
scalda perché aumenta la
propria energia cinetica: la
temperatura dell’acqua
aumenta.
Spengendo la piastra
riscaldante l’acqua cede
calore all’ambiente esterno e
si raffredda: diminuisce la
sua energia cinetica e la sua
temperatura diminuisce.
Lo scambio di calore fra un sistema e
l’ambiente
Calore ceduto
dall’ambiente al sistema
significa processo
endotermico, Q > 0.
Calore ceduto dal sistema
all’ambiente significa
processo esotermico,
Q< 0
Espansione del gas ideale nel vuoto
L’espansione avviene
senza alcuna pressione
che si opponga per cui il
sistema non crea un
lavoro di espansione
P (V2 - V1) = 0
Nell’espansione del gas
ideale non viene
scambiato calore fra
l’ambiente ed il sistema.
Espansione di un gas reale nel vuoto
Anche nell’espansione del gas
reale nel vuoto non viene creato
lavoro ma in questo caso
aumenta l’energia potenziale
del gas perché le molecole si
allontanano reciprocamente e
quindi le loro interazioni
reciproche diminuiscono. Il
sistema assorbe calore
dall’ambiente. L’espansione di
un gas reale è un processo
endotermico. Se il sistema
non scambia calore con
l’ambiente, diminuisce l’energia
cinetica del gas.
Espansione isoterma di un gas con una
pressione che si oppone all’espansione
Se un gas reale si espande contro una pressione P (costante) che si
oppone, il sistema compie un lavoro
L = P (V2 – V1) = PV
Espansione isoterma di un gas con una
pressione che si oppone all’espansione
Inoltre, il gas espandendosi aumenta la propria energia potenziale.
Il sistema assorbe calore dall’ambiente esterno (processo
endotermico). Il calore ( Q ) scambiato a P e T costanti è uguale
alla variazione di entalpia del sistema:
Q (T ,P )= P V + E pot = H
La variazione di entalpia ( H ) in
una trasformazione è uguale al
calore scambiato fra il sistema e
l’ambiente a temperatura e
pressione costanti.
In una trasformazione esotermica
H < 0, in una trasformazione
endotermica
H > 0
L’entalpia di formazione delle sostanze a
condizioni standard (T = 298 K; P = 1
atm delle sostanze gassose)
La reazione di formazione di 1 mole di una sostanza a partire dalle
sostanze elementari alla temperatura di 298 K ed alla pressione
di 1 atm delle sostanze gassose definisce l’entalpia standard di
formazione di una sostanza:
½ N2 + 3/2 H2
½ N2 + ½ O2
C + ½ O2
C + O2
H°
NH3
NO
CO
CO2
H°
H°
f
= - 46,2 kJ mol-1
f
f
= 90,4 kJ mol-1
= - 111 kJ mol-1
H° f = - 394 kJ mol-1
Il joule ( J ) è l’unità di misura
dell’energia nel Sistema Internazionale
1 J = 0,239 cal
1 J = 1.107 erg
1 kJ = 103 J
L’entalpia standard di reazione
(T = 298 K ; P = 1 atm)
L’entalpia di reazione alle condizioni standard è la differenza fra
l’entalpia standard di formazione dei prodotti e quella dei
reagenti (ciascuna moltiplicata per il rispettivo coefficiente di
reazione).
L’entalpia della reazione del metano con ossigeno (reazione di
combustione) è:
CH4 + 2 O2
CO2 + 2 H2O
H °reaz = H°f(H2O)(kJ mol-1) x 2 (mol) + H °f(CO2)(kJ mol-1) x
1 (mol) - H°f(CH4)(kJ mol-1) x 1 (mol) = - 803 kJ
La reazione è esotermica.
(H °f(O2) = 0, come per tutte le sostanze elementari nella loro
forma stabile a 298 K e 1 atm).
L’entalpia standard di reazione
(T = 298 K ; P = 1 atm)
L’entalpia della reazione del metano con vapor d’acqua
(reazione con cui si produce l’idrogeno):
CH4 + 2 H2O
CO2 + 4 H2
H °reaz = + H °f(CO2)(kJ mol-1) x 1 (mol) H°f(H2O)(kJ mol-1) x 2 (mol) - H°f(CH4)(kJ mol-1) x
1 (mol) = 253 kJ
La reazione è endotermica.
Il principio di Le Chatelier
E’ un criterio empirico per prevedere in che senso si sposta una
reazione quando si variano la temperatura, la pressione o la
concentrazione delle specie all’equilibrio.
Un aumento di temperatura fa spostare a sinistra una reazione
esotermica e a destra una reazione endotermica.
La reazione endotermica: CH4 + 2 H2O
CO2 + 4 H2
è favorita da un aumento di T
Un aumento della pressione favorisce una reazione in cui
diminuisce il numero dei prodotti rispetto ai reagenti
N2 + 3 H2
2 NH3
La sintesi dell’ammoniaca è favorita da un aumento di P
La variazione di entropia
Un gas reale si espande in un
recipiente vuoto anche se il
processo è endotermico. La
contrazione di un gas reale è
un processo esotermico ma
non avviene. Perché?
La risposta sta nella variazione
di entropia. Da (a) a (b)
l’entropia cresce: un sistema
tende a evolversi nel senso
in cui l’entropia aumenta.
A
L’entropia assoluta ( S )
S = k log W
k = 1,381.1023 J K-1 è la
costante di Boltzmann, una
delle costanti fondamentali. Il
simbolo W che definisce
l’entropia è legato al numero
dei modi con cui gli atomi o le
molecole si dispongono in uno
stato a parità di energia.
L’entropia dell’acqua
Alla temperatura di 0,0098 °C
ed alla pressione di 4,58
mmHg le tre fasi dell’acqua
sono in equilibrio fra loro:
l’entropia del gas è maggiore
di quella del liquido che a
sua volta è maggiore di
quella del solido. L’entropia è
una grandezza che cresce
con l’aumento del
disordine molecolare.
L’entropia di un cristallo ideale a 0 K è
zero
In un cristallo ideale a 0 K tutti
gli atomi si dispongono
secondo un ordine preciso
nelle rispettive posizioni del
reticolo cristallino. C’è un
solo modo di disporre gli
atomi: W = 1 e per
conseguenza S = 0.
L’entropia di una sostanza reale
è sempre maggiore di zero e
cresce con T e con la propria
complessità strutturale e
molecolare.
L’entropia di un gas
In un gas esistono
moltissimi modi di
disporre le molecole
nello spazio pur
mantenendo la stessa
energia.
Il gas ha il massimo valore
dell’entropia.
La variazione di entropia di una reazione
La variazione di entropia di una reazione si calcola dalla
differenza fra entropia assoluta S° dei prodotti e
quella dei reagenti (ciascun valore moltiplicato per il
rispettivo coefficiente stechiometrico):
CH4 + 2 H2O
CO2 + 4 H2
S° = S° (H2)(J mol-1 K-1) x 4(mol) + S° (CO2)(J mol-1
K-1) x 1(mol) - S° (H2O)(J mol-1 K-1) x 2(mol) –
S° (CH4)(J mol-1 K-1) x 1(mol) = 410 J K-1
La spontaneità delle trasformazioni legate
alle variazioni di H ed S.
Le reazioni sono favorite da
diminuzione dell’entalpia
H < 0
aumento dell’entropia
S > 0
Una reazione di combustione è
sicuramente spontanea perché
esotermica e perché l’entropia
aumenta formandosi sostanze
gassose che hanno anche alta
temperatura.
La variazione di energia libera ( G ) di una
reazione
La variazione di energia libera è
il criterio generale di
spontaneità e di equilibrio di
una trasformazione:
G < 0 avviene
G > 0 non avviene
G = 0 equilibrio
La variazione di energia libera
tiene conto sia della
variazione di entalpia che
dell’ entropia
G =
H
- T S
L’energia libera di formazione delle
sostanze a condizioni standard (T = 298
K; P = 1 atm delle sostanze gassose)
La reazione di formazione di 1 mole di una sostanza a partire dalle
sostanze elementari alla temperatura di 298 K ed alla pressione
di 1 atm delle sostanze gassose definisce l’energia libera
standard di formazione di una sostanza:
½ N2 + 3/2 H2
½ N2 + ½ O2
C + ½ O2
C + O2
G°
f
= - 16,6 kJ mol-1
NO G°
f
= 86,7 kJ mol-1
NH3
CO
CO2
G°
f
= - 137 kJ mol-1
G° f = - 395 kJ mol-1
L’energia libera standard di reazione
(T = 298 K ; P = 1 atm)
L’energia libera di reazione alle condizioni standard è la differenza
fra l’energia libera standard di formazione dei prodotti e quella
dei reagenti (ciascuna moltiplicata per il rispettivo coefficiente di
reazione).
L’energia libera della reazione del metano con ossigeno (reazione di
combustione) è:
CH4 + 2 O2
CO2 + 2 H2O
G°reaz = G°f(H2O)(kJ mol-1) x 2 (mol) + G °f(CO2)(kJ mol-1)
x 1 (mol) - G°f(CH4)(kJ mol-1) x 1 (mol) = - 802 kJ
La reazione è spontanea
(Le sostanze elementari a 298 K e 1 atm hanno G°f = 0)
L’energia libera standard di reazione
(T = 298 K ; P = 1 atm)
L’energia libera della reazione del metano con vapor
d’acqua (reazione con cui si produce l’idrogeno):
CH4 + 2 H2O
CO2 + 4 H2
G °reaz = G°f(CO2)(kJ mol-1) x 1 (mol) –
G°f(H2O)(kJ mol-1) x 2 (mol) - G°f(CH4)(kJ mol-1) x
1 (mol) = 114 kJ
La reazione non è spontanea.
La relazione fra energia libera di una
reazione e la sua costante di equilibrio
L’energia libera standard di una reazione permette di
calcolare la costante di equilibrio di una reazione
G°(reaz)(T) = - RT lnKp
a qualunque temperatura.