TERAPIA DELL’INSUFFICIENZA CARDIACA
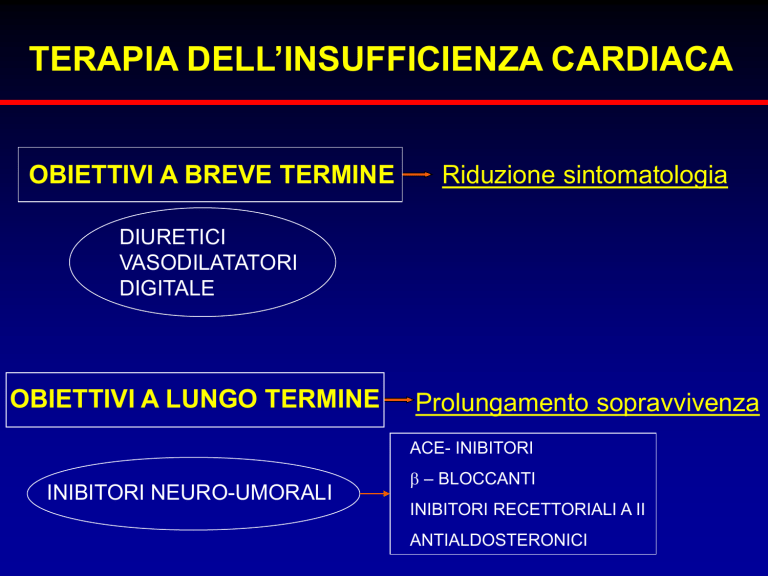
OBIETTIVI A BREVE TERMINE
Riduzione sintomatologia
DIURETICI
VASODILATATORI
DIGITALE
OBIETTIVI A LUNGO TERMINE
Prolungamento sopravvivenza
ACE- INIBITORI
INIBITORI NEURO-UMORALI
b – BLOCCANTI
INIBITORI RECETTORIALI A II
ANTIALDOSTERONICI
DIURETICI
Utilizzati per contrastare ritenzione idro-salina
Fondamentali nei pazienti con evidenza di sovraccarico di volume
Rapido miglioramento di dispnea e tolleranza all’esercizio fisico
Sempre associati ad ace-inibitori e beta-bloccanti
Un loro uso appropriato è elemento chiave per il successo degli
altri farmaci. E’ necessario adeguamento della posologia dopo
il raggiungimento del “peso secco”
EFFETTO SULLA SOPRAVVIVENZA NON DOCUMENTATO
DA TRIALS CLINICI RANDOMIZZATI E CONTROLLATI
DIURETICI TIAZIDICI (SCOMPENSO LIEVE)
DIURETICI DELL’ANSA: FUROSEMIDE (SCOMPENSO MODERATO)
AUMENTARE DOSE O FREQUENZA DI SOMMINISTRAZIONE
O SOSTITUIRE CON TORASEMIDE
AGGIUNGERE TIAZIDICO (METOLAZONE)
FUROSEMIDE O TORASEMIDE EV SE SCOMPENSO REFRATTARIO
(EVENTUALMENTE IN ASSOCIAZIONE CON INOTROPI EV)
Digoxin
A neurohormonal mediator in heart failure ?
unico inotropo non tachicardizzante
azione “vagomimetica”
riduzione attività adrenergica
ridotta sintesi e secrezione di renina
Gheorghiade M, Ferguson D. Circulation 1991; 84: 2181-85
DIG Trial. NEJM, 1997; 336: 525-33.
DIG Trial. NEJM, 1997; 336: 525-33.
La digitale è indicata :
nei pazienti con scompenso sintomatico, EF < 40% e
fibrillazione atriale per ridurre la frequenza
ventricolare (classe I, C)
nei pazienti in ritmo sinusale con sintomi di
scompenso cardiaco ed EF < 40% per migliorare i
sintomi e ridurre le ospedalizzazioni (classe IIa, B)
Linee Guida ESC 2008
POSOLOGIA
0.25-0.125 mg/dì, dosi inferiori nei pazienti
anziani, con disfunzione renale o con basso
peso corporeo (0.125-0.0625)
Concentrazione
0.5-0.9 ng/ml
plasmatica
raccomandata
Gheorghiade M. et al. J Am Coll Cardiol 2002; 39:946-953
VASODILATATORI
Non hanno indicazione specifica nello
scompenso cardiaco cronico.
Terapia aggiuntiva in caso di angina o
ipertensione arteriosa (classe IA).
Utilizzati nello scompenso cardiaco acuto.
Vasodilatatori
Idralazina-isosorbide dinitrato: in caso di intolleranza ad ace-inibitori
e sartanici
Nitrati: in presenza di angina concomitante o per alleviare la dispnea
Calcio-antagonisti diidropiridinici: per il trattamento di ipertensione
arteriosa o angina concomitante, non controllate con nitrati e betabloccanti. Effetto neutro sulla sopravvivenza
Calcio-antagonisti con effetto inotropo negativo: sconsigliati.
Controindicati in associazione ai beta-bloccanti
Alfa-bloccanti: non evidenza a favore del loro utilizzo nello scompenso
Nesiritide: esperienza clinica ancora limitata
FARMACI ANTI NEURO-UMORALI
Negli ultimi 20 anni il maggiore progresso nel
trattamento dell’insufficienza cardiaca cronica
è stato l’utilizzo di farmaci ANTI NEUROUMORALI che determinano un miglioramento
della prognosi.
SCOMPENSO CARDIACO
Volemia
MECCANISMI COMPENSATORI
FC
Aumento contrattilità
Ipertrofia miocardica
SISTEMI NEURO-UMORALI
PORTATA CARDIACA E PERFUSIONE
TISSUTALE ADEGUATE
RIMODELLAMENTO
DETERIORAMENTO FUNZIONE CARDIACA
PROGRESSIONE SINDROME
FARMACI ANTI NEURO-UMORALI
ACE-INIBITORI
BETA-BLOCCANTI
INIBITORI RECETTORIALI DELL’ANGIOTENSINA
ANTIALDOSTERONICI
ACE-INHIBITORS
A cornerstone in the treatment of heart failure
Editorial – VHeFT II and SOLVD Treatment
Braunwald, NEJM 1991; 325: 351-53
Trials clinici con ACE-inibitori
CONSENSUS 10-year follow-up
All randomized patients, original and follow-up
Mortality
1.0
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0.0
p=0.008
Placebo
Enalapril
1
2
3
4
5
6
Year
7
8
9
10
11
Swedberg et al, EHJ 1999
ACE-inhibitors in patients with CHF
(data on 7105 pts from 34 trials)
Total mortality
Sudden death
21.9%
ACE-inhibitors
Control
15.8%
4.7%
OR
95%CI
0.77
0.67-0.88
5.8%
0.91
0.73-1.12
Garg R et al JAMA 1995; 273: 1450-1456
INDICAZIONI DEGLI ACE-I
Devono essere somministrati in tutti i pazienti con
scompenso cardiaco sintomatico ed EF < 40% nei
quali determinano: miglioramento della funzione
ventricolare sin, riduzione dei sintomi e delle
ospedalizzazioni per scompenso cardiaco, aumento
della sopravvivenza.
Linee Guida ESC 2008
EFFETTI COLLATERALI
TOSSE (5-10%)
ANGIOEDEMA (<1%)
IPOTENSIONE
INSUFFICIENZA RENALE
IPERPOTASSIEMIA
MODALITA’ DI IMPIEGO DEGLI ACE-I
INIZIARE CON DOSI BASSE, PREFERIBILMENTE LA SERA
RIDURRE O SOSPENDERE I DIURETICI 24 ORE PRIMA
INCREMENTARE LA DOSE DOPO 2-4 SETTIMANE
N.B. CONTROLLARE POTASSIEMIA E CREATININEMIA :
a 1-2 settimane dall’inizio della terapia
a 1 e 4 settimane dall’aumento della dose
a 1, 3 e 6 mesi dopo la dose di mantenim.
ogni 6 mesi successivamente
Linee Guida ESC 2008
POSOLOGIA
EFFETTI COLLATERALI
In corso di terapia con ace-inibitori:
se CREATININEMIA 3-3.5 mg/dl dimezzare la dose
se > 3.5 mg/dl interrompere il trattamento
se POTASSIEMIA > 5.5 mmol/l dimezzare la dose
se > 6 mmol/l interrompere il trattamento
LG ESC 2008
CONTROINDICAZIONI DEGLI ACE-I
STORIA DI ANGIOEDEMA
STENOSI BILATERALE DELL’A. RENALE
POTASSIEMIA > 5 mEql/l
CREATININEMIA > 2.5 mg/dl
STENOSI AORTICA SEVERA
ACE escape
Inibizione incompleta da parte degli ACE-inibitori dei
sistemi renina angiotensina tissutali
Incremento, dopo mesi di terapia, dei livelli
plasmatici di angiotensina II e di aldosterone
Sviluppo di strategie aggiuntive / alternative
antagonisti dell’aldosterone
bloccanti dei recettori dell’angiotensina II
Angiotensin System
Non-ACE Pathways
(tonin, chymase, CAGE)
•
Angiotensinogen
Renin
• Vasoconstriction
• Cell growth
• Na/H20 retention
• Sympathetic
activation
Aldosterone
AT1
Angiotensin I
Angiotensin II
AT2
ACE
Cough,
Angioedema
? Preconditioning
Bradykinin
B2
Inactive
Fragments
• Vasodilation
• Antiproliferation
(kinins)
Losartan Heart Failure Survival Study
ELITE II
Study Design
NYHA II-IV; EF 40%
N=3152
CAPTOPRIL
LOSARTAN
50 mg 3 times daily
(N=1574)
50 mg Daily
(N=1578)
Primary Endpoint:
All-Cause Mortality
J Card Fail 1999
ELITE II
- Primary Endpoint: All-Cause Mortality -
Probability of Survival
1,0
0,8
0,6
Captopril (n-1574) 250 Events
Losartan (n-1578) 280 Events
15.9 % over 1.5 years
17.7 % over 1.5 years
0,4
0,2
p=0.16
Average Mean Mortality Rate = 11.0 % per year
0,0
0
100
200
300
400
500
Days of Follow-up
600
700
Pitt, B. et al, Lancet 2000; 355:1582-87
Losartan Heart Failure Survival Study - ELITE II
Withdrawal for Adverse Experience (Excluding Death)
20
% of Patients
Losartan (N=1578)
15
**
Captopril (N=1574)
** p0.001
10
**
5
0
**
Any AE
Drug-Related AE
Cough
HF
Preliminary Results - AHA ‘99
ELITE II
CONCLUSIONS
ELITE II did not confirm the hypothesis that losartan was superior
to captopril in improving survival in patients with heart failure due
to systolic left ventricular dysfunction
ELITE II did confirm that losartan was significantly better tolerated
than captopril with fewer discontinuations due to adverse
experiences
ELITE II
IMPLICATIONS
ACE-inhibitors remain the therapy of choice
Angiotensin
II
antagonists
may
be
considered in patients in whom ACE-inhibitors
are not tolerated
CHARM Programme
3 component trials comparing candesartan
to placebo in patients with symptomatic heart failure
CHARM
Alternative
CHARM
Added
CHARM
Preserved
n=2028
n=2548
n=3025
LVEF 40%
ACE inhibitor
intolerant
LVEF 40%
ACE inhibitor
treated
LVEF >40%
ACE inhibitor
treated/not treated
Primary outcome for each trial: CV death or CHF hospitalisation
Primary outcome for Overall Programme: All-cause death
CHARM-Alternative
Patient disposition
2028 patients randomised
NYHA II-IV
LVEF 40%
Candesartan
Placebo
n=1013
n=1015
Lost to
follow-up
n=2
Lost to
follow-up
n=1
Completed Study
Completed Study
n=1011
n=1014
Median follow-up of 34 months
CHARM-Alternative
CV death or CHF hospitalisation
50
%
406 (40%)
Placebo
40
334 (33%)
30
Candesartan
20
10
HR 0.77 (95% CI 0.67-0.89), p=0.0004
Adjusted HR 0.70, p<0.0001
0
0
Number at risk
Candesartan 1013
Placebo
1015
1
2
929
887
831
798
3
3.5 years
434 122
427 126
ARB
Sono raccomandati nei pazienti intolleranti agli
ace-inibitori, nei quali si sono dimostrati in grado
di ridurre il rischio di morte per cause
cardiovascolari e la necessità di ricovero per
aggravamento dello scompenso cardiaco.
(classe di raccomandazione I, livello di evidenza B)
Linee Guida ESC 2008
Is the combination of an ARB and
ACE-inhibitor more efficacious
than ACE-inhibitor monotherapy ?
AMI
VALIANT
2002
CHF
Val-HeFT
CHARM
2000
2002
Valsartan Heart Failure Trial
Study Design
5010 patients
18 yr; EF<40%; NYHA II–IV
Receiving Standard
Therapy including ACE
inhibitors,diuretics
digoxin, bblockers,(stratified
randomization)
Randomized to
Valsartan
40 mg bid titrated
to160 mg bid
Placebo
906 deaths (events reported)
J. N. Cohn et. al, J. Card. Fail. 1999; 5: 155-160
Val-HeFT: All-Cause Mortality
Survival Probability
1.00
0.95
0.90
P = 0.8
0.85
Valsartan
0.80
Placebo
0.75
0.70
0
0
3
6
9
12
15
18
Time Since Randomization (mo)
21
24
27
Cohn JN et al. N Engl J Med. 2001;345:1667-1675.
Val-HeFT: Heart Failure-Related
Hospitalizations*
100
Valsartan
Placebo
95
90
85
Event-Free
Probability
80
75
27.5% risk reduction
70
P <0.00001
65
0
0
3
6
9
12
15
Months
*First hospitalization.
Cohn JN et al. Circulation. 2000;102:2672b.
18
21
24
27
30
Combined Morbidity/Mortality in subgroups
% Patients Favors Valsartan
Favors Placebo
All Patients100
< 65
65
Male
Female
EF < 27
EF 27
ACEI (Yes)
ACEI (No)
BB (Yes)
BB (No)
IHD (Yes)
IHD (No)
47
53
80
20
50
50
93
7
35
65
57
43
0.3 0.4 0.5 0.6 0.7 0.8 0.9
1
1.1 1.2 1.3 1.4
CHARM Programme
3 component trials comparing candesartan
to placebo in patients with symptomatic heart failure
CHARM
Alternative
CHARM
Added
CHARM
Preserved
n=2028
n=2548
n=3025
LVEF 40%
ACE inhibitor
intolerant
LVEF 40%
ACE inhibitor
treated
LVEF >40%
ACE inhibitor
treated/not treated
Primary outcome for each trial: CV death or CHF hospitalisation
Primary outcome for Overall Programme: All-cause death
CHARM-Added
Patient disposition
2548 patients randomised
NYHA II-IV
LVEF 40%
Candesartan
Placebo
n=1276
n=1272
Lost to
follow-up
n=3
Lost to
follow-up
n=1
Completed Study
Completed Study
n=1273
n=1271
Median follow-up of 41 months
CHARM-Added: CV death or
CHF hospitalisation
50
%
Placebo
40
538 (42.3%)
483 (37.9%)
30
Candesartan
20
10
HR 0.85 (95% CI 0.75-0.96), p=0.011
Adjusted HR 0.85, p=0.010
0
0
Number at risk
Candesartan 1276
Placebo
1272
1
2
1176
1136
1063
1013
3
3.5 years
948 457
906 422
CHARM-Added:
Prespecified
subgroups, CV death or CHF hosp
p-value for
treatment
interaction
Candesartan Placebo
BetaYes
blocker No
223/702 274/711
260/574 264/561
0.14
Recom. Yes
dose of No
ACE inhib.
232/643 275/648
251/633 263/624
0.26
All patients
483/1276 538/1272
0.6
0.8
candesartan
better
1.0
Hazard
ratio
1.2
1.4
placebo
better
ARB
Sono raccomandati nei pazienti con persistente
sintomatologia (classe NYHA II-IV) nonostante
terapia ottimale con ACE-inibitori e betabloccanti a condizione che non ricevano anche
antialdosteronici, nei quali si sono dimostrati in
grado di ridurre la necessità di ricovero per
aggravamento dello scompenso cardiaco.
(classe di raccomandazione I, livello di evidenza A)
Linee Guida ESC 2008
VALIANT Trial Design
Eligible Patients
1 Acute MI >12 hours and <10 days
2 Signs or symptoms of CHF or LVD
Stepwise titration,
maximum tolerated dose
Target
Doses
Captopril
Captopril
50
50mg
mgtid
Randomize (N = 14,808)
Valsartan
160 mg bid
C
tid +
C50
50 mg
mgtid+
VV80
80mg
mgbid
bid
Primary End Point: All-Cause Mortality
Pfeffer MA et al. Am Heart J. 2000;140;727-50.
ARBs Post MI
Comparators
Endpoint
OPTIMAAL (2002)
VALIANT (2003)
Losartan
Captopril
Valsartan
Captopril
Valsartan + Captopril
All-cause mortality
CONTROINDICAZIONI DEGLI ARB
STENOSI BILATERALE DELL’A. RENALE
POTASSIEMIA > 5 mEql/l
CREATININEMIA > 2.5 mg/dl
MODALITA’ DI IMPIEGO DEGLI ARB
INIZIARE CON DOSI BASSE
(Candesartan 4-8 mg/die
Valsartan 40 mg/bid)
INCREMENTARE LA DOSE DOPO 2-4 SETTIMANE
N.B. CONTROLLARE POTASSIEMIA E CREATININEMIA :
a un mese dall’inizio della terapia
a 1 e 4 settimane dall’aumento della dose
a 1, 3 e 6 mesi dopo la dose di mantenim.
ogni 6 mesi successivamente
Linee Guida ESC 2008
ALDOSTERONE
fibrosi miocardica e vascolare
riassorbimento sodio e ritenzione idrica ed
escrezione di potassio a livello del nefrone distale
stimolo alla sete (anche Angio II)
attivazione simpatica e inibizione parasimpatica
disfunzione barorecettoriale
RALES. NEJM 1999; 341: 709-17.
Effect of spironolactone on mortality in patients
with severe heart failure.
The Rales study (n. 1663 pts)
Total mortality
Sudden death
45.8%
Spironolactone
34.5%
Placebo
9.9%
OR
95%CI
0.70
0.60-0.82
13.1%
0.71
0.54-0.95
ARB in classe NYHA II
AREA IN-CHF:
canrenone 50 mg vs placebo in pz con scompenso cardiaco
lieve-moderato (cl. NYHA II): riduzione del rimodellamento
V sin, miglioramento della EF V sin, della classe NYHA,
riduzione dei livelli di BNP, di morte ed ospedalizzazione per
cause cardiovascolari
EMPHASIS HF:
eplerenone in pz con scompenso cardiaco lieve-moderato (cl.
NYHA II): riduzione del rischio di morte cardiovascolare o
di ospedalizzazione per insufficienza cardiaca
ANTIALDOSTERONICI
Sono raccomandati in aggiunta ad ace-i, betabloccanti e diuretici :
nello scompenso cardiaco avanzato (classe IIIIV) per ridurre mortalità e morbidità (classe di
raccomandazione I, livello di evidenza B)
nel post-infarto in pazienti con disfunzione
sistolica ventricolare e scompenso cardiaco o
diabete (classe di raccomandazione I, livello di
evidenza B)
Linee Guida ESC 2008
EFFETTI COLLATERALI
IPERPOTASSIEMIA
INSUFFICIENZA RENALE
GINECOMASTIA
N.B. CONTROLLARE POTASSIEMIA E CREATININEMIA :
a 1 e 4 settimane dall’inizio della terapia
a 1 e 4 settimane dall’aumento della dose
a 1, 2, 3 e 6 mesi dopo la dose di mantenim.
ogni 6 mesi successivamente
CONTROINDICAZIONI DEGLI ANTIALDOSTERONICI
CREATININEMIA > 2.5 mg/dl o CLEARANCE < 30 ml/min
POTASSIEMIA > 5 mEq/L
TP. CON ACE-INIBITORI + SARTANI
Dose iniziale 25 mg, da aumentare dopo 4-8 settimane
SE CLEARANCE DELLA CREATININA < 50 mL/min
ridurre la dose iniziale di spironolattone a 12.5 mg
I BETA BLOCCANTI:
C’E’ANCORA RAGIONE DI
TEMERLI ?
Effetti sfavorevoli
dell’iperattivazione simpatica
Downregulation dei recettori beta1
Cardiotossicità (apoptosi, necrosi)
Ipertrofia e fibrosi miocardica (rimodellamento
ventricolare)
Tachicardia (ischemia miocardica,
riempimento ventricolare)
Aumento di PA per vasocostrizione periferica
Induzione tachiaritmie
Attivazione RAAS
tempo
di
Differenze farmacologiche dei b-bloccanti
approvati per lo scompenso cardiaco
Blocco
b1
Blocco
b2
Blocco
a1
ISA
Carvedilolo
+++
+++
+++
-
*
Metoprololo
+++
-
-
-
-
Bisoprololo
+++
-
-
-
-
Nebivololo
+++
-
-
-
**
*antiossidante, antiproliferativo
**proprietà vasodilatanti (nitrossido)
Effetti
ancillari
I grandi trials con beta bloccanti nello
scompenso cardiaco
TRIAL (anno)
Farmaco
PAZ
(n.)
Eziologia
NYHA
(I-IV)
FE
(%)
FUP
(mesi)
MDC (‘93) Metoprololo
383
Idiopatica
II-III
22%
5
CIBIS (‘94) Bisoprololo
641
Mista
III
25%
21
ANZ trial (‘95) Carvedilolo
415
Ischemica
I-III
29%
18
US-Trial (‘96) Carvedilolo
1094
Mista
II-III
23%
6,5
CIBIS II (‘99) Bisoprololo
2647
Mista
III
27%
16
MERIT-HF (‘99) Metoprololo
3991
Mista
II-III
28%
12
RESOLVD (‘00) Metoprololo
426
Ischemica
I-IV
28%
6
BEST (‘01) Bucindololo
2708
Ischemica
III-IV
23%
24
COPERNICUS (‘01) Carvedilolo
2289
Mista
III-IV
19%
10,4
CAPRICORN (‘01) Carvedilolo
1959
Ischemica
I-III
32%
16
SENIORS (’05) Nebivololo
2128
Mista
I-IV
33%
21
b blockade in patients with heart failure
Effects on total mortality and sudden death
CIBIS-II
(n=2647)
US Carvedilol
(n=1014)
Total
Sudden
MERIT-HF
(n=3991)
Sudden
Total
Total
Sudden
17.3%
11.8%
10.8%
7.8%
3.2%
p=0.001
6.3%
3.8%
3.6%
7.2%
6.6%
3.9%
1.7%
p=0.04
Carvedilol
Placebo
p=0.0001
p=0.001
Bisoprolol
p=0.0001 p=0.0002
Metoprolol
All-cause mortality
Proportion event free
1
23% vs. placebo
P=0.031
0.95
0.9
Carvedilol
0.85
0.8
Placebo
0.75
0.7
0
0.5
1
1.5
2
2.5
Years
CAPRICORN, Lancet 2001; 357: 1385-90.
Cardiovascular mortality or non-fatal MI
Proportion event free
1
30% ¯ vs. placebo
P=0.0017
0.9
Carvedilol
0.8
Placebo
0.7
0
0.5
1
1.5
2
2.5
Years
CAPRICORN, Lancet 2001; 357: 1385-90.
POSOLOGIA DEI BETA BLOCCANTI
E’ importante iniziare la terapia SOLO in pazienti
stabili e SEMPRE a DOSI MOLTO
BASSE,
seguite da incrementi graduali (raddoppiare la
dose ogni 1-2 settimane, in accordo con la
risposta clinica), sino a raggiungere la dose
target o, comunque, la massima dose tollerata.
All’inizio della terapia l’azione cronotropa e
inotropa negativa di questi farmaci può
condizionare un transitorio peggioramento
dei segni e sintomi di scompenso,
determinare
bradicardia,
ipotensione,
astenia.
E’ necessario pertanto nella fase di
titolazione un quotidiano controllo del peso
corporeo e, ad ogni incremento della
posologia, di FC e PA.
Gli effetti favorevoli compaiono DOPO TRE
MESI DI TRATTAMENTO
PEGGIORAMENTO DEI SINTOMI DI SCOMPENSO:
aumentare la dose di diuretico o ACE-I, se non
sufficiente ridurre la dose del beta-bloccante
IPOTENSIONE: ridurre la dose dei vasodilatatori, se
non sufficiente ridurre la dose del beta-bloccante
BRADICARDIA:
ridurre
concomitanti
farmaci
bradicardizzanti, se non sufficiente ridurre la dose del
beta-bloccante, interromperlo solo se strettamente
necessario
SEMPRE considerare la reintroduzione/aumento della
dose del beta-bloccante quando il paziente si è
stabilizzato
CONTROINDICAZIONI ALL’USO
DEI BETA BLOCCANTI
BPCO e asma bronchiale gravi (pz in terapia
con b2 agonisti o steroidi)
BAV di I grado con PR>280 msec o BAV di II
grado tipo Mobitz 2 e di III grado, anche
parossistici
FC<50 bpm
Ipotensione con PAS<90 mmHg
Classe NYHA IV avanzata di grado severo o
in terapia con inotropi per via e.v.
L’uso dei beta bloccanti nei pazienti
affetti da scompenso cardiaco può
rendersi
problematico
per
le
controindicazioni, la difficoltà nella
titolazione dei farmaci, la presenza di
pazienti che, in alcuni casi, peggiorano
con la terapia.
Un gran numero di trials ha
dimostrato che, nei pazienti
con scompenso cardiaco, i
betabloccanti aumentano la
sopravvivenza,
riducono
le
ospedalizzazioni e migliorano il
quadro clinico e la qualità
della vita.
I beta bloccanti dovrebbero fare parte
integrante dell’arsenale terapeutico
del paziente con scompenso cardiaco
cronico.
“I beta-bloccanti rappresentano una
ulteriore importante freccia nella
faretra delle terapie farmacologiche
dello scompenso cardiaco”
E. Braunwald, N Engl J Med 2001; 344: 1711-12.
Stage A Therapy
Angiotensin Converting Enzyme
Inhibitors (ACEI)
I IIa IIb III
ACEI can be useful to prevent HF in patients at
high risk for developing HF who have a history of
atherosclerotic vascular disease, diabetes
mellitus, or hypertension with associated
cardiovascular risk factors.
Stage A Therapy
Angiotension Receptor Blockers
(ARBs)
I IIa IIb III
ARBs can be useful to prevent HF in patients
at high risk for developing HF who have a
history of atherosclerotic vascular disease,
diabetes mellitus, or hypertension with
associated cardiovascular risk factors.
Stage B Therapy
Angiotensin Converting Enzyme
Inhibitors (ACEI)
I IIa IIb III
Beta-blockers and ACEIs should be used in all
patients with a recent or remote history of MI
regardless of EF or presence of HF.
I IIa IIb III
ACEI should be used in patients with a reduced EF
and no symptoms of HF, even if they have not
experienced MI.
Stage B Therapy
Angiotensin Receptor Blockers
(ARBs)
I IIa IIb III
An ARB should be administered to post-MI patients
without HF who are intolerant of ACEIs and have a
low LVEF.
Stage B Therapy
Beta-Blockers
I IIa IIb III
I IIa IIb III
Beta-blockers and ACEIs should be used in all
patients with a recent or remote history of MI
regardless of EF or presence of HF.
Beta-blockers are indicated in all patients
without a history of MI who have a reduced
LVEF with no HF symptoms.
Stage B Therapy
Therapies NOT Recommended
I IIa IIb III
I IIa IIb III
Digoxin should not be used in patients with low EF,
sinus rhythm, and no history of HF symptoms,
because in this population, the risk of harm is not
balanced by any known benefit.
Calcium channel blockers with negative inotropic
effects may be harmful in asymptomatic patients
with low LVEF and no symptoms of HF after MI.
Stage C Therapy
(Reduced LVEF with Symptoms)
Angiotensin Enzyme Converting
Inhibitors (ACEIs)
I IIa IIb III
ACEIs are recommended for all patients with
current or prior symptoms of HF and reduced
LVEF, unless contraindicated.
Stage C Therapy
(Reduced LVEF with Symptoms)
Angiotensin Receptor Blockers (ARBs)
I IIa IIb III
ARBs approved for the treatment of HF are
recommended in patients with current or prior
symptoms of HF and reduced LVEF who are ACEIintolerant .
Stage C Therapy
(Reduced LVEF with Symptoms)
Beta-Blockers
I IIa IIb III
Beta-blockers (using 1 of the 3 proven to reduce
mortality, i.e., bisoprolol, carvedilol, and sustained
release metoprolol succinate) are recommended for
all stable patients with current or prior symptoms of
HF and reduced LVEF, unless contraindicated.
Stage C Therapy
(Reduced LVEF with Symptoms)
Aldosterone Antagonists
I IIa IIb III
Addition of an aldosterone antagonist is recommended in
selected patients with moderately severe to severe
symptoms of HF and reduced LVEF. Creatinine should be
less than or equal to 2.5 mg/dL in men or less than or
equal to 2.0 mg/dL in women and potassium should be
less than 5.0 mEq/L.
Stage C Therapy
(Reduced LVEF with Symptoms)
Diuretics
I IIa IIb III
Diuretics and salt restriction are indicated in
patients with current or prior symptoms of HF
and reduced LVEF who have evidence of fluid
retention.
Stage C Therapy
(Reduced LVEF with Symptoms)
Digitalis
I IIa IIb III
Digitalis can be beneficial in patients with
current or prior symptoms of HF and reduced
LVEF to decrease hospitalizations for HF.
Stage C Therapy
(Reduced LVEF with Symptoms)
ARBs (cont’d)
I IIa IIb III
The addition of an ARB may be considered in
persistently symptomatic patients with reduced
LVEF who are already being treated with
conventional therapy.
I IIa IIb III
Routine combined use of an ACEI, ARB, and
aldosterone antagonist is not recommended for
Patients with current or prior symptoms of HF and
reduced LVEF.
Stage C Therapy
(Reduced LVEF with Symptoms)
Therapies NOT Recommended
I IIa IIb III
Calcium channel blocking drugs are not indicated as
routine treatment for HF in patients with current or
prior symptoms of HF and reduced LVEF.
Stage D Therapy
Medical Therapy
I IIa IIb III
I IIa IIb III
Continuous intravenous infusion of a positive
inotropic agent may be considered for
palliation of symptoms in patients with
refractory end-stage HF.
Routine intermittent infusions of positive
inotropic agents are not recommended for
patients with refractory end-stage HF.
Algorithm for Heart Failure
Neurohormonal Inhibiting Drug
Therapy
Evidence based
recommendations
Beta-blocker
intolerance
or
contraindicated
ACEI
Beta-blocker
ARBs
ACE Intolerance
Spironolactone, if not contraindicated in severe HF patients
Antitrombotici
Nello scompenso cardiaco associato a FA, pregresso
evento tromboembolico o trombo ventricolare mobile
è indicata la terapia anticoagulante (I, A)
In presenza di sottostante coronaropatia sono
raccomandati i farmaci antiaggreganti (IIa, B)
Nei pazienti con pregresso infarto è raccomandato
l’impiego di aspirina o anticoagulanti orali (IIa, C)
Non vi sono dimostrazioni sicure di un effetto
favorevole dell’aspirina sulla sopravvivenza dei
pazienti con scompenso
Antiaritmici
Gli antiartimici di classe I dovrebbero essere evitati in
quanto pro-aritmici (III, B)
I beta-bloccanti riducono il rischio di morte improvvisa
nello scompenso cardiaco (I, A)
L’amiodarone è efficace nella maggior parte delle
aritmie ventricolari e sopraventricolari (I, A), ma non
ha alcun effetto sulla sopravvivenza.
Criteri di inclusione
18 anni
Scompenso cardiaco di natura ischemica/non-ischemica
Class NYHA dalla II alla IV
Disfunzione ventricolare sinistra (FE 35%)
FC 70 bpm
Ritmo sinusale
Documentata ospedalizzazione per peggioramento di
scompenso cardiaco 12 mesi
Swedberg K, et al. Eur J Heart Fail. 2010;12:75-81.
Pazienti
6.558 randomizzati
3.268 Ivabradina
3.290 placebo
3.241 analizzati
3.264 analizzati
2 persi al follow-up
1 perso al follow-up
Lancet. Online 29-08-2010
Caratteristiche basali
Età media (anni)
Maschi, %
Eziologia ischemica, %
NYHA II, %
NYHA III/IV, %
Precedente IM, %
Diabete, %
Ipertensione, %
Lancet. Online 29-08-2010
Ivabradina
3.241
60,7
76
68
49
51
56
30
67
Placebo
3.264
60,1
77
67
49
51
56
31
66
Disegno dello studio
Ivabradina 5 mg bid
Ivabradina 2.5, 5, or 7.5 mg bid
in base a FC e tollerabilità
Screening
7 a 30 gg
Placebo, bid
D0
D14
D28
3,5 anni
Swedberg K, et al. Eur J Heart Fail. 2010;12:75-81.
M4
Ogni 4 mesi
End-point primario
Morte cardiovascolare e Ospedalizzazione per scompenso cardiaco
40
Placebo*
N = 6.505
- 18%
NYHA II-IV
30
Ivabradina*
20
p < 0,0001
10
Mesi
0
0
3
6
12
18
24
30
* In aggiunta a Beta-bloccanti (89%), ACE-inibitori (91%), Diuretici (90%)
Lancet. Online 29-08-2010
End-point primario
Morte cardiovascolare e Ospedalizzazione per scompenso cardiaco
40
Placebo*
N = 6.505
- 18%
NYHA II-IV
30
Ivabradina*
20
p < 0,0001
10
Mesi
0
0
3
6
12
18
24
30
* In aggiunta a Beta-bloccanti (89%), ACE-inibitori (91%), Diuretici (90%)
Lancet. Online 29-08-2010
Ospedalizzazione per scompenso
Rischio di eventi (%)
30
Placebo*
- 26%
20
Ivabradina*
10
p < 0,0001
Mesi
0
0
6
12
18
24
30
* In aggiunta a Beta-bloccanti (89%), ACE-inibitori (91%), Diuretici (90%)
Lancet. Online 29-08-2010
Sottogruppi prespecificati
Età
<65 anni
≥65 anni
Sesso
Maschi
Femmine
Beta-bloccanti
No
Si
Eziologia dello scompenso cardiaco
Non-ischaemico
Ischaemico
Classe NYHA
NYHA II
NYHA III or IV
Diabete
No
Si
Ipertensione
No
Si
FC basale
<77 bpm
≥77 bpm
0.5
A favore di Ivabradina
Lancet. Online 29-08-2010
1.0
Hazard ratio
1.5
A favore di Placebo
Effetti collaterali
Pazienti con
Effetti collaterali
Ivabradina
N=3.232, n (%)
Placebo
N=3.260, n (%)
Bradicardia
sintomatica
150 (5%)
32 (1%)
Bradicardia
asintomatica
184 (6%)
48 (1%)
Fosfeni
89 (3%)
17 (1%)
17 (0.5%)
7 (0.2%)
Visione confusa
Lancet. Online 29-08-2010




![Scompenso cardiaco- attività dell`Asl di Nuoro [file]](http://s1.studylibit.com/store/data/005106553_1-2acc9f03391e8aa6792037a95036da21-300x300.png)







