Dolore
Dolore
EPIDEMIOLOGIA
L’organizzazione Mondiale della Sanità ritiene che
almeno 4 milioni di persone soffrano di dolore da malattia
tumorale.
Circa il 70 % dei pazienti con un tumore in fase
avanzata presenta dolore dovuto alla malattia.
Uno studio dimostra che più del 41% dei pazienti
con tumori metastatici solidi lamenta dolori dovuti alla
malattia e che il 42% di essi riceve un trattamento
analgesico inadeguato.
Da rilevamenti effettuati nella regione Toscana, nel
1996 ci sono stati 9000 casi di pazienti terminali oncologici
6000-8500 pazienti (il 70-90%) hanno avuto un decorso
della malattia caratterizzato da sintomatologia dolorosa.
I FARMACI ANALGESICI OPPIACEI NELLA TERAPIA DEL DOLORE
Il trattamento del dolore da cancro rappresenta un grave problema di salute
pubblica in tutto il mondo e si calcola che ogni anno siano 10 milioni i nuovi casi di
cancro e 6 milioni le morti per questa malattia.
L’Organizzazione Mondiale della Sanità (OMS) ha evidenziato che la maggior
parte dei casi di dolore oncologico potrebbe essere trattata applicando le
opportune terapie che derivano dall’evoluzione delle conoscenze mediche.
Nonostante le indicazioni fornite dall’OMS i pazienti affetti da dolore severo non
sempre sono curati con le opportune terapie farmacologiche e ciò costituisce
una negazione del diritto degli individui di alleviare la propria sofferenza.
I governi dei singoli paesi hanno il dovere morale di garantire agli operatori gli
strumenti per poter mettere in atto le indicazioni dell’OMS soprattutto nei paesi
industrializzati dove le lacune dei trattamenti possono essere facilmente colmate
con l’educazione del personale sanitario e agevolando l’accesso ai farmaci
analgesici oppiacei. Alla luce di recenti analisi sul consumo dei farmaci oppiacei,
l’Italia risulta essere un paese che non risponde ai reali bisogni dei pazienti
affetti da dolore severo in corso di patologie neoplastiche o degenerative
negando loro il giusto sollievo in particolare nella fase terminale.
Al fine di facilitare la prescrizione e l’impiego dei farmaci oppiacei e di supportare
gli operatori sanitari è stata emanata la legge 8 febbraio 2001, n.12, corredata da
diversi decreti applicativi, il più recente dei quali è il Decreto Ministeriale del 4
aprile 2003.
Terapia del Dolore
Al fine di facilitare la prescrizione e l’impiego
dei farmaci oppiacei e di supportare gli
operatori sanitari è stata emanata la
legge 8 febbraio 2001, n.12, corredata
da diversi decreti applicativi, il più recente
dei quali è il Decreto Ministeriale del 4
aprile 2003.
Terapia del Dolore
RESPONSABILITA’ DEL MEDICO
• Il nuovo corpo normativo è proteso a fornire la necessaria
assistenza sanitaria indispensabile nel trattamento delle
gravissime patologie accompagnate da dolore severo,
assistenza che costituisce spesso l’ultimo rimedio a tutela
della dignità umana.
• Tra i principi fondamentali della Costituzione, infatti, c’è la
tutela della salute come diritto fondamentale dell’individuo
e della collettività. E’ compito del SSN rispondere alle
esigenze ed al bisogno di salute della popolazione
attuando le misure più adeguate (legge 833/78, art.1).
• La ratio della legge 8 febbraio 2001, n.12 è quella di
agevolare la prescrizione e favorire l’uso dei farmaci
oppiacei per alleviare le sofferenze di quei pazienti
affetti da gravi forme di dolore severo.
Terapia del Dolore
I 10 farmaci compresi nell’allegato III-bis della legge 8 febbraio 2001, n.120
Buprenorfina
Codeina
Diidrocodeina
Fentanyl
Idrocodone
Metadone
Morfina
Ossicodone
Ossimorfone
Idromorfone
…agevolato l’impiego nei “pazienti affetti da
dolore severo in corso di patologia neoplastica o
degenerativa, ad esclusione del trattamento
domiciliare degli stati di tossicodipendenza da
oppiacei”
Terapia del Dolore
Dobbiamo interpretare queste modifiche al D.P.R.
n. 309 del 9 ottobre 1990 in una ottica più ampia
di quella prettamente legislativa, in quanto
restituiscono dignità alla figura del malato
terminale, che riacquista il diritto di ricevere un
trattamento capace di alleviare la parte più
disumana della malattia: il dolore.
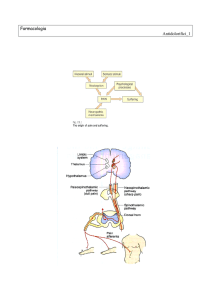
indica la sua origine da
un’anomalia funzionale del
sistema nervoso
Il dolore va trattato fin dalla sua insorgenza!!
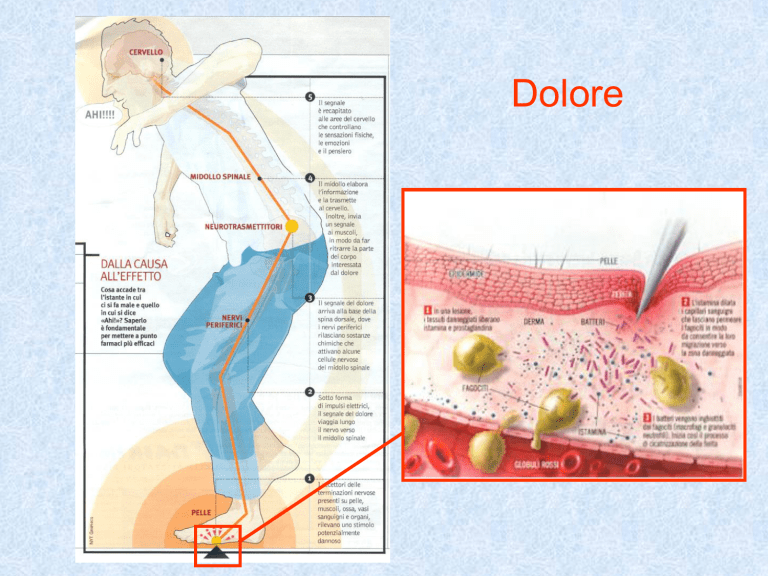
Dolore
L’informazione nocicettiva nasce in periferia
in seguito a diversi stimoli ed è convogliata al
midollo spinale (corno posteriore) da fibre
afferenti amieliniche di tipo C a conduzione
lenta (dolore sordo, non localizzato) e da
piccole fibre mieliniche A, tipo delta (dolore
acuto).
Le fibre afferenti entrano nel midollo spinale
attraverso le radici dorsali e terminano nelle
corna posteriori (sostanza grigia).
Dal
midollo
spinale,
l’informazione
nocicettiva arriva ai centri corticali (talamo)
ad opera di neuroni di trasmissione.
Il dolore vero e proprio è la presa di
coscienza delle informazioni nocicettive
trasmesse dal talamo ed integrate a
livello corticale e limbico.
Le strutture coinvolte sono la corteccia
(anteriore cingolata, somatico-sensoriale,
prefrontale), l’ipotalamo,
il talamo, la
sostanza
grigia
periacqueduttale,
il
cervelletto ed i gangli della base.
A
B
Dolore
Events
leading
to
activation,
sensitization, and spread of sensitization
of primary afferent nociceptor terminals.
A. Direct activation by intense pressure
and consequent cell damage. Cell
damage induces lower pH (H+) and
leads to release of potassium (K+) and to
synthesis of prostaglandins (PG) and
bradykinin (BK). Prostaglandins increase
the sensitivity of the terminal to
bradykinin and other pain-producing
substances. B. Secondary activation.
Impulses generated in the stimulated
terminal propagate not only to the spinal
cord but also into other terminal branches
where they induce the release of
peptides, including substance P (SP).
Substance P causes vasodilation and
neurogenic
edema
with
further
accumulation of bradykinin. Substance P
also causes the release of histamine (H)
from mast cells and serotonin (5HT) from
platelets.
Trasmettitori e recettori della percezione del dolore
Controllo della sensibilità dolorosa
“Gate control”
• Per la complessa rete neuronale
esistente nel midollo spinale, la
stimolazione
ripetuta
delle
terminazioni dolorifiche “apre” il
cancello (autofacilitazione) ed
aumenta l’attivazione delle vie
ascendenti spino-talamiche.
• Stimoli sensoriali non nocicettivi
e informazioni discendenti “chiudono” il cancello e diminuiscono
la sensibilità dolorosa.
LA TERAPIA DEL DOLORE
Da sempre l’uomo ha cercato nuove strade per far fronte al dolore.
Normalmente, per il trattamento del dolore si fa una distinzione tra :
• Dolore acuto
• Dolore cronico benigno
• Dolore cronico da cancro
L'entità della percezione del dolore e la sua valutazione in termini emotivi
è il risultato di eventi complessi che coinvolgono strutture e meccanismi
non sempre del tutto noti.
Ogni stato algico comprende aspetti
cognitivi (attenzione),
interpretativi (finalizzazione, informazione) ed
emozionali (ansia, rabbia, depressione, umiliazione, ecc.)
LA TERAPIA DEL DOLORE
Dolore acuto Il dolore acuto è causato da un trauma tissutale e
dall’attivazione dei recettori periferici nel punto di lesione. Il trauma altera le
risposte caratteristiche dei nocicettori e le loro connessioni centrali
coinvolgendo il sistema simpatico. In genere i sistemi riparativi
dell’organismo intervengono e portano alla guarigione della lesione con
scomparsa del dolore.
•Post operatorio
•Trauma Viscerale (infarto, colica)
•Muscolare
•Parto
•Manovra diagnostica o terapeutica
Si utilizzano FANS ed oppiacei, a seconda della gravità del dolore
Tempo di somministrazione breve ed effetti collaterali trascurabili
Dolore cronico Anch’esso scatenato da un evento traumatico ma
può continuare per fattori che, sia dal punto di vista patogenetico che da
quello fisico, non sono direttamente correlati alla causa iniziale. Il trauma
può superare la capacità di guarigione del corpo e il dolore diventa esso
stesso malattia.
DOLORE CRONICO BENIGNO
• Articolare
• Neuropatico (Post-herpetico, trigemino)
• Centrale
• Cefalea
A differenza del dolore da cancro, il trattamento è di lunga durata e gli
effetti collaterali sono importanti.
I farmaci utilizzati sono soprattutto i FANS (COX-1 e COX-2 inibitori), il
paracetamolo e in patologie particolari bloccanti del TNF, gli
antidepressivi e gli anticonvulsivanti.
Si sta facendo strada l’impiego di farmaci oppiacei anche nel dolore
cronico benigno, soprattutto:
- quando gli effetti collaterali dei farmaci utilizzati sono inaccettabili (es.
nell’anziano, nel nefropatico)
- quando il dolore non risponde ad altri trattamenti
IL DOLORE CRONICO da cancro
Il 35-45% dei pazienti prova dolore ad uno stato precoce o
già al momento della diagnosi di tumore o di altre malattie
degenerative.
• Circa il 70% dei pazienti ha dolore in uno stadio avanzato
della patologia.
• Quasi tutti i pazienti terminali hanno dolore.
Si utilizza la scala OMS.
In relazione all’aumentare del dolore:
• A) FANS
• B) Oppiodi deboli (agonisti parziali: Ossicodone,
buprenorfina, codeina, tramadolo)
• C) Oppiodi forti con o senza adiuvanti per il controllo
degli effetti collaterali, del dolore incidente e per la qualità
di vita
Si deve ricordare che è un trattamento limitato nel
tempo
Farmaci per la terapia del dolore
Analgesici Non Oppioidi
• Farmaci Antinfiammatori Non Steroidei
Analgesici Oppioidi
• Agonisti forti (morfina, meperidina, metadone, fentanil e derivati)
• Agonisti deboli (codeina, destropropossifene, tramadolo)
• Agonisti / antagonisti(pentazocina)
• Agonisti parziali (buprenorfina)
• Farmaci Adiuvanti
• Antidepressivi triciclici
• Antiepilettici
• Farmaci serotoninergici (SSRI, trazodone)
• Farmaci noradrenergici (clonidina, terazosina)
• Miorilassanti
• Corticosteroidi
• Anestetici locali
• Altri (capsaicina, somatostatina)
• Ansiolitici
Analgesici periferici antiinfiammatori
• Antiinfiammatori non steroidei (FANS),
compreso il paracetamolo che non ha
effetto antinfiammatorio, ma esercita una
azione antidolorifica centrale.
Analgesici periferici antiinfiammatori
Analgesici periferici antiinfiammatori
Analgesici oppioidi
• Antidolorifici potenti, i farmaci del malato di
cancro, ma anche farmaci da usare in una
serie di situazioni non così drammatiche e
finali come il dolore del malato terminale
• Morfina e derivati dell'oppio
• Molecole di sintesi morfino-mimetiche:
levorfano, pentazocina, buprenorfina
• Succedanei della morfina: petidina, metadone
Oppio, oppiacei ed oppiodi
Leu-encefalina
Papaver somniferum
La coltivazione del papavero ed i suoi effetti euforizzanti
erano noti ai Sumeri già nel 3400 a. C.
• Solo nel 1803 un chimico tedesco, Friedrich Sertuener,
identificò il principio attivo, la morfina.
• Nel 1827 la Meck & Co. iniziò a produrre la morfina per
scopi commerciali.
• La morfina, gli altri alcaloidi naturali dell’oppio e i derivati
costituiscono la categoria degli oppiacei.
• L’unico uso legale degli oppiacei è il trattamento del
dolore post-operatorio.
Morfina
Oppio, oppiacei ed oppiodi
Le sostanze oppioidi agiscono su recettori specifici a livello del midollo
spinale e del tronco cerebrale (sostanza grigia delle corna dorsali e
sostanza gelatinosa di Rolando).
Questi recettori (mu, delta, kappa) sono responsabili non solo degli effetti
positivi (analgesia) ma anche degli effetti collaterali (depressione
respiratoria, prurito,vomito etc).
Gli oppiodi agiscono da agonisti su recettori specifici distribuiti sul SNC, la
cui identità è stata chiarita con molto ritardo rispetto ad altri ed in seguito
all’isolamento e la caratterizzazione dei loro leganti endogeni: le
endomorfine (o endorfine), cioè composti analgesici endogeni.
Dopo la scoperta delle endomorfine (1975-80) e la clonazione di molte
delle classi recettoriali venne usato il termine “recettori degli oppiodi ”
per la loro capacità di legare anche composti chimicamente non correlati
alla morfina.
Contro la tosse e per curare l’asma…
morfina per sedare i
pianti dei bimbi..
Analgesici oppioidi
Agonisti puri:
- Morfina
- Codeina
- Meperidina
- Metadone
- Tramadolo
- Fentanyl
- Ossicodone
Agonisti parziali:
- Buprenorfina
Agonisti-antagonisti:
-Pentazocina
Antagonisti:
- Naloxone
DEFINIZIONE DELLA TERMINOLOGIA
• OPPIOIDI AGONISTI PURI: hanno un effetto stimolante sul loro recettore, che
viene attivato in modo massimale.
Presentano una dose effetto lineare e non presentano un effetto-tetto.
• OPPIOIDI AGONISTI PARZIALI: agiscono sul recettore in modo sub-massimale,
per limitata efficacia intrinseca.
Delineano un rapporto dose-effetto meno rapido e presentano effetto-tetto per cui
oltre certi limiti, l’aumento ulteriore non provoca aumento dell’effetto.
Recettori per gli oppiodi
K+
NH2
II
G a G bg
GDP
cAMP
COOH
GTP
Adenilato ciclasi
Proteina Gi
2+
Ca
Recettori per gli oppiodi
μ: analgesia con sede prevalente
sopraspinale
depressione respiratoria,
costipazione, miosi (in parte
attribuibili all’inibizione del rilascio
di acetilcolina), sensazione di
benessere o euforia
k: analgesia con sede prevalente
spinale
sedazione (narcosi … catalessi)
effetti da disforici a psicotominetici
δ: analgesia con sede spinale e
sopraspinale
riduzione dell’attività motoria
altri effetti più o meno in comune
con i μ
Meccanismo d’azione
La morfina mima gli effetti delle endorfine (oppioidi endogeni).
L'effetto analgesico si ottiene per modulazione della
neurotrasmissione dei messaggi nocicettivi a livello
a) spinale (midollo) per attivazione degli interneuroni inibitori.
b)
sopraspinale
(bulbo, ponte, mesencefalo)
facilitazione delle vie discendenti inibitorie.
per
A questi effetti post- (diminuzione del firing neuronale) e presinaptici (per diminuita produzione o liberazione di altri
neurotrasmettitori) si aggiungono effetti sulla componente
emozionale (sistema limbico) ed il dolore è meno intenso
e più sopportabile.
Meccanismo d’azione……
c) periferico. Il dolore associato all’infiammazione sembra
essere particolarmente sensibile a queste azioni periferiche.
Recettori µ funzionali su terminali periferici dei neuroni
sensoriali supporta questa ipotesi.
La stimolazione dei recettori periferici µ diminuisce l’attività
del
neurone
sensoriale
e
la
liberazione
del
neurotrasmettitore.
La somministrazione periferica di oppioidi (es. nel ginocchio
di pazienti sottoposti ad artroscopia) ha dimostrato efficacia
clinica.
Lo sviluppo di oppioidi selettivi per siti periferici potrebbe
essere importante per il trattamento del dolore infiammatorio.
Effetti degli oppioidi
Siti e meccanismi di azione
• Inibizione diretta del sistema nocicettivo
ascendente (k, µ)
• Attivazione del sistema di controllo del dolore
discendente (k, µ)
• Inibizione della trasmissione algica a livello
talamico (µ)
• Inibizione periferica della liberazione di mediatori
infiammatori dalle cellule immunitarie (µ)
Effetti clinici degli oppioidi
Analgesia
• Effetto di sollievo sia sul dolore acuto che
su
quello
cronico,
con
notevole
attenuazione o scomparsa completa e
sensazione di sollievo psichico. Efficacia
minore sul dolore neuropatico.
• Gli oppioidi inducono analgesia senza
perdita di conoscenza, con possibile
effetto euforizzante.
Affinità farmaci per i recettori
oppioidi
Farmaco
m
Morfina
+++
Metadone
+++
Fentanil
+++
Sufentanil
+++
Meperidina
++
Codeina
+
Tramadolo
+Buprenorfina +++AP
Pentazocina -
Recettore
d
+
k
++
+
+
+
+
+
-AP
+
Oppioidi forti
• La morfina è il punto di riferimento di ogni farmaco
analgesico. Possiede tutti gli effetti tipici dei farmaci
oppioidi: analgesia, depressione respiratoria, nausea,
vomito, modulazione endocrina, antitosse, rallentamento del
transito intestinale, effetti sul sistema immunitario. La durata
di azione della morfina è di circa 4 ore; sono anche
disponibili formulazioni a lento rilascio che ne portano la
durata di azione a 8 ore.
• Il metabolismo è prevalentemente epatico, dove si coniuga
con l’acido glicuronico dando luogo a due metaboliti, la
morfina-3-glicuronide (M-3-G) e la morfina-6-glicuronide (M6-G).
• La M-3-G non ha più l’azione farmacologica degli oppioidi
• La M-6-G va considerato un oppioide a tutti gli effetti
(analgesia ed effetti collaterali) con una potenza 4 volte
superiore a quella della morfina.
Morfina
• Eliminazione per via renale. Molecola idrofila: passaggio
lento della barriera emato-encefalica
• La dose terapeutica presenta una notevole variabilità
individuale (entità e tipologia del dolore, farmaci
precedentemente assunti, età del soggetto, funzionalità
renale)
• Bisogna poi tenere conto anche della via di
somministrazione
• Iniziando un trattamento con morfina orale ad immediato
rilascio si può partire con una dose pari a 5-10 mg ogni 4
ore salendo, se necessario, con incrementi di dose del 2550%, valutando continuamente efficacia ed effetti collaterali.
• Non “effetto-tetto”
• Vie di somministrazione : os, ev, im, sc, rettale e più
raramente epidurale, spinale, intrarticolare
Morfina a rilascio rapido (ORAMORPH):
vantaggi
• 20 mg/ml di morfina solfato, disponibile in flaconi da 20 ml e 100 ml
• sciroppo contenente 2 mg/ml di morfina solfato.
• rapidità d'azione (concentrazioni plasmatiche massime entro la
prima ora)
• breve durata d'azione (4 ore)
• risultano utili anche per l'uso "al bisogno" nei pazienti che sono già
in trattamento con le compresse a lento rilascio
• La dose iniziale dipende dal trattamento analgesico precedente.
• Il trattamento può essere poi proseguito con i discoidi e le capsule
a cessione controllata che hanno un picco di concentrazione più
lento e una durata d'azione più prolungata (12 ore).
• La morfina ha un sapore molto amaro. La soluzione non contiene
edulcoranti e nel caso in cui il paziente non la gradisca può essere
miscelata con una bibita zuccherata o con un succo di frutta.
Morfina orale a cessione controllata (MS
Contin): vantaggi
•
•
•
•
è agevole da somministrare (ogni 12 ore),
elimina il disagio della dose notturna,
è bene accetta dal personale infermieristico,
il paziente la può assumere senza
l'intervento di altre persone.
• non presenta effetto-tetto per cui è possibile
aumentare la posologia al bisogno.
• Le compresse di MS CONTIN devono essere
ingerite intere, non suddivise in parti e non
masticate
Metadone (Eptadone)
• Il metadone ha una durata di azione di 8 ore circa ed ha
ottima biodisponibilità orale. Non ha “effetto tetto”
• Il metadone è 6/7 volte più potente della morfina.
• Il picco plasmatico viene raggiunto in circa 4 ore, ma l’effetto
analgesico è più precoce grazie alla elevata lipofilia della
molecola, che consente un facile superamento della barriera
emato-encefalica
• Si lega alle proteine plasmatiche, e la quota legata alle
proteine plasmatiche si comporta come una riserva, una
specie di deposito a lento rilascio. Questi aspetti correlati
anche a una durata media dell’effetto analgesico più breve e
pari a 4-8 ore, possono essere causa di accumulo del
farmaco; ciò accade se si usano dosi ripetute o
somministrazioni troppo ravvicinate.
• Attualmente, il metadone sta trovando un impiego sempre
più comune nella terapia del dolore cronico anche a
domicilio e nel dolore post-operatorio.
• Vie di somministrazione: os, im, ev, epidurale.
• Il fentanyl (Fentanest, Leptofen) (derivato della meperidina)
è un farmaco dotato di una notevole potenza analgesica (75125 volte maggiore della morfina).
• Può essere usato in formulazioni transdermiche a lento
rilascio.
• E’ un agonista puro per i recettori degli oppioidi, possedendo
elevata affinità per i recettori mu
• Elevata rapidità d’azione (30 sec dopo ev) e limitata durata
d’azione nelle forme iniettabili (30-60 min dopo ev)
• Il catabolismo è interamente epatico e non dà luogo a
metaboliti attivi
• L’elevata lipofilia garantisce la cessione del farmaco
attraverso la cute da parte di un sistema esterno
• Vie di somministrazione: im, epidurale, spinale, transdermica
e trans-mucosale
• No somministrazione per os: effetto di primo passaggio pari al
70%
• La meperidina (petidina) è un oppioide sintetico che non
induce la contrazione dello sfintere di Oddi.
Somministrazione transdermica
Sezione schematica del cerotto DUROGESIC
• Il cerotto va sostituito ogni 72 ore
• Assorbimento lento
• Concentrazioni ematiche
relativamente costanti
• Se non era in atto alcuna terapia
antalgica sono necessarie circa 24 ore
per raggiungere lo steady state da
parte del fentanyl; utile copertura con
oppioidi mu-agonisti a rapida azione
• Se era già in atto un trattamento con
oppioidi può accadere una fase di
“scopertura analgesica” con una
possibile fase di astinenza; utile
ridurre l’oppioide di partenza fino al
raggiungimento dello steady state del
fentanyl
Fentanyl
Presente in commercio in Italia
come:
Formulazione iniettabile 0.05 mg/ml:
Fentanest.
Sistema TTS: Durogesic 25, 50, 75, 100
mcg/h.
Oral trans-mucosal fentanyl citrate OTFClollipop da 200, 400, 600, 1200 e 1600 mcg.
Oppioidi deboli nel trattamento del dolore…
•Il tramadolo (Contramal®, Fortradol®)
(derivato della codeina) è un debole agonista del recettore
oppiaceo µ, ma ha anche la capacità di bloccare la ricaptazione
di serotonina e noradrenalina come i classici antidepressivi
triciclici. L’effetto analgesico del tramadolo è comparabile a
quello della codeina, ma accompagnato da effetti riconducibili a
quelli degli antidepressivi triciclici, con il potenziamento delle vie
serotoninergica
e
noradrenergica.
Questo
particolare
meccanismo di azione potrebbe essere alla base di alcune sue
caratteristiche, come la minore tendenza alla depressione
respiratoria, la stimolazione del sistema immunitario e la scarsa
tendenza alla tolleranza.
•Potenza farmacologica: 1/5-1/10 della morfina
•Biodisponibilità orale: 70-100%
• Emivita : 5-6 ore
•Metabolismo: epatico
•Eliminazione: renale
•“Effetto-tetto” per dosi complessive giornaliere di 400-600 mg
Oppioidi deboli nel trattamento del dolore…
•TRAMADOLO (Contramal® , Fortradol®) INDICAZIONI
••Cervicalgie
••Dolori articolari
••Dolore associato ad osteoporosi
••Dolore post operatorio
••Dolore da colica
••Dolore da cancro (II scalino)
••Dolore ostetrico
••Dolore toracico (compresi angina ed infarto)
Oppioidi deboli nel trattamento del dolore…
• La codeina, è circa dieci volte meno potente della
morfina, ma ne condivide tutti gli effetti. Rispetto alla
morfina, la codeina ha il vantaggio di essere bene
assorbita per via orale. Bassa affinità per i recettori mu
• Buona disponibilità per os.
• Metabolismo epatico: il 10% viene demetilata a morfina.
• Dosi abituali di somministrazione di 30-60 mg per os ogni
4-6 ore; 10 mg sono sufficienti a determinare un’attività
antitussigena
• “Effetto-tetto” per dosi complessive giornaliere di 360 mg
• L’associazione di Paracetamolo 500 mg – Codeina 30 mg
• (Co-efferalgan,Tachidol), produce un buon sinergismo.
• Opportuna una riformulazione del rapporto tra i due
farmaci, per fornire la codeina a pieno dosaggio senza
elevare a livelli tossici le dosi di paracetamolo.
• Il destropropoxifene (Liberen) è un
analgesico
molto
più
debole
del
metadone, di potenza paragonabile a
quella della codeina, caratterizzato però
dalla stessa lunga durata di azione del
metadone; è generalmente usato in
associazione ai FANS.
La buprenorfina (Subutex, Temgesic, Transtec) è bene assorbita per
via orale. Induce fenomeni allucinatori e vomito che impediscono di
utilizzare appieno le sue qualità analgesiche.
• E’ un oppioide potente agonista parziale con elevata affinità per i
recettori mu e k: è 25-50 volte più potente della morfina, ma meno
efficace. E’ antagonista dei recettori k
• Se somministrato insieme ad un agonista puro può antagonizzare
gli effetti dell’agonista spiazzandolo dal suo legame con i recettori
mu, con possibile comparsa di crisi di astinenza.
La buprenorfina…
• A dosaggi terapeutici non è evidente l’effetto-tetto: tale
effetto sembra comparire a dosaggi > 4 mg/die.
• Ulteriori aumenti di dosi provocano un aumento degli
effetti collaterali, parzialmente reversibili con naloxone.
• Attualmente in Italia è utilizzata in somministrazione per
via sublinguale alla dose di 0.2-0.4 mg ogni 6-8 ore,
con un’azione
• analgesica che si realizza in 15-45 minuti o in fiale da
0.3 mg per via ev.
• Da alcuni mesi anche in Italia è disponibile il cerotto di
buprenorfina a cessione lenta transcutanea (Transtec
35, 52.5, 70 mcg/h pari rispettivamente a 0.8 mg, 1.2
mg, 1.6 mg nelle 24 ore)
Effetti collaterali degli oppioidi
• Miosi (segno prognostico della intossicazione acuta grave da
oppioidi) (non va incontro a tolleranza);
• Nausea, vomito;
• Costipazione con aumento del tono muscolare del duodeno,
della porzione antrale e dello sfintere pilorico dello sfintere
anale (non va incontro a tolleranza);
• Spasmo dello sfintere di Oddi (controndicazione nel
trattamento dello coliche biliari);
• Iperglicemia con un abbassamento del metabolismo basale
per riduzione della temperatura corporea;
• Vasodilatazione periferica per liberazione diretta di istamina,
diminuzione del precarico, effetto inotropo e cronotropo
negativo;
• Depressione respiratoria per inibizione diretta dei centri
respiratori bulboponti e depressione dei chemiorecettori;
L’exitus per sovradosaggio è dovuto all’effetto inibitorio sui
centri respiratori e quindi a depressione respiratoria!!!
L’exitus per sovradosaggio è dovuto all’effetto inibitorio sui
centri respiratori e quindi a depressione respiratoria!!!
… E’ la complicanza peggiore degli oppioidi,
ma è MOLTO RARA!
Non si manifesta se gli oppioidi sono usati correttamente
Esiste un ANTIDOTO: il naloxone (Narcan)
Strategia per il controllo degli effetti
collaterali da oppioidi - 1
Utilizzo farmaci antagonisti degli oppioidi
utile in situazioni di sovradosaggio (errore
posologico) o di accumulo acuto e grave con
rischio di depressione respiratoria
grave bradipnea
stato di coscienza obnubilato
miosi
iperidrosi
cianosi
Strategia per il controllo degli effetti
collaterali da oppioidi - 2
Somministrazione di farmaci
sintomatici sugli effetti indesiderati:
Stipsi: incremento dell’idratazione e
somministrazione di farmaci lassativi
(lassativi osmotici e derivati della senna)
Nausea/vomito: utilizzo di antiemetici
(metoclopramide, alloperidolo,
scopolamina, ondansetron)
Depressione respiratoria: da trattare con
naloxone ev
Strategia per il controllo degli effetti
collaterali da oppioidi - 3
Rotazione degli oppioidi o switching:
quando ?
Dolore controllato, ma vi sono effetti collaterali intollerabili
per il paziente.
Il dolore non è adeguatamente controllato ed è impossibile
aumentare la dose di oppioide a causa degli effetti
collaterali.
Il dolore non è adeguatamente controllato, nonostante il
continuo incremento della dose di oppioide che comunque
non produce effetti collaterali severi.
perché ?
migliorare il rapporto analgesia/tollerabilità in relazione
all’esistenza di una tolleranza crociata incompleta tra i
diversi oppioidi.
Interazioni con altri farmaci
• SEDATIVI IPNOTICI
- Potenziamento della depressione del sistema nervoso
centrale e in particolare della depressione respiratoria.
• TRANQUILLANTI ANTIPSICOTICI
- Aumentata sedazione. Effetti variabili sulla Depressione
Respiratoria. Potenziamento degli effetti cardiovascolari
(azioni antimuscariniche ed alfa-bloccanti).
• MAO-INIBITORI
- Controindicazione assoluta all’uso di tutti gli analgesici
stupefacenti per l’elevata incidenza di coma iperpiretico
Aumentata incidenza di ipertensione.
Tolleranza e farmacodipendenza da
oppioidi
• Per tolleranza Si intende la necessità di dosi di
farmaco più elevate per mantenere inalterata
l’efficacia nel tempo (analgesia, effetto euforizzante, ma
anche effetti collaterali, in particolare depressione
respiratoria). La tolleranza è crociata (cioè è estesa a tutti i
farmaci analgesici-narcotici di tipo oppiaceo) e si ottiene
dopo due-tre settimane alle normali dosi terapeutiche
• Il
meccanismo
non
è
metabolico
(diminuito
assorbimento, aumentata degradazione o eliminazione
del farmaco) ma si ipotizza dovuta a up-regolazione di
sistemi di trasduzione intracellulari (cAMP) che
antagonizzano gli effetti della attivazione dei recettori
oppioidi.
Portenoy. Cancer pain managementt. Seminars in Oncology 1993:20 ( 2,Suppl 1)19-35
Tolleranza e farmacodipendenza da
oppioidi
Tolleranza acquisita
farmacocinetica: variazioni, nel tempo, della distribuzione,
della clearance, della degradazione, etc.
farmacodinamica: cambiamento della risposta delle
cellule ai farmaci (coinvolge recettori)
appresa: 1) comportamentale,acquisizione di strategie atte
a conservare una data funzione nonostante lo stato
tossico (es.: imparare a percorrere una linea retta) e 2)
condizionata, tolleranza al farmaco anche in assenza di
effettiva somministrazione
Tolleranza e farmacodipendenza da
oppioidi
• Per dipendenza fisica si intende lo stato di ipereccitabilità che si
sviluppa nelle cellule del SNC in conseguenza della
somministrazione di una sostanza e e sindrome di astinenza
in seguito ad una brusca riduzione nella dose o alla
• somministrazione di un antagonista degli oppioidi.
• La dipendenza psichica
è invece quello stato di ansia o
depressione che nel paziente si ha all'idea di "interrompere" l'uso di
una sostanza.
• Nel caso della morfina e degli altri analgesici-narcotici la dipendenza
è fisica oltre che psichica e l'interruzione del farmaco provoca una
vera e propria crisi di astinenza, spiegabile con le modificazione
tipiche della tolleranza.
OPPIACEI:
Sindrome d’Astinenza
Manifestazione clinica dovuta alla sospensione di
eroina in un soggetto che ne è fisicamente dipendente.
Sintomatologia speculare ed opposta a quella
causata dall’intossicazione acuta.
Non pericolosa per la vita.
Ansia, craving e disforia dopo 6-12 ore dall’ultima
assunzione di eroina.
Accentuazione progressiva con picco alle 36-72 ore
Attenuazione e scomparsa in 7-10 giorni.
Sindrome di astinenza “protratta” della durata anche
di molti mesi.
OVERDOSE
E’ la causa più comune di exitus, può verificarsi:
•in soggetti che fanno uso per la prima volta della
sostanza;
•per diminuita tolleranza dopo un periodo di astinenza;
•per l'immissione sul mercato di preparati più puri della
sostanza.
•Altra evenienza è quella che può capitare ai “Body
Stuffers” : per trasportare clandestinamente la droga
questa viene confezionata in piccoli contenitori di
plastica che vengono ingeriti, la rottura dei quali può
determinare casi di intossicazione letali.
OVERDOSE
Il paziente in overdose da oppiacei si presenta:
con pupille puntiformi areattive allo stimolo
luminoso;
depressione respiratoria grave con due/tre atti
respiratori al minuto;
riflessi osteotendinei osteotendinei ridotti o assenti;
ipotermico;
in coma;
alcune volte è riscontrabile anche rabdomiolisi;
l'evoluzione è l'arresto cardiorespiratorio.
Antagonisti degli oppiacei
• Naloxone (Narcan) E’ antagonista su tutti i recettori.
Ha una emivita di circa 1-2 ore, l’effetto si ottiene già dopo
1-2 min.
Già a dosi di 1 mg sopprime l’azione degli oppiacei.
Utilizzato nelle sindromi da overdose da oppiacei.
La sua breve emivita rende necessaria la somministrazione
ripetuta, in casi di avvelenamenti gravi.
• Naltrexone (Antaxone, Nalorex, Narcoral) Emivita più
lunga, quindi basta una sola somministrazione.
Può essere utilizzato nei tossicodipendenti come misura
preventiva nei confronti di recidive.
MORFINA: PREGIUDIZI COMUNI E MITI
DA SFATARE
•La morfina utilizzata nel dolore da cancro
comporta raramente depressione respiratoria e
solo in caso di errori grossolani di dosaggio.
•La morfina specie se data per os non genera
dipendenza psichica (tossicomania).
•La morfina non instaura una rapida ed
incontrollata tolleranza.
•La somministrazione di morfina non comporta
fenomeni disforici.
•La morfina non accorcia la vita.
•La morfina non compromette la qualità di vita.
Cannabis e cannabinoidi
Anandamide
Cannabis sativa
D9-THC
Cannabinoidi
Cannabinoidi
• Analoghi della anandamide
• Derivati cannabinioidi inducono nell’uomo
sensazione di benessere, aumento dell’appetito,
bradicardia, vasodilatazione, bronco-dilatazione
e controlla la nausea indotta dai chemioterapici
antineoplastici.
• Utilizzati nelle sindromi spastiche e nella sclerosi
multipla.
• Gli antagonisti inducono iperalgesia e la
presenza dei recettori nei tessuti tende a
dimostrare che gli endocannabinoidi potrebbero
contribuire al controllo della sensibilità dolorosa.
Recettori per i cannabinoidi
K+
NH2
II
G a G bg
GDP
cAMP
COOH
GTP
Adenilato ciclasi
Proteina Gi
+
Na
Effetti antidolorifici dei cannabinoidi
Effetto
centrale.
antinocicettivo
Innalzamento
della
soglia
dolorifica sia a livello centrale
(potenziamento del GABA e
inibizione del glutammato) che
a livello spinale (promuovono il
rilascio di oppiodi nel sistema
discendente di controllo del
dolore).
Efficaci sul dolore neuropatico.
Effetto
antinocicettivo
periferico
di
tipo
mediato
antinfiammatorio,
dall'inibizione
del
rilascio di sostanze algogene
proinfiammatorie da parte delle
cellule del sistema immunitario.
Altri farmaci nel trattamento del dolore cronico
• Si tratta di farmaci, che pur non essendo propriamente
analgesici, vengono utilizzati insieme agli analgesici
tradizionali per il trattamento di particolari sindromi dolorose
•Corticosteroidi
• Antidepressivi
• Anticonvulsivanti
• Bisfosfonati
• Alfa 2 agonisti
• Calcio-antagonisti
• Anestetici locali in somministrazione locale
Steroidi
• Desametasone (Decadron) e
Prednisone (Deltacortene)
• attivi nel controllo del dolore:
• da compressione di nervi e tessuti molli
• da compressione peridurale del midollo
spinale
• metastasi ossee
• dolore da tensione capsulare
• edema cerebrale
Antidepressivi triciclici
• Sono attivi come antidolorifici
forse perché interferiscono con
la ricaptazione di serotonina e
di noradrenalina, due sistemi
neurotrasmettitoriali importanti
per la modulazione inibitoria del
dolore.
• Riducono ansia e depressione
• Migliorano il legame degli
oppioidi ai recettori specifici
(<tolleranza)
Antidepressivi triciclici
• Gli antidepressivi triciclici sono usati nel dolore
di origine neuropatica. Possono anche essere
utilizzati per potenziare l’effetto analgesico della
morfina, ma questo impiego va attentamente
valutato alla luce dei loro effetti collaterali che
vengono ad aggiungersi a quelli dell’oppiaceo.
Potranno ad esempio essere associati quando
nel dolore da cancro si riconosca una
componente neuropatica per compressione o
lesione di tessuto nervoso.
Anticonvulsivanti (antiepilettici)
• Carbamazepina
(Tegretol)
• Fenitoina
(Dintoina)
• Acido valproico
(Depakin)
appartengono al
gruppo dei
bloccanti del
sodio
Utili nel dolore neuropatico
periferico lancinante
Bifosfonati
• INDICAZIONI:
• Trattamento dell’ipercalcemia
• Trattamento del dolore da metastasi ossee
• Prevezione delle complicanze scheletriche nei pazienti
con metastasi ossee
• In ambito oncologico viene utilizzato il Pamidronato
(Aredia : 60-90 mg in 1-2 ore o Zometa : 4 mg in 15-20
minuti una volta al mese)
• Inibiscono l’attività degli osteoclasti, esercitano un
effetto antiinfiammatorio e possono provocare l’apoptosi
degli osteclasti
Bloccanti degli Amminoacidi
eccitatori
• Ketamina: Questo farmaco, utilizzato
soprattutto in anestesia, è tuttavia noto per
i suoi effetti disforici che ne limitano
l’impiego a casi molto particolari ed in
ambito specialistico ha anche effetti
antinocicettivi.
WHO
• If pain occurs, there should be prompt oral
administration of drugs in the following order:
nonopioids (aspirin and paracetamol); then, as
necessary, mild opioids (codeine); then strong
opioids such as morphine, until the patient is free of
pain. To calm fears and anxiety, additional drugs –
“adjuvants” – should be used. To maintain freedom
from pain, drugs should be given “by the clock”, that
is every 3-6 hours, rather than “on demand”. This
three-step approach of administering the right drug
in the right dose at the right time is inexpensive and
80-90%
effective.
Surgical
intervention
on
appropriate nerves may provide further pain relief if
drugs are not wholly effective. (Last update: May 3,
2002)
Uso dei farmaci analgesici
(WHO “ladder”)
Libertà dal dolore
Oppioidi forti
+/- Non oppioidi +/- Adiuvanti
Dolore persistente o aumentato
Oppioidi deboli
+/- Non oppioidi +/- Adiuvanti
Dolore persistente o aumentato
Analgesici non oppioidi
+/- Adiuvanti
Dalla terapia del dolore alle
cure palliative
Le Cure Palliative sono la cura totale prestata alla
persona affetta da una malattia non più responsiva alle
terapie aventi come scopo la guarigione.
Il controllo del dolore,degli altri sintomi e delle
problematiche psicologiche, sociali
e spirituali è di prevalente importanza.
European Association for Palliative Care Newsletter n.1,1989
Cefalea
•
•
•
•
•
•
•
•
•
•
Primaria o idiopatica
Muscolotensiva
Emicrania
Cefalea a grappolo
Secondaria
Malattie infettive
Ipertensione endocranica
Traumi cranici
Tumori celebrari
Iatrogena
Trattamento acuto
dell’emicrania e cefalea a
grappolo
• FANS (aspirina, paracetamolo, ibuprofen,
diclofenac)
• Ergotamina, diidroergotamina
• Triptani (sumatriptan, zolmitriptan)
Profilassi dell’emicrania e
cefalea a grappolo
• β-bloccanti (propranolol, atenololo)
• Valproato