Regolazione dell’equilibrio
acido-base
La regolazione della concentrazione degli ioni idrogeno è
simile alla regolazione di qualunque altro ione, dovendo
esistere un equilibrio fra intake ed escrezione. Benché il
rene rivesta il ruolo fondamentale nel controllo di questo
equilibrio, esistono molti sistemi che esercitano uno
stretto controllo sul valore del pH.
La concentrazione degli idrogenioni è strettamente
controllata perché tutti i sistemi enzimatici hanno un
meccanismo di funzionamento che dipende al valore
del pH. La concentrazione degli H+ è molto bassa
rispetto a quella di altri ioni ed è circa 4 · 10-5 mEq/l.
Molecole che rilasciano ioni idrogeno in soluzione sono
dette acidi. Ad esempio HCl in acqua si ionizza in ioni
H+ e Cl-. Similmente H2CO3 si dissocia formando H+ e
HCO3-
Una base è uno ione o una molecola che può
accettare ioni idrogeno. Per esempio HCO3- è una
base perché accetta ioni H+ per formare acido
carbonico. In genere le proteine funzionano come basi
perché gli aa carichi negativamente tendono ad
attrarre ioni H+. L’emoglobina ed altre proteine
plasmatiche sono fra le basi più importanti
dell’organismo.
Si definisce acido forte un acido che rapidamente
e totalmente si dissocia per formare H+ e X- (HCl),
mentre un acido debole è un acido che si dissocia
lentamente e non completamente (H2CO3).
Similmente si definisce base forte una base che
accetta ioni H+ facilmente (OH- che lega ioni H+
per formare acqua). Una base debole accetta ioni
H+ più difficilmente (HCO3-).
Considerata la bassa concentrazione di ioni H+ nel
sangue è meglio esprimere questo valore in termini
logaritmici come:
pH= log 1/[H+] = -log [H+]
da cui si ricava che il valore di pH è inversamente
proporzionale alla concentrazione degli
idrogenioni.
Il normale valore del pH arterioso è 7.4, mentre
quello venoso è circa 7.35 per la presenza di
maggiori quantità di CO2 rilasciata dai tessuti.
Questi valori devono essere assolutamente
costanti con possibilità di minime variazioni (7.0 ≤
pH ≤ 8.0). Il pH intracellulare è normalmente più
basso perché il metabolismo cellulare produce
acidi. Il pH delle urine può variare fra 4.5 e 8.0 a
seconda delle necessità. Il pH più basso
nell’organismo si ritrova nello stomaco durante la
digestione, dove si arriva fino a 0.8.
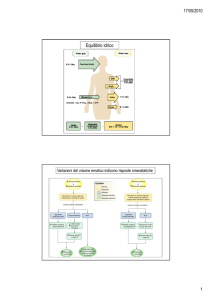
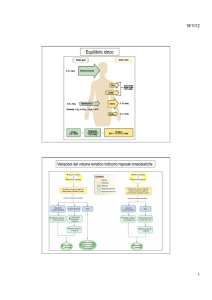
Difese per le variazioni di pH
Esistono tre sistemi principali che regolano la
concentrazione di idrogenioni nei fluidi corporei per
prevenire acidosi ed alcalosi.
i. Sistemi buffer acido-base: si combinano
immediatamente con H+ per evitare variazioni
eccessive del pH
ii. Centro respiratorio: regola la rimozione di CO2
e quindi di H2CO3
iii. Sistema renale: elimina urine acide o basiche
riportando la concentrazione di idrogenioni ai
valori normali.
pH
Sistemi buffer
rapidi
Sistema polmonare
per il controllo di
CO2
Sistema
renale per
il controllo
di H+
più abbondante
più adatto come pK
fondamentali
all’interno della
cellula
Quando c’è una variazione nella concentrazione
degli idrogenioni, i sistemi buffer reagiscono entro
pochi secondi per minimizzare le variazioni di pH.
La seconda linea di difesa è rappresentata dal
sistema respiratorio che elimina CO2 dall’organismo.
Questi due sistemi controllano il valore di pH finché
non interviene il sistema renale che elimina
l’eccesso di acido o base dall’organismo. Questo
sistema, benché sia il più efficace, è però anche il
più lento a rispondere.
Un tampone è una sostanza che si lega reversibilmente a
ioni H+ secondo la seguente regola:
Buffer + H+ ↔ H-Buffer (acido debole)
Se la concentrazione di idrogenioni aumenta, la reazione si
sposta a destra, mentre a sinistra se la concentrazione di
idrogenioni diminuisce, in modo da minimizzare le variazioni
di H+.
Questi sistemi buffer sono fondamentali per tamponare
l’eccesso di H+ che deriva dall’ingestione esterna e dalla
produzione endogena.
Vediamo quali sono questi sistemi.
Il sistema buffer più diffuso è il sistema bicarbonato che
prevede:
i. un acido debole H2CO3
ii. un sale di bicarbonato NaHCO3
L’acido debole viene formato nell’organismo dalla reazione di
idratazione della CO2
CO2 + H2O ↔ H2CO3
catalizzata dall’enzima anidrasi carbonica che è abbondante
nelle pareti degli alveoli polmonari e nelle cellule dell’epitelio
tubulare.
Il sistema di buffer completo è dato da:
CO2 + H2O ↔ H2CO3
H+ + HCO3AC
eccesso di H+
Quando si aggiunge un acido forte come HCl, l’aumento
degli idrogenioni sposta la reazione verso sinistra formando
acido carbonico che a sua volta forma CO2 e acqua.
L’eccesso di anidride carbonica stimola l’attività respiratoria
per eliminarla.
Quando si aggiunge una base forte come NaOH questa si
combina con acido carbonico per formare ione bicarbonato.
In questo modo una base forte (NaOH) è sostituita
da una base debole (NaHCO3). L’acido carbonico
diminuisce nel processo di titolazione e quindi la
CO2 a sua volta diminuisce per idratarsi e formare
nuovo H2CO3 . La respirazione viene rallentata e
così l’eliminazione di CO2.
CO2 + H2O ↔ H2CO3
con un acido forte
CO2 + H2O
H2CO3 + HCl
Stimolazione
dell’attività
respiratoria per
eliminare la CO2
H+ + HCO3con una base forte
H2CO3 + NaOH
NaCO3 + H2O
H2CO3 diminuisce nel
processo di titolazione e
nuova CO2 si deve idratare
per formare nuovo acido
carbonico. La respirazione
viene rallentata.
Costante di dissociazione dell’acido carbonico
H2CO3
H+ + HCO3-
K’= (H+ x HCO3-) / H2CO3
H+= K x (0.03 x PCO2 / HCO3-)
L’equazione sotto riportata rappresenta l’equazione
di Handerson-Hasselbalch per il sistema
bicarbonato. pK vale circa 6.1 e 0.03 · PACO2 sta ad
indicare che 0.03mM di H2CO3 è presente nel
sangue per ogni mmHg di PCO2
La concentrazione del bicarbonato è regolata
principalmente dal sistema renale, mentre la
pressione parziale della CO2 nel fluido
extracellulare è controllata dalla rate respiratoria.
Questo tampone ha quindi il vantaggio di essere
sotto il controllo di due sistemi che giocano nella
regolazione del pH.
Quando un’alterazione dell’equilibrio acido-base
deriva da variazioni del bicarbonato si parla di
disordini acido-base metabolici. Quando
l’alterazione deriva da variazioni della PCO2 si parla
di disordini acido-base di tipo respiratorio
pH=pK + log HCO3- / 0.03PCO2
Intervallo in cui il
tampone bicarbonato
funziona
A questo valore il pH è
uguale al valore di pK e
la capacità del buffer è
la massima. Il rapporto
fra HCO3- e CO2 è 1
Il sistema fosfato
L’acido fosforico si trasforma rapidamente in
diidrogeno fosfato, H2PO4-. H2PO4- è un buffer
eccellente poiché può tanto riprender un H+ formando
acido fosforico, quanto cedere un altro idrogeno a
formare HPO42- . In condizioni estreme può infine
ceder l’ultimo idrogeno.
Se H2PO4- è in una soluzione acida, la reazione si
sposta a sinistra a formare H3PO4, mentre se è in
una soluzione basica la reazione procede verso
destra. Quindi questo sistema può accettare o
donare ioni H+ a seconda della soluzione in cui si
trova.
Il tampone fosfato è meno importante del sistema
bicarbonato perché nei fluidi extracellulari è molto meno
concentrato. Risulta invece un sistema importante a livello
renale perché il fosfato si concentra nel tubulo renale ed
inoltre il pH nel tubulo è inferiore a 7.4 portandosi quindi
molto vicino al pK del sistema fosfato che quindi ha un
ottimo potere tampone.
Il sistema fosfato è un ottimo tampone intracellulare dove
risulta molto concentrato ed inoltre anche qui il pH
intracellulare è molto vicino al pK del sistema rendendolo
quindi molto efficace.
Gli aa possono accettare o donare ioni idrogeno
rendendoli buffer eccellenti. Ogni proteina ha
tipicamente centinaia di aa, cosicché le proteine
sono ottimi buffer. Si trovano nel sangue e
all’interno delle cellule.
Controllo renale dell’equilibrio acido-base
I reni controllano il valore del pH eliminando urine acide o
basiche. L’eliminazione di urina acida consente di eliminare
l’eccesso di acido, mentre l’escrezione di urine basiche
rimuove basi dai fluidi extracellulari. Il bicarbonato è filtrato a
livello glomerulare e i protoni sono secreti a livello tubulare e
quindi rimossi dal sangue.
Se secrezione H+ > filtrazione HCO3-
urine acide
Se secrezione H+ < filtrazione HCO3-
urine basiche
Acidi non-volatili
Giornalmente sono prodotti circa 80 mEq di acidi non-volatili
derivati dal metabolismo proteico, quali acido solforico (ox di
aa con S come Met e Cys) e acido fosforico dal metabolismo
di acidi nucleici e fosfolipidi. Sono non-volatili e quindi non
eliminabili attraverso la via polmonare. L’eliminazione è a
carico renale.
Ogni giorno a livello renale sono filtrati 4320mEq di HCO3(180 l/die x 24 mEq/l) che non devono essere persi con le
urine, ma recuperati.
Per recuperare questo bicarbonato si deve
formare acido carbonico il che significa che
4320mEq di ioni H+ devono essere secreti per
riassorbire il bicarbonato. Inoltre 80mEq aggiuntivi
devono essere secreti per eliminare il carico acido
derivato dal metabolismo sopra citato.
Quindi in totale giornalmente abbiamo:
4320 + 80 = 4400 mEq H+ secreti dal tubulo
In condizioni di alcalosi i reni aumentano la quantità
di bicarbonato escreto. Gli idrogenioni non devono
quindi essere utilizzati per il recupero di bicarbonato
e non vengono quindi secreti, il che equivale ad
aumentare gli idrogenioni nel liquido extracellulare.
In condizioni di acidosi i reni riassorbono tutto il
bicarbonato filtrato e ne producono ex-novo che
serve a ripristinare quello perso nella titolazione
degli acidi.
Quindi:
i reni regolano la concentrazione di ioni H+
attraverso tre meccanismi:
secrezione di ioni idrogeno
riassorbimento del bicarbonato filtrato
produzione di nuovi ioni bicarbonato
Secrezione di ioni H+ e riassorbimento
di bicarbonato nel tubulo renale
Secrezione di idrogenioni e riassorbimento di
bicarbonato avvengono in ogni parte del nefrone
fatta eccezione per TDs e TAs dell’ansa. Ricordiamo
che per ogni bicarbonato riassorbito deve essere
secreto un idrogenione. La secrezione di ioni H+
avviene con modalità differenti nelle varie parti del
nefrone.
3240 mEq/die
4320mEq/die
648mEq/die
Riassorbimento di bicarbonato in varie porzioni del nefrone
TCP
Schema generale di secrezione di ioni H+ nel lume.
Contro-trasporto Na-H grazie al gradiente stabilito
dalla Na-K ATPasi. In questo modo sono secreti
giornalmente 3900mEq di H+.
Il fluido tubulare diviene molto acido solo nel
nefrone distale.
Recupero del bicarbonato
Riassorbimento di carbonato nel TCP
http://sprojects.mmi.mcgill.ca/nephrology/presentation/presentation1.htm
i.
CO2 nella cellula viene idratata in presenza
dell’anidrasi carbonica
ii.
H2CO3 si dissocia in H+ e HCO3-
iii.
H+ in contro-trasporto con Na+ è secreto nel
lume dove si combina con HCO3- filtrato per
dare acido carbonico che si dissocia in acqua
e anidride carbonica
iv.
HCO3- è riassorbito nel sangue
Quindi, ogni volta che si forma uno ione
idrogeno nelle cellule dell’epitelio
tubulare, si forma anche uno ione
bicarbonato che viene rilasciato nel
sangue. Il risultato è il riassorbimento di
bicarbonato dal filtrato tubulare.
In alcalosi metabolica c’è un eccesso di ioni
bicarbonato rispetto agli idrogenioni. Il bicarbonato non
viene totalmente riassorbito, ma rimane nelle urine per
essere escreto.
In acidosi metabolica c’è un eccesso di ioni H+ rispetto
al bicarbonato che verrà totalmente riassorbito e quindi
saranno gli ioni H+ a rimanere nelle urine. Questi ioni
H+ devono essere titolati da sistemi tampone (fosfato ed
ammonio) ed eliminati come sali
La secrezione di ioni H+ nella parte distale del TCD e nel
DC avviene attraverso un meccanismo di trasporto attivo.
La maggiore differenza con TCP è proprio che in questa
parte del nefrone esiste una pompa idrogenionica che
muove gli ioni H+ dall’interno della cellula, dove si
formano a partire dalla reazione di idratazione della CO2
ad opera dell’anidrasi carbonica, al lume tubulare.
In questa parte del nefrone la pompa riesce a stabilire un
gradiente idrogenionico altissimo che porta il pH fino a
circa 4.5 che è il limite inferiore raggiungibile nel rene.
Cellule
intercalate
1.
In TCD e
DC gli
ioni H+
sono
secreti
da una
pompa
idrogeno
che usa
ATP
CO2 cellulare
idratata con
formazione di
H2CO3 e quindi
di H+ e HCO3-
In caso di acidosi, quando si presenta la necessità di
eliminare un eccesso di ioni H+, solo una piccola parte di
idrogenioni può rimanere in forma ionica nelle urine,
perché altrimenti il valore di pH scenderebbe troppo
danneggiando il tessuto.
Per fare un esempio, per eliminare 80mEq/die di
idrogenioni derivati da acidi non-volatili, bisognerebbe
eliminare 2667 litri di urina se gli idrogenioni rimanessero
in forma ionica!!!!!
Quando gli ioni H+ sono in eccesso rispetto al
bicarbonato filtrato, gli ioni H+ sono tamponati da
altri sistemi tampone che sono il sistema fosfato e
il tampone ammoniacale. In questo modo si
formano nuovi ioni bicarbonato che sono
riassorbiti: questa quota costituisce il
bicarbonato ex-novo.
Entrambi i due componenti del sistema tampone
risultano concentrati nelle urine perché sono
scarsamente riassorbiti. Inoltre, siccome le urine
sono sempre lievemente acide rispetto ai fluidi
extracellulari, questo tampone lavora in un ambiente
con un pH molto vicino al pK, che è la situazione
ideale per un sistema tampone.
Escreto come sale di Na+
Quindi, tutte le volte che uno ione idrogeno
secreto nel lume tubulare, si combina con un
buffer che non sia bicarbonato, l’effetto netto è
l’aggiunta di nuovo bicarbonato nel sangue.
Questo avviene tutte le volte che tutto il
bicarbonato è stato riassorbito per la titolazione
degli H+. Quando il tampone bicarbonato è
esaurito nel filtrato, si presenta la necessità di
nuovo bicarbonato e titolazione con un altro buffer.
Il secondo sistema tampone è il sistema formato da
ammoniaca (NH3) e ione ammonio (NH4+). Quest’ultimo
è formato dalla glutammina che è trasportata attivamente
all’interno del TCP, del TAS, TCD e DC.
Il trasporto di ioni ammonio è diverso a seconda che si
parli di TCP o DC.
Nel primo caso (TCP) viene immesso ione ammonio nel
lume tubulare e lo ione bicarbonato è riassorbito.
Nel secondo caso (DC) la membrana tubulare non è
permeabile allo ione ammonio e quindi è secreta
ammoniaca che legando poi idrogenioni forma ioni
NH4+ che restano intrappolati nel lume.
TCP
In TCP dalla glutammina
si formano 2NH4+ e
2HCO3-. Gli ioni ammonio
sono secreti nel lume,
mentre gli ioni
bicarbonato di nuova
sintesi sono riassorbiti
NEW
nel sangue.
DC
Intrappolamento dello ione ammonio
Acidosi: aumento dell’escrezione netta di idrogenioni,
con aumento dell’escrezione di ioni ammonio. Sintesi
ex-novo di bicarbonato riassorbito nel sangue
Alcalosi: escrezione di ioni ammonio a zero, mentre
aumenta l’escrezione di ioni bicarbonato. Quindi
perdita netta di bicarbonato dal sangue (secrezione
acida negativa) e nessuna sintesi ex-novo di
bicarbonato
Alcalosi
Acidosi
HCO3
PACO2
metabolica
respiratoria
Diminuzione
del
bicarbonato
Aumento della
CO2 nel plasma
-
HCO3metabolica
Aumento del
bicarbonato nel
plasma
PACO2
respiratoria
Diminuzione
della CO2 per
iperventilazione