Le macchine termiche
•
•
•
Il primo principio ci offre la possibilità di trasformare
energia interna, calore in lavoro meccanico
Le macchine che realizzano queste trasformazioni di
chiamano “macchine termiche”
esempi di macchine termiche:
– Il motore dell’automobile
– Le vecchie locomotive a vapore
•
Gli stessi principi vengono utilizzate dai
– Frigoriferi, condizionatori, pompe di calore
P
Pi
i
f
Pf
T
Vi
DU = 0
•
•
•
•
•
•
Vf
V
Q=W
Una espansione isoterma trasforma tutto il calore assorbito dal serbatoio
di calore a temperatura T in lavoro meccanico
Una volta raggiunta la pressione atmosferica l’espansione si arresta
Così anche la produzione di lavoro
Occorre riportare il sistema al punto di partenza e ripetere l’espansione
La macchina termica deve operare su un ciclo
Perché ci sia una reale produzione di lavoro occorre far tornare indietro il
sistema lungo una isoterma a temperatura più bassa
G.M. - Edile-Architettura 2004/05
Rendimento di una macchina termica
•
Se ritorno indietro lungo una isoterma a temperatura
più bassa,
– il lavoro da effettuare, area in rosa, per riportare il
sistema nello stato iniziale è più piccolo di quello
ottenuto nella prima fase
– Nel ciclo si ottiene una produzione netta, positiva, di
lavoro del sistema sull’ambiente esterno
• Il lavoro è rappresentato dall’area racchiusa dal ciclo
• Se il ciclo viene percorso in verso orario, come è il caso
descritto, il lavoro è positivo (il sistema fa lavoro
sull’esterno)
P
Pi
i
DU = Q - W
DUii = 0 Þ
h
W= Q
f
Pf
T
g
Vi
Vf
V
• Se il ciclo viene percorso in verso antiorario, il lavoro è negativo, allora è l’ambiente esterno
ad effettuare un lavoro sul sistema
•
•
•
•
Si osservi che sulla isoterma if il sistema assorbe un calore Q pari al lavoro
effettuato (area sotto la trasformazione, grigia)
Nella isoterma gh il calore è negativo, viene ceduto dal sistema all’ambiente
esterno
Lungo le isocore in una il calore viene assorbito (hi) nell’altra viene ceduto (gf).
W
Si definisce rendimento di una macchina termica il rapporto tra
h=
il lavoro prodotto nel ciclo e il calore comunque assorbito nel ciclo:
Qass
G.M. - Edile-Architettura 2004/05
Macchine termiche che lavorano tra due
serbatoi
DU = Q - W
•
•
•
•
•
DUii = 0 Þ
Le macchine termiche sono sistemi termodinamici che
descrivono un ciclo
C’è una parte del ciclo in cui il sistema assorbe calore
da uno o più serbatoi presenti nell’ambiente esterno
C’è un’altra parte del ciclo in cui il sistema cede calore
ad uno o più serbatoi presenti nell’ambiente esterno
Nel ciclo il sistema esegue un lavoro netto positivo
sull’ambiente esterno
W
h=
Qass
W
Un caso particolare di macchina termica è quella che
lavora tra due serbatoi
– Schematizzabile come nella figura a lato
– La macchina assorbe calore Q1 dal serbatoio a
temperatura più elevata T1
– Cede il calore Q2 al serbatoio a temperatura inferiore T2
– Produce il lavoro W
•
W= Q
Il rendimento della macchina è dato da
h=
W
Q1
h=
Q1 - Q2
Q1
=1 -
Q2
Q1
G.M. - Edile-Architettura 2004/05
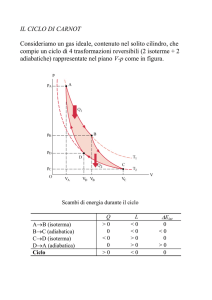
La macchina e il ciclo di Carnot
•
•
La macchina di Carnot è la macchina reversibile che opera
con due soli serbatoi di calore
Il ciclo è costituito da
– due isoterme (alle temperature T1 e T2)
– e da due adiabatiche (è l’unica trasformazione reversibile che
non richiede ulteriori serbatoi di calore)
– Nella figura è rappresentato il ciclo di Carnot percorso da un
gas perfetto
W
•
Scegliendo il punto b
dove far finire
l’espansione isoterma, si
può variare il lavoro
fatto dalla macchina in
un ciclo.
•
Tutte le macchine reversibili che operano con due
soli serbatoi di calore sono macchine di Carnot
Il ciclo può essere percorso da una qualsiasi
sostanza: gas perfetto, gas reale, acqua e vapor
d’acqua, freon, etc.
•
G.M. - Edile-Architettura 2004/05
Studio del ciclo di Carnot percorso da un gas
perfetto
•
DU = Q - W
Trasformazione ab - Espansione isoterma
– DU=0, Q1=Wab
– La trasformazione è reversibile: possiamo
suddividerla in tratti infinitesimi
– Il lavoro in ciascun tratto infinitesimo sarà:
dW=PdV
– Il lavoro complessivo
ò
b
ò
b
nRT1
Wab = PdV =
dV = nRT1
V
a
a
V
= nRT1[lnV ] ba = nRT1ln b
Va
ò
b
a
dV
=
V
Vb
Va
– Dato che Vb è maggiore di Va (espansione) il lavoro è positivo
– Il calore Q1 è uguale al lavoro: è anch’esso positivo (calore assorbito)
G.M. - Edile-Architettura 2004/05
Studio del ciclo di Carnot percorso da un gas
perfetto
•
DU = Q - W
Trasformazione bc - Espansione adiabatica
– Qbc=0, DUbc =-Wbc
– La variazione di DU energia del gas perfetto
DUbc = nCV (T2 - T1 )
– Dato che T2 è più piccolo di T1, DU <0
– Il lavoro W è maggiore di zero (il lavoro viene
fatto dal sistema sull’ambente esterno
Wbc = -nCV ( T2 - T1)
•
Trasformazione cd - Compressione isoterma
– DU=0, Q2=Wcd
– Operando come sulla trasformazione ab, otteniamo
il lavoro complessivo
Va
Vd Vb
Vc
Vd
Wcd = nRT2 ln
Vc
– Dato che Vd è minore di Vc (compressione), il lavoro è negativo
– Il calore Q2 è uguale al lavoro: è anch’esso negativo (calore ceduto)
G.M. - Edile-Architettura 2004/05
Studio del ciclo di Carnot percorso da un gas
perfetto
DU = Q - W
•
Trasformazione da - Compressione adiabatica
– Qda=0, DUda =-Wda
– La variazione di DU energia del gas perfetto
DUda = nCV ( T1 - T2 )
– Dato che T2 è più piccolo di T1, DU >0
– Il lavoro W è minore di zero (il lavoro viene fatto
sul sistema dall’ambente esterno
Wda = -nCV ( T1 - T2 )
•
•
•
Si osservi che Wda=-Wbc
Il lavoro complessivo svolto nel ciclo sarà:
W=Wab+Wbc+Wcd+Wda
W = nRT1ln
Il calore assorbito nel ciclo è solo Q1=Wab
Q1 = nRT1ln
•
Va
Vb
Va
Il rendimento del ciclo di Carnot
h=
W
=
Q1
Vd Vb
Vc
Vb
V
+ nRT2ln d
Va
Vc
Vb
V
V
+ nRT2ln d
ln d
Va
Vc
T2 Vc
=
1+
V
T1 ln Vb
nRT1ln b
G.M.
Va - Edile-Architettura 2004/05
Va
nRT1ln
DU = Q - W
Studio del ciclo di Carnot
percorso da un gas perfetto
Vb
V
V
+ nRT2ln d
ln d
W
Va
Vc
T2 Vc
h=
=
=
1+
V
Q1
T1 ln Vb
nRT1ln b
Va
Va
V
ln d
• Vogliamo far vedere che:
Vc
Vb = -1
ln
Va
nRT1ln
ab isoterma
Pa Va = PbVb
bc adiabatica
cd isoterma
PbVbg = Pc Vcg
Pc Vc = PdVd
da adiabatica
PdVdg
=
•
Pa Vag
g -1
æ Vc ö
=ç ÷
è Vd ø
g-1
Vb Vc
=
Va Vd
Va
Vc
Moltiplicando tutti i primi membri e
tutti i secondi membri tra loro
PaVaPb Vbg PcVcPdVdg = PbVb PcVcg Pd Vd Pa Vag
VaVbg VcVdg = Vb Vcg Vd Vag
æ Vb ö
ç ÷
è Va ø
Vd Vb
Vbg-1Vdg -1 = Vcg -1Vag -1
h = 1-
T2
T1
G.M. - Edile-Architettura 2004/05
Il frigorifero
•
•
•
Il ciclo di Carnot è un ciclo reversibile
Quindi può essere percorso all’indietro
Ma quando una trasformazione viene percorsa al
contrario
–
–
–
–
•
Si invertono i segni degli scambi energetici
Sicuramente cambia segno DU
Ma anche W e Q
Quelle che erano le quantità assorbite diventano cedute e
viceversa
w
quindi la macchina di Carnot lavorando al contrario
– assorbe il lavoro W
– assorbe il calore Q2 dal serbatoio più freddo
– cede la quantità di calore Q1 al serbatoio più caldo
•
•
Abbiamo realizzato un frigorifero
Si definisce coefficiente di prestazione del frigorifero
e=
Q2
Q2
=
W
Q1 - Q2
G.M. - Edile-Architettura 2004/05
Il secondo principio della Termodinamica Enunciato di Kelvin-Plank
•
Le macchine termiche sono sistemi termodinamici che
descrivono un ciclo
• C’è una parte del ciclo in cui il sistema assorbe calore da
uno o più serbatoi presenti nell’ambiente esterno
• C’è un’altra parte del ciclo in cui il sistema cede calore ad
uno o più serbatoi presenti nell’ambiente esterno
• Nel ciclo il sistema esegue un lavoro netto positivo
sull’ambiente esterno
• è impossibile realizzare un processo il cui unico risultato sia quello di
assorbire calore da un serbatoio e di convertirlo completamente in lavoro.
h=
Q1 - Q2
Q1
=1 -
Q2
Q1
<1
T1
W
Macchina monoterma
W(=Q1)
Q1
Q1 £ 0
G.M. - Edile-Architettura 2004/05
Il secondo principio della Termodinamica Enunciato di Clausius
•
non è possibile realizzare un processo il cui unico risultato sia
quello di far passare del calore da un corpo più freddo ad uno più
caldo.
•
•
Il passaggio di calore da un corpo più freddo ad uno più caldo
deve essere sempre accompagnato da qualche altra modifica da
qualche altra parte nell’universo
Ossia c’è bisogno di un lavoro esterno
G.M. - Edile-Architettura 2004/05
Verifica dell’equivalenza tra le due
formulazioni
•
•
Si può vedere che violando una formulazione è violata anche l’altra
Supponiamo che esiste una macchina termica che riesca a trasformare tutto
il calore estratto da un serbatoio a temperatura T1 in lavoro meccanico.
Posso usare questa macchina accoppiandola ad una macchina di Carnot che
facciamo lavorare come frigorifero
•
–
T1
Q1
Il lavoro prodotto dalla prima macchina viene utilizzato per far funzionare il
frigorifero
W
T2
T1
•
•
L’effetto cumulativo delle due
macchine è un frigorifero ideale che
preleva il calore Q2 dal serbatoio più
freddo e lo trasferisce a quello più caldo
senza richiedere alcun lavoro
dall’esterno
Questa macchina viola la seconda
formulazione del II principio
W Q'1
Q2
T2
T1
Q1
T1
W= Q1
Q2
T2
Q'1= Q2+ Q1
Q2
Q2
T2
G.M. - Edile-Architettura 2004/05
Irreversibilità e II principio
•
•
Il secondo principio della termodinamica ci fa capire perché alcune trasformazioni
sono irreversibili
Prendiamo il passaggio di calore tra due corpi inizialmente a temperatura differente:
–
•
Il secondo principio ci impedisce di realizzare la condizione di partenza perché bisogna
trasferire del calore da un corpo più freddo ad uno più caldo è per fare questo occorre
produrre qualche altra modifica da qualche altra parte nell’universo
prendiamo un pendolo messo in oscillazione che dopo un po’ si ferma perdendo la sua
energia meccanica in energia interna dell’aria e dei corpi interessati
–
–
Per ripristinare la situazione iniziale occorrerebbe estrarre dall’aria e dai corpi questa energia
interna e ritrasformala, tutta, in lavoro (energia meccanica)
Il secondo principio ci impedisce di fare questo: una parte dell’energia non può essere
trasformata in lavoro meccanico e deve essere ceduto ad un serbatoio a temperatura più bassa.
G.M. - Edile-Architettura 2004/05
Il teorema di Carnot
• Tutte le macchine che lavorano tra due termostati hanno
un rendimento che è minore, o al massimo uguale, a quello
di una macchina di Carnot che lavori tra gli stessi due
termostati.
• tutte le macchine reversibili (tutte le macchine di Carnot)
che lavorano tra gli stessi termostati hanno, tutte, lo stesso
rendimento.
•
•
•
•
La dimostrazione si fa per assurdo:
Supponiamo che esista una macchina X che lavora tra i due
termostati a temperatura T1 e T2 che abbia un rendimento maggiore
della macchina di Carnot operante tra gli stessi termostati
Regolando il ciclo della macchina di Carnot facciamo in modo che
il lavoro fatto dalle due macchine in un ciclo sia uguale
Consideriamo positive tutte le quantità di calore, per distinguere il
calore assorbito da quello ceduto useremo esplicitamente il segno
Q’1
Q’2
w
C
G.M. - Edile-Architettura 2004/05
Il teorema di Carnot
W
hX =
Q'1
hC =
hX > hC Þ
W = Q'1 - Q'2
W = Q1 - Q2
W
W
>
Q'1
Q1
Q’1
W
Q1
Þ Q1 > Q'1
Þ Q'1 - Q'2 = Q1 - Q2
Q’2
Þ Q2 - Q'2 = Q1 - Q'1
Q1 - Q'1 > 0
Q2 - Q'2 > 0
w
C
G.M. - Edile-Architettura 2004/05
Il teorema di Carnot
•
•
•
•
•
•
•
•
Se combiniamo le due macchine otteniamo una macchina che trasferisce il
calore Q=Q2-Q’2 (>0) dal serbatoio a temperatura più bassa a quello a
temperatura più alta senza richiedere alcuna altra modificazione
nell’universo.
Contraddice il secondo Principio della Termodinamica
hX £ hC cvd
L’ipotesi da cui siamo partiti è falsa. Quindi
Dimostrazione della 2a parte
Se la macchina X è
reversibile allora il suo ciclo
può essere invertito e si può
scambiare il ruolo della
macchina X con quello della
macchina di Carnot
Ripetendo lo stesso
ragionamento a ruoli invertiti
hC £ hXrev
otterremo:
Le due relazioni precedenti devono essere vere contemporaneamente.
hXrev = hC cvd
Questo accade solo se
G.M. - Edile-Architettura 2004/05
Conseguenze del teorema di Carnot
•
•
Dati due termostati a temperatura diversa, la maniera più efficiente per
trasformare calore in lavoro meccanico è quello di utilizzare una macchina di
Carnot.
il rendimento di una macchina di Carnot è indipendente dalla sostanza
impiegata per percorre il ciclo, gas perfetto, gas reale, acqua e vapore d’acqua,
freon. etc, dipende solo dalle temperature dei termostati tra cui opera:
– Abbiamo già calcolato il rendimento di una macchina di Carnot operante con un
gas perfetto
h =1•
T2
T1
Tutte le macchine di Carnot operanti tra questi due termostati avranno tutti lo
stesso rendimento appena calcolato.
G.M. - Edile-Architettura 2004/05
La temperatura termodinamica o assoluta
•
•
•
Il teorema di Carnot ci permette di definire una ulteriore scala di temperatura
Infatti se prendiamo una macchina di Carnot che opera tra il corpo di cui si vuole
conoscere la temperatura e il sistema del punto triplo
Dalla definizione di rendimento
hdef = 1hC = 1•
•
•
Qtr
Q
Ttr
T
Þ
Qtr Ttr
=
Q T
Þ T = 273.16
Ttr
Q
K
Qtr
Il calore scambiato da una macchina di Carnot gioca il ruolo di
caratteristica termometrica
Questa nuova definizione della temperatura, è equivalente alla
scala di temperatura del gas perfetto per tutte le temperature
misurabili col gas perfetto
Estende fino allo zero assoluto l’intervallo di temperature
misurabili, perché all’interno della macchina di Carnot ci
possiamo mettere qualunque sostanza.
G.M. - Edile-Architettura 2004/05
•
Un inventore sostiene di aver inventato cinque motori, ciascuno operante tra i serbatoi termici
a 400 e 300 K. Per ogni ciclo, i dati di ogni motore sono i seguenti:
–
–
–
–
–
–
Qa=200 J, Qc=-175 J, W=40 J
Qa=200 J, Qc=-150 J, W=50 J
Qa=600 J, Qc=-200 J, W=400 J
Qa=100 J, Qc=-90 J, W=10 J
Qa=500 J, Qc=-200 J, W=400 J
Dire quali dei due principi della termodinamica (eventualmente entrambi) vengono violati da ciascun
motore. Nel caso invece entrambi i principi della termodinamica risultino soddisfatti, stabilire se il
ciclo è reversibile
hC =1•
T2
300
=1= 0.25
T1
400
Applic
azione
h £ hC
No primo
•
Ok primo, ok secondo, reversibile
•
Ok primo, no secondo
•
Ok primo, ok secondo, non reversibile
•
No primo
W
50
=
= .25
Qass 200
W 400
h3 =
=
= .66
Qass 600
W
10
h4 =
=
= .10
Qass 100
h2 =
G.M. - Edile-Architettura 2004/05
•
Una macchina termica a combustione interna, il motore dell'automobile a benzina, può
essere approssimata con il ciclo mostrato in figura. Si supponga che la miscela aria-benzina
possa essere considerato un gas perfetto e che venga utilizzato un rapporto di compressione
4 a 1 (V4 = 4V1). Si supponga inoltre che p2=3p1.
–
–
–
Determinate la pressione e la temperatura in ognuno dei quattro vertici del diagramma p-V in
funzione di p1 e T1, e del rapporto g dei calori specifici del gas.
Esprimere il rendimento del ciclo in funzione del rapporto di compressione.
Confrontare con il rendimento di una macchina di Carnot che lavora tra le temperature estreme.
3p1
•
•
Applic
azione
Questo ciclo è denominato “ciclo Otto” ed è il ciclo
secondo cui funziona il motore benzina.
Punto 2
V2 = V1
P2 = 3P1
T2 =
P2V2 3P1V1
=
= 3T1
nR R P1V1
RT1
•
2
Adiabatica
3
Scoppio
p1
1
Adiabatica
4
V1
V4
Punto 3
V3 = V4 = 4V1
V2g
V1g
P3 = P2 g = 3P1 g g = 3´ 4-g P1
V3
4 V1
P3V3 3´ 4-g P1 ´ 4 ´V1
T3 =
=
= 3´ 41-g T1
PV
nR
R 1 1
RT1 G.M. - Edile-Architettura 2004/05
•
Una macchina termica a combustione interna, il motore dell'automobile a benzina, può
essere approssimata con il ciclo mostrato in figura. Si supponga che la miscela aria-benzina
possa essere considerato un gas perfetto e che venga utilizzato un rapporto di compressione
4 a 1 (V4 = 4V1). Si supponga inoltre che p2=3p1.
–
–
–
Determinate la pressione e la temperatura in ognuno dei quattro vertici del diagramma p-V in
funzione di p1 e T1, e del rapporto g dei calori specifici del gas.
Esprimere il rendimento del ciclo in funzione del rapporto di compressione.
Confrontare con il rendimento di una macchina di Carnot che lavora tra le temperature estreme.
3p1
V4 = 4V1
•
Applic
azione
Punto 4
V
r = 4 =4
V1
Adiabatica
3
Scoppio
V1g
V1g
P4 = P1 g = P1 g g = 4-g P1
V4
4 V1
p1
P4V4 4-g P1 ´ 4 ´V1
T4 =
=
= 41-g T1
PV
nR
R 1 1
RT1
4
nCV (T4 - T3 )
(
W
Qced
h=
=1+
=1+
=1+
Qass
Qass
nCV (T2 - T1 )
1-g
T4
41-g T1
1
hC =1- =1=1T2
3T1
3´ 4g -1
2
- 3´ 41-g ) T1
(3-1) T1
1
Adiabatica
4
V1
V4
41-g (1- 3)
1
=1+
=1- g -1
4
(3-1)
G.M. - Edile-Architettura 2004/05
•
•
In un ciclo di Carnot l'espansione isoterma di un gas ideale avviene a 412 K e la
compressione isoterma a 297 K. Durante l'espansione il gas assorbe 2090 J di energia
termica.
Determinare:
–
–
–
–
•
Applic
azione
Il lavoro fatto dal gas durante l'espansione isoterma
Il calore ceduto dal gas durante la compressione isoterma
Il lavoro fatto sul gas durante la compressione isoterma
Il rendimento del ciclo.
O
G.M. - Edile-Architettura 2004/05
•
Una macchina termica ciclica funziona tra due sorgenti costituite rispettivamente da una
massa m di vapore d'acqua a 100°C e da una massa m1=1kg di ghiaccio a 0°C. la macchina
preleva calore dalla sorgente calda e viene fatta funzionare finché tutto il ghiaccio si è fuso o
il vapore si è liquefatto.
–
–
la macchina termica sia irreversibile con rendimento h*=0,2: quale deve essere il valore della massa
del vapore m se si vuole fondere tutto il ghiaccio?
Si dica quale tipo di macchina si deve usare per fondere il ghiaccio facendo liquefare
•
•
–
•
Applic
azione
la massa minima di vapore,
la massa di vapore più grande possibile (mmax).
Si calcoli la variazione di entropia del sistema costituito dalle sorgenti e dalla macchina termica nei
tre casi considerati. Si usino i seguenti valori approssimati: calore latente di fusione del ghiaccio lf =
79,7 cal/g, calore di liquefazione del vapore di acqua le = 539 cal/g.
O
G.M. - Edile-Architettura 2004/05
•
Una mole di gas perfetto monoatomico viene utilizzata come sostanza di lavoro di
una macchina termica che compie il ciclo mostrato in figura. Si calcoli:
• Il lavoro fatto dalla macchina in un ciclo.
• Il calore assorbito per ciclo
• Il rendimento di una macchina di carnot operante tra la più alta e la più bassa temperatura
presenti nel ciclo
•
Applic
azione
Si ponga P1=3P0, V1=2V0, P0=1,01x105 Pa e V0=22,5 litri.
P
•
O
cV ,P
1 1
b
a
V0,P0
d
V
G.M. - Edile-Architettura 2004/05
Dal teorema di Carnot al teorema di Clausius
T1
•
Il teorema di Carnot ci ha detto che il rendimento di una
qualunque macchina termica operante tra due termostati è
minore o al massimo uguale a quello della macchina di
Carnot operante tra gli stessi termostati.
Q
Q
hdef = 1- 2 = 1+ 2
Q1
Q1
Q
T
Q2
T
Þ 1+ 2 £ 1- 2
Þ
£- 2
Q1
T1
Q1
T1
T
hC = 1- 2
T1
Q2
Q
£- 1
T2
T1
•
•
•
Q1 Q2
Þ
+
£0
T1 T2
Questa relazione può essere
generalizzata al caso di una
macchina che scambia calore
con n serbatoi.
Q1
W
X
Q2
T2
T1
Q1
Q2
2
Q
Þ å i £0
i=1 Ti
n
Q3
T3
Qi
åT
i=1
M
T2
Qi
£0
i
Teorema di Clausius
Qn
Ti
Tn
La somma dei calori scambiati in un ciclo dalla macchina M con gli n serbatoi, ciascun calore
diviso per la temperatura del serbatoio con cui viene scambiato, è minore o uguale a zero.
- Edile-Architettura
Strettamente minore se parti del ciclo sono irreversibili. Uguale se ilG.M.
ciclo
è reversibile. 2004/05
Il teorema di Clausius
n
•
•
•
•
Qi è il calore scambiato con il serbatoio i-esimo
Ti è la temperatura del serbatoio i-esimo
La somma è effettata su tutti i serbatoi con cui
viene scambiato calore in un ciclo
Se il numero di serbatoi con cui il sistema
interagisce in un ciclo è infinito:
ò
dQ
£0
T
•
•
å
i=1
Qi
£0
Ti
T1
Q1
M
Q2
Q3
T2
T3
Qi
Strettamente minore = ciclo irreversibile
Uguale = ciclo reversibile
Qn
Ti
Tn
•
•
dQ è il calore infinitesimo scambiato con il serbatoio a temperatura T
T è la temperatura del serbatoio con cui viene scambiato il calore dQ.
– N.B. la temperatura del sistema quando viene scambiato il calore dQ potrebbe non
essere nota
– Solo se la trasformazione è reversibile la temperatura del sistema quando viene
scambiato il calore dQ è proprio uguale alla temperatura T del serbatoio con cui
avviene lo scambio
•
L’integrale è esteso al ciclo
G.M. - Edile-Architettura 2004/05
L’entropia
•
•
•
Consideriamo due trasformazioni reversibili R1 ed R2
che portano il sistema dallo stesso stato iniziale allo
stesso stato finale
L’insieme della prima trasformazione più la seconda
percorsa al contrario costituiscono un ciclo
reversibile.
Applicando Clausius a questo ciclo abbiamo:
ò
dQR
=0
T
C
dQR calore
scambiato
reversibilmente
ò
R2
•
i
dQR
f
T
=-ò
R2
f
i
perchè
il ciclo
è reversibile
dQR
T
Þ
ò
R1
f
i
dQR
T
Da cui si ottiene:
+
ò
R2
P
R1
f
i
i
dQR
f
T
ò
R1
f
i
R2
V
=0
dQR
T
=
ò
R2
f
i
dQR
T
Questa eguaglianza vale per qualunque trasformazione che connette lo stato
iniziale con lo stato finale: l’integrale del calore scambiato reversibilmente
diviso per la temperatura a cui avviene lo scambio, non dipende dalla
G.M. - Edile-Architettura 2004/05
trasformazione ma solo dallo stato iniziale e finale
L’entropia
•
Esiste dunque una funzione di stato che chiameremo entropia, S, tale che
l’integrale del calore scambiato reversibilmente diviso per la temperatura a
cui avviene lo scambio, effettuato su una trasformazione reversibile che
connette lo stato iniziale i e lo stato finale f, è dato dalla differenza dei valori
della funzione S nello stato finale meno quello dello stato iniziale
ò
R
•
•
f
i
dQR
T
= Sf - Si
Sf - Si = DS
Essendo S una funzione di stato, quando un sistema passa dallo stato iniziale i
allo stato finale f, la variazione di entropia è sempre la stessa qualunque sia la
trasformazione utilizzata (reversibile o irreversibile).
Naturalmente per determinare la variazione di entropia devo calcolarla
applicando la definizione: il calcolo della variazione di entropia si può fare
solo su una trasformazione reversibile.
– Se la trasformazione che stiamo studiando è reversibile allora non c’è problema,
basta applicare la definizione alla trasformazione.
– Se invece la trasformazione è irreversibile, occorre innanzitutto sostituire la
trasformazione data con una reversibile che fa passare il sistema dallo stesso stato
iniziale allo stesso stato finale, poi applicare la definizione.
G.M. - Edile-Architettura 2004/05
Calcolo della variazione di entropia in alcune trasformazioni:
serbatoio di calore
•
•
•
•
Durante il trasferimento di calore
il serbatoio non cambia stato
Rimane in uno stato di equilibrio
termodinamico
Il trasferimento di calore avviene
In maniera reversibile
T
Q
DS =
f
dQ R 1 f
Q
=
dQ R =
T
T i
T
Þ
i
Þ
G.M. - Edile-Architettura 2004/05
Calcolo della variazione di entropia in alcune trasformazioni:
Trasformazione reversibile
•
•
Durante il trasferimento di calore
il serbatoio e il sistema hanno la
stessa temperatura
Considerando un tratto infinitesimo
di trasformazione
T
dQ
Sistema
T
dSsist =
dQ
T
dSserb =
-dQ
T
dSUniverso = dSSistema + dSSerbatoio =
dQR dQR
T
-
T
=0
G.M. - Edile-Architettura 2004/05
Calcolo della variazione di entropia in alcune trasformazioni:
generica trasformazione di un gas perfetto
•
•
Consideriamo una generica trasformazione if
Poiché l’entropia è una funzione di stato, per il
calcolo della sua variazione possiamo utilizzare una
qualunque trasformazione come quella mostrata in
figura.
f
dQR
dQR
f
dQR
nCV dT f nRT dV
DS= Þ
=Þ
+Þ
=Þ
+Þ
=
T
T
T
T V
i
i
c T
i
c
c
c
P
c
Pf
Pi
f
i
Tf
Ti
Vi
Vf
V
c
f
V
é ù
é
ù
dT f
dV
T
= ò nCV
+ ò nR
= nCV êlnT ú + nRêlnV ú = nCV ln c + nR ln f =
ë ûi
ë
ûc
T c
V
Ti
Vc
i
c
Tf
Vf
= nCV ln + nR ln
Ti
Vi
Tf
V
+ nR ln f
Ti
Vi
T
P
DS = nCP ln f - nR ln f
Ti
Pi
P
V
DS = nCV ln f + nCp ln f
G.M. - Edile-Architettura
2004/05
Pi
Vi
DS = nCV ln
Calcolo della variazione di entropia in alcune trasformazioni:
cambiamento di fase
•
Durante un cambiamento di fase, la temperatura rimane costante:
DS= Sliq - Ssol =
Þ
liq
sol
dQR
T
=
la temperatura
fusione di fusione è
costante
1
Tfusione
ml fusione
Þsol dQR = T
fusione
liq
G.M. - Edile-Architettura 2004/05
Calcolo della variazione di entropia in alcune trasformazioni:
espansione libera
•
•
•
•
Vuoto
G as
L’espansione libera è una
trasformazione irreversibile
Per calcolo la variazione
fig. A
dell’entropia dobbiamo
• Vi,T
utilizzare trasformazione
reversibile
P
Pi
Per esempio una trasformazione
isoterma
dU = dQ- dW
Sull’isoterma
Pf
Pe
•
i
f
dU = 0 Þ dQ = dW
DSsist =
f
dQR
ÞT
i
DSamb = 0
=
f
dQR
ÞT
i
=
f
Vf
nRT dV
=
nRln
ÞT V
Vi
i
Vf,T
T
Vi
Vf
V
DSuniv = DSsist + DSamb > 0
G.M. - Edile-Architettura 2004/05
Calcolo della variazione di entropia in alcune trasformazioni:
conduzione di calore
•
•
•
•
•
•
Consideriamo due corpi a temperatura diversa T1 e T2.
Se i due corpi interagiscono solo tra di loro il calore
Corpo 2 Corpo 1
ceduto dal corpo 1 sarà assorbito dal corpo 2
T2
T1
La trasformazione è irreversibile
T1>T2
Ma avviene a pressione costante
Il calore trasferito da un corpo all’altro può essere
Q1 = m1c1 (Tm - T1 ) < 0
calcolato come se la trasformazione fosse reversibile
Q2 = m2 c2 (Tm - T2 ) > 0
Diciamo Tm la temperatura di equilibrio
Q2 = -Q1 Þ m2c2 (Tm -T2 ) = -m1c1 (Tm -T1 )
DS2 =
f
dQR
ÞT
=
i
DS1 =
f
dQR
ÞT
i
=
Tm =
m1c1T1 + m2 c2T2
m1c1 + m2 c2
f
m2 c2 dT
Tm
=
m
c
ln
Þ T
2 2
T2
i
f
m1c1dT
T
= m1c1 ln m
T
T1
Þ
i
DS= DS1 + DS2 = m1c1 ln
Tm
T
+ m2 c2 ln m
T1
T2
dQ
T+dT
Corpo 2
T
G.M. - Edile-Architettura 2004/05
Calcolo della variazione di entropia in alcune trasformazioni:
conduzione di calore
•
Se i due corpi sono della stessa sostanza ed hanno la
stessa massa
c =c =c
1
2
m1 = m2 = m
m c T + m2 c2T2 mc(T1 + T2 ) (T1 + T2 )
Tm = 1 1 1
=
=
m1c1 + m2 c2
2mc
2
DS= DS1 + DS2 = m1c1 ln
T
=
T1T2
=
(T1 + T2 )
T2
T1
T1>T2
Tm
T
+ m2 c2 ln m =
T1
T2
dQ
Þ Tm
Tm Þ
Tm2
= mcÞln + ln Þ= mc ln
T2 Þ
T1T2
Þ T1
2
m
Corpo 2 Corpo 1
T+dT
Corpo 2
T
2
4
T1T2
=
T12 + 2T1T2 + T22
4T1T2
T12 - 2T1T2 + T22 + 4T1T2
4T1T2
=
T12 + 2T1T2 + T22 - 4T1T2 + 4T1T2
(T - T )
= 1+ 1 2
4T1T2
4T1T2
=
2
>1
DS= DSuni > 0
G.M. - Edile-Architettura 2004/05
L’aumento dell’entropia nelle trasformazioni
naturali
•
•
•
Vogliamo dimostrare che nelle trasformazioni naturali
(irreversibili), l’entropia dell’universo termodinamico (ossia
del sistema più quella dei serbatoi di calore con cui esso
interagisce) aumenta.
In altri termini: la variazione di entropia dell’universo
termodinamico è sempre maggiore di zero (è uguale a zero
solo per trasformazioni reversibili).
L’insieme della trasformazione irreversibile I e di quella
reversibile II percorsa al contrario costituisce un ciclo
P
II
I
V
ò
– Applichiamo la disuguaglianza di Clausius
dQ
T
£0
dQ f dQ i dQrev f dQ f dQrev f dQ
Þ T = Þ T + Þ T = Þ T - Þ T = Þ T - DSsist Þ 0
i,I
f ,II
i,I
i,II
i,I
DSsist Þ
f
dQ
ÞT
i,I
G.M. - Edile-Architettura 2004/05
L’aumento dell’entropia nelle trasformazioni
naturali
•
Se durante la trasformazione irreversibile il sistema non
scambia calore con l’ambiente (sistema isolato), allora:
f
dQ
ÞT
=0
Þ
DSsist Þ 0 Þ
•
•
•
ÞT
DSuniv = DSsist + DSamb Þ 0
Þ0
DSamb = 0
•
dQ
i,I
i,I
•
DSsist Þ
f
=0
Se durante la trasformazione irreversibile viene scambiato del
calore tra sistema e ambiente esterno
Si ridefinisce un sistema più ampio costituito dal sistema stesso
più tutte le sorgenti con cui il sistema ha interagito
Il sistema più ampio coincide con l’universo termodinamico
Tale sistema è isolato, tutti gli scambi di calore avvengono al
suo interno.
Ripetendo il ragionamento già fatto per questo sistema più
ampio (isolato) otterremo:
DS
Þ0
Sistema
più ampio
T1
Sistema
T2
Tn
sist _ ampio
=DSuniv
G.M. - Edile-Architettura 2004/05
Entropia ed energia inutilizzabile
•
Nei processi naturali l’entropia dell’universo aumenta
– Pendolo che si ferma per gli attriti
•
Contemporaneamente si perde capacità di trasformare l’energia in lavoro
meccanico
– Nel caso del pendolo, il secondo principio della termodinamica ci impedisce di
estrarre l’energia dall’aria e ritrasformarla tutta in energia meccanica.
•
In una trasformazione irreversibile, l’energia diventata inutilizzabile per essere
trasformata in lavoro meccanico è data da:
Ein=DSunivTo
•
•
•
To è la temperatura del serbatoio a più bassa temperatura tra quelli utilizzati
durante la trasformazione.
DSuniv è la variazione di entropia dell’universo
N.B. non si deve pensare che l’energia non si sia conservata, solo che ha perso
la capacità di essere trasformata in energia meccanica
– È come quando si rompe un bicchiere: nessuno dei pezzi del bicchiere viene perso, il
bicchiere perde solo la sua forma e quindi la capacità di contenere dei liquidi.
G.M. - Edile-Architettura 2004/05
•
Una mole di gas perfetto che occupa un volume V1=12.3 litri alla temperatura
T1=300 K subisce una espansione libera che lo porta a raddoppiare il suo volume,
V2=24.6 litri. Il gas viene quindi riportato con una trasformazione reversibile nel
suo stato iniziale.
Applic
azione
– Qual è la variazione di entropia dell’universo sull’intero ciclo?
– Descrivere quale trasformazione reversibile voi usereste per riportare il gas al suo stato
iniziale dopo l’espansione libera.
– Calcolare quanta energia durante il ciclo si è trasformata in energia non più convertibile
in lavoro.
– Verificare che essa è pari a T1DS.
•
O
G.M. - Edile-Architettura 2004/05
•
Un pezzo di 50.0 g di rame alla temperatura di 400 K viene posto in una scatola
isolante insieme a un pezzo di 100 g di piombo alla temperatura di 200 K.
– Qual è la temperatura di equilibrio dei due pezzi di metallo?
– Qual è la variazione di energia interna del sistema costituito dai due pezzi di metallo, tra
lo stato di equilibrio finale e lo stato iniziale?
– Qual è la variazione di entropia del sistema?
– (calori specifici: piombo 129 J/(kg K), rame 387 J/(kg K))
•
Applic
azione
O
G.M. - Edile-Architettura 2004/05
•
Alla pressione atmosferica l’etanolo bolle alla temperatura di 78°C, congela a –
114 °C e possiede un calore latente di evaporazione di 879 kJ/kg, un calore
latente di fusione di 109 kJ/kg e un calore specifico di 2.43 kJ/(kg K).
– Quanto calore deve cedere un campione di massa 0,510 kg, inizialmente in fase
aeriforme alla temperatura di 78°C, per diventare solido alla temperatura di –114 °C?
– Qual è la variazione di entropia subita dal campione in questo processo?
•
Applic
azione
O
G.M. - Edile-Architettura 2004/05
•
In un cilindro, munito di un pistone a tenuta, sono contenuti 20 grammi di idrogeno
(molecola H2, massa molecolare M=2 u) alla pressione atmosferica (1.01x105 Pa). Il gas
viene riscaldato a pressione costante dalla temperatura di 30 °C alla temperatura di 40°C,
tenendolo a contatto con un serbatoio di calore alla temperatura di 50°C.
–
–
–
–
–
Supponendo che durante la trasformazione il gas si comporti come un gas perfetto, determinare:
Il numero di moli.
Il lavoro fatto dal gas.
La variazione di energia interna.
La variazione di entropia del gas e dell’universo.
Applic
azione
Pe=1atm
•
Q
O
50°C
G.M. - Edile-Architettura 2004/05
•
Un litro di gas con g=1.3 inizialmente è in equilibrio termico a 273 K di temperatura e a 1.0
atmosfera di pressione. Esso viene compresso adiabaticamente a metà del suo volume
originario.
–
–
–
•
Trovate la sua pressione e la sua temperatura finali.
Successivamente il gas viene raffreddato lasciando disperdere, a pressione costante, il calore
nell’ambiente esterno e fino a riportarlo alla temperatura dell’ambiente, 273 K, Qual è il suo volume
finale.
Calcolare la variazione di entropia del sistema e dell’ambiente esterno nelle due trasformazioni.
Applic
azione
O
G.M. - Edile-Architettura 2004/05
•
Un impianto a carbone da 1000 MW opera tra 800 e 300 K con un rendimento pari
a due terzi del massimo possibile. Con che ritmo si perde il calore prodotto?
Supponiamo che si usi l’acqua per eliminare il calore in eccesso e, in questo modo
il liquido si riscalda di 8 °C. Quanta acqua deve fluire al secondo attraverso
l’impianto. Di quanto aumenta l’ entropia dell’universo in un secondo?
•
Applic
azione
O
G.M. - Edile-Architettura 2004/05
• Si pone un cubo di ghiaccio di 12.6 g, alla temperatura di 0 °C, in un
lago alla temperatura di 15 °C. Si determini la variazione di entropia
dell'universo quando il ghiaccio si porta all'equilibrio termico con il lago
(si assuma il calore latente di fusione del ghiaccio pari a lf=333 kJ/kg, il
calore specifico dell'acqua pari a c =1 cal/(g K))
•
Applic
azione
O
G.M. - Edile-Architettura 2004/05
• Cinquanta grammi di ossigeno gassoso a 320 K compiono 80 J di lavoro
mentre viene assorbita una quantità di calore di 40 cal.
• )Qual è la variazione di energia interna?
• )La variazione di temperatura?
• )La variazione di entropia considerando la trasformazione isobara?
Applic
azione
• (L'ossigeno è biatomico con peso atomico 16. 1 cal = 4.186 J)
•
O
G.M. - Edile-Architettura 2004/05
•
•
•
Una macchina frigorifera di coefficiente di prestazione 3 mantiene a
temperatura costante T1 =250 K in una cella frigorifera, scaricando il calore
nell'ambiente esterno, a temperatura di 300 K. Il motore della macchina,
posto all'esterno, trasforma in lavoro utile il 90% dell'energia assorbita dalla
rete elettrica. Il rimanente 10% viene dissipato in calore.
L'isolamento delle pareti che separano la cella frigorifera dall'ambiente
esterno è tale che ogni ora essa assorbe una quantità di calore Q1=4,2 x 107 J
che deve essere sottratta per mantenere costante la sua temperatura T1.
Si domanda:
•
•
•
•
•
Applic
azione
) la potenza utile fornita dal motore e quella assorbita dalla rete;
il calore complessivo scaricato all'esterno in un'ora;
) la variazione di entropia, dopo un'ora, della cella frigorifera e dell'ambiente esterno;
) La potenza che il motore assorbirebbe dalla rete, se il frigorifero funzionasse da macchina
di Carnot reversibile, ed il calore scaricato all'esterno in un'ora.
O
G.M. - Edile-Architettura 2004/05