LEZIONE DEL 09/05/2017
. VIA AEROBICA DEL PIRUVATO: CICLO DI KREBS;
. IL CICLO DI CALVIN;
ANTICAMERA (del Paradiso) DEL CICLO DI KREBS
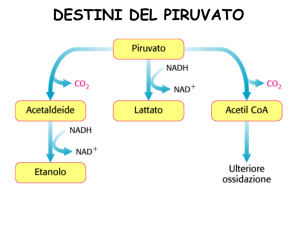
Se non viene usato per fermentazione, il piruvato è
trasportato nel mitocondrio, dove si trova un enzima
con tre unità funzionali (la PIRUVATO DEIDROGENASI)
NAD+, NADP+, FAD dipendenti, che sono dei derivati
vitaminici ossidoriducenti (caricano, scaricano) e le
loro reazioni sono reversibili tranne quando
associate a decarbossilazione.
Le tre subunità ( E1, E2, E3 : deidrogenasi)
costituiscono un complesso enzimatico così grosso da
poter essere visto col microscopio elettronico (gli
elettroni hanno anche massa; per rendere visibile ciò
che si ingrandisce col microscopio si riveste il
tessuto d'oro, così gli elettroni si sparano su
tessuti metallici). Esse non sono monomeriche, ma
dimeri o trimeri ripetuti in decin di copie e
disposte a strati con E2 all'interno (collegati l'uno
all'altro come sfere).
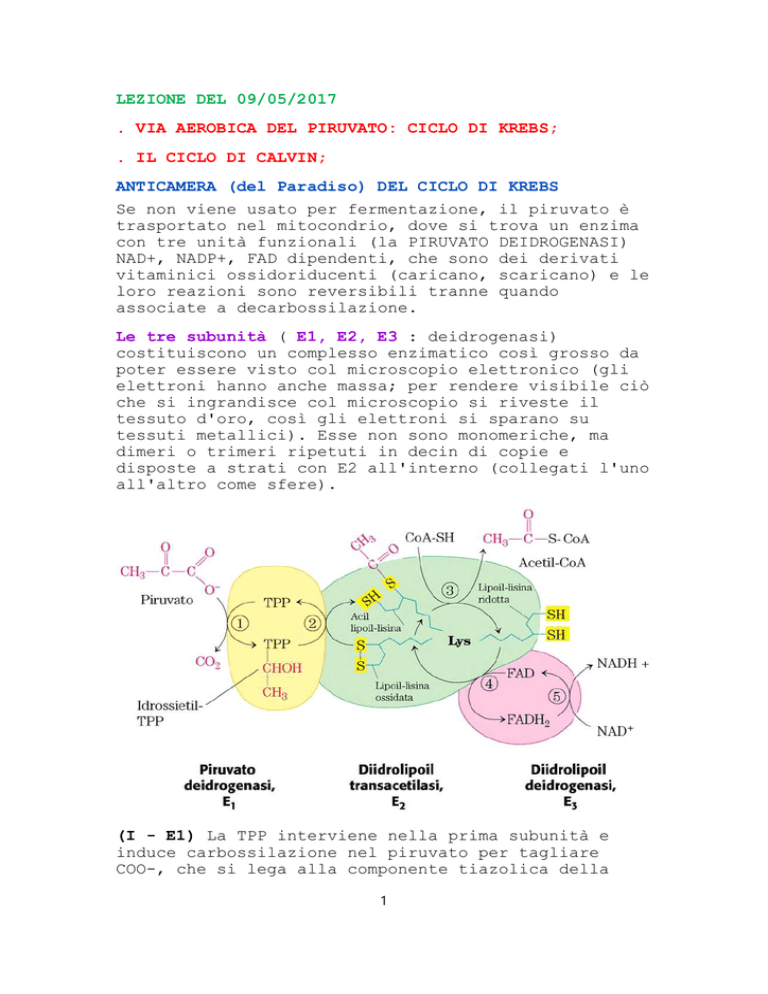
(I - E1) La TPP interviene nella prima subunità e
induce carbossilazione nel piruvato per tagliare
COO-, che si lega alla componente tiazolica della
1
TPP.
A seguito di questo, E1 ruota sotto E2 e CO2 legato
al g. tiazolico viene passato all'acido lipoico, che
reagisce con la lisina, creando un braccio mercanico
(forcello). L'acido lipoico si trova in uno stato
ridotto (per ossidarsi fa un ponte disolfuro come il
glutatione), ospita CH3COO- e se lo aggancia su un
SH; la TPP si sgancia e riceve una nuova molecola di
piruvato.
Nelle reazioni sono stati coinvolti già coinvolti due
cofattori (1) TPP e (2) e lipoato.
Il lipoato si sposta su un'altra unità, sulla
subunità 2 (E2) e poi arriva (3) CoASH , che già
aspettava il lipoato per prendere da esso l'acetato e
fare acetil-CoA. Il lipoato se ne va nel suo stato
ridotto e dev'essere ricaricato; per questo serve il
terzo blocco (E3), che ha altri due cofattori
vitaminici:
(4) FAD, che
lipoato (FAD
per il ciclo
L'acetil-CoA
stacca i due protoni e riossida il
-> FADH2); serve a preparare acetil-CoA
di Krebs e per produrre energia.
aspetta che arrivi il
(5) NAD che provoca un'ossidoriduzione:
(NAD+ -> NADH)
FADH2 -> FAD
Preferisco NADH come navetta mobile, perché solubile;
FAD invece è vincolato, perché sta sempre legato ad
una proteina.
CoAS∼COCH3 è fortemente energetica; il NADH è
fortemente riducente nel mitocondrio (mentre nella
glicolisi il NADH si trovava nel citosol).
Se potessi invertire queste reazioni, dall'acetato
rifarei piruvato e conseguentemente uno zucchero.
L'acetil-CoA, oltre che a provenire dallo zucchero,
lo fa anche dal metabolismo delle proteine e da acidi
grassi. Questa reazione della deidrogenasi è
irreversibile: non può trasformare i grassi in
zuccheri. C'è un solo organismo che può fare questa
reazione al contrario: nel ciclo del GLIOSSILATO,
nelle piante sotto forma di semi (non può accumulare
zuccheri nel seme perché richiede acqua). Le piante
2
riescono a pprodurre piruvato da CoA e a partire da
gliossilato.
Regolazione delle subunità
E2 ed E3 vengono controllate retroattivamente (a
feedback negativo), bloccate ad alte concentrazioni
di acetil-CoA e NADH rispettivamente; E1, invece,
subisce una regolazione per modificazione covalente
tramite la fosforilazione dell'ossidrile della catena
laterale della tirosina.
[ APPROFONDIMENTO: Piruvato Deidrogenasi
Introduzione
Una combinazione di più tecniche, cristallografia ai
raggi X, spettroscopia NMR, e microscopia
elettronica, sta rivelando i segreti dell'enzima
piruvato deidrogenasi. Questo enzima si trova nei
mitocondri, organelli cellulari specializzati nelle
reazioni ossidative, e qui realizza la
decarbossilazione ossidativa, una tappa centrale
della produzione di energia nella cellula, che
collega la glicolisi al ciclo di Krebs. Questa
reazione viene realizzata in tre passaggi distinti da
tre enzimi diversi (E1, E2, E3), tutti e tre sono
legati tra loro in modo funzionale in un grande
complesso multienzimatico, la piruvato deidrogenasi.
3
Anatomia di un complesso multienzimatico
Il complesso ha molte parti mobili che lavorano
insieme per realizzare la reazione globale. E'
costruito attorno ad un nocciolo simmetrico (E2)
mostrato qui in blu. Tutte le catene proteiche che
compongono il nocciolo terminano con una lunga coda
flessibile che si avvolge per realizzare molti altri
domini funzionali. Uno di questi domini lega gli
altri enzimi del complesso, mostrati in verde (E1) e
in giallo-aramcione (E3). Vi sono poi molti altri
piccoli domini che agiscono da trasportatori. Una
amminoacido lisina su questi trasportatori, mostrato
in magenta, è legato ad una speciale molecola,
l'acido lipoico (non mostrato nella struttura).
Questo trasporta le molecole parzialmente reagite da
E1 (verde, dove il piruvato viene decarbossilato) ad
E2 (nocciolo blu, dove il residuo viene ossidato
dall'acido lipoico e trasferito al coenzima A), e
alla fine si porta in E3 (giallo-arancione, dove
l'acido lipoico ridotto viene ossidato ad opera di
FAD e NAD+). Qui il complesso enzimatico è stato
rappresentato in modo semplificato e contiene solo 6
delle 24 code proteiche. Nel complesso vero il
nocciolo centrale è completamente circondato da
catene proteiche.
Scoprire il Complesso
Dato che il complesso è flessibile, si è rivelato
difficile da studiare, infatti solo le proteine che
hanno una forma ben definita si possono vedere con la
tecnica della diffrazione ai raggi X, o con la
spettroscopia NMR. Per questo motivo i chimici
strutturisti hanno scelto la via del "divide et
impera" e hanno diviso il complesso in piccoli
frammenti, questi, avendo una struttura più rigida,
sono stati determinati con facilità. Infine, per
capire come assemblare i vari frammenti, hanno usato
immagini in bassa risoluzione ottenute con il
miscroscopio elettonico. Nell'immagine qui sopra sono
state incluse le strutture di più frammenti: Il
nocciolo centrale E2 (PDB 1eaa), i domini di
trasporto (PDB 1lac), e i due enzimi E1 ed E3 legati
alle code proteiche (PDB 1w85 e 1ebd).
L'Importanza di Assumere vitamine
La reazione di decarbossilazione ossidativa che viene
compiuta dalla piruvato deidrogenasi è complessa, e
quindi utilizza diverse molecole di supporto.
4
L'enzima E1 che realizza il primo passaggio,
decarbossilazione, è mostrato qui a destra (file PDB
1w85), usa tiamina pirofosfato (vitamina B1) per
estrarre anidride carbonica, CO2, dal piruvato. La
molecola di tiamina ha un atomo di carbonio
particolarmente reattivo, mostrato qui con un
asterisco, che compie l'attacco al piruvato. Anche
altre molecole sono indispensabili per realizzare la
reazione complessiva: i piccoli domini trasportatori
usano acido lipoico per legare il piruvato (dopo che
ha perso CO2) e ossidarlo ad acetile e alla fine (in
E2) cedono l'acetile ad un'altra molecola strana, il
coenzima A (che contiene acido pantotenico, vitamina
B5). L'enzima che realizza l'ultimo passaggio (E3)
usa FAD (che contiene riboflavina, vitamina B2) e NAD
(che contiene niacina, vitamina B3 o PP) per
riportare l'acido lipoico nella sua forma iniziale
ridotta. Le nostre cellule non sono in grado di
sintetizzare molte di queste molecole complesse e
quindi le dobbiamo assumere con la dieta, per questo
si chiamano vitamine, ammine della vita.
Esplorando la Struttura
Come accade spesso in biochimica, le cose si rivelano
ancora più complesse quando vengono osservate in
dettaglio. Esistono molte varianti della piruvato
deidrogenasi nei vari tipi di cellule. Alcune cellule
hanno uno o due domini di trasporto sulle code
proteiche invece dei tre mostrati qui. Il complesso
nelle nostre cellule include un'altra proteina nel
nocciolo che possiede dei propri domini di trasporto.
Inoltre lo stesso nocciolo può avere geometrie
5
diverse: un nocciolo a
subunità (mostrato qui
un nocciolo a forma di
subunità (mostrato qui
1b5s).
forma di cubo composto di 24
sotto a sinistra PDB 1eaa) o
dodecaedro composto di 6o
sotto a destra, file PDB
Il nocciolo di sinistra è stato preso da Azobacter,
quello sulla destra da Geobacillus.
Qui sotto sono mostrati i due tipi di nocciolo
lievemente ruotati per apprezzare la loro complessità
tridimensionale. La fine di ogni catena è stata
colorata in ciano, da qui escono le code proteiche
che costituiscono ulteriori domini e che legano gli
altri due enzimi del complesso.
Nel vocciolo di sinistra sono anche state evidenziate
in rosa le molecole di coenzima A legate nei siti
attivi dell'enzima. ]
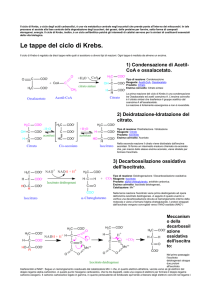
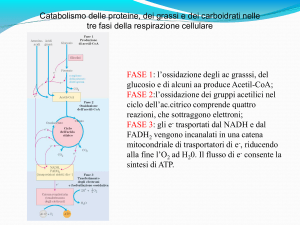
CICLO DI KREBS (oppure DEGLI ACIDI TRICARBOSSILICI, o
dell'ACIDO CITRICO)
Ciclo di Krebs
Il ciclo di Krebs, o ciclo degli acidi carbossilici,
è una via metabolica centrale negli eucarioti che
prende posto all'interno dei mitocondri. In tale
processo si assiste alla fase centrale della
degradazione degli zuccheri, dei grassi, delle
proteine per fornire, sotto forma di composti
eterogenei, energia. Il ciclo di Krebs, inoltre, è un
ciclo anfibolitico poichè gli intermedi di catalisi
servono per la sintesi di costituenti essenziali
della vita biologica.
Le tappe del ciclo di Krebs. (Può essere visto come
un orologio che parte da ore 12; la prima metà delle
reazioni è riducente, l'altra ossidante)
Il ciclo di Krebs è regolato da dieci tappe nelle
quali si assistono a diversi tipi di reazioni. Ogni
tappa è mediata da almeno un enzima.
1) Condensazione di Acetil-CoA e ossalacetato.
6
Tipo di reazione: Condensazione
Reagente: Acetil-coenzima-A, ossalacetato
Prodotto: Citrato
Enzima coinvolto: Citrato sintasi
La prima reazione del ciclo di Krebs è una
condensazione tra Ossalacetato ed acetil coenzima A.
L'enzima coinvolto è il citrato sintasi che
trasferisce il gruppo acetilico dal coenzima A
all'ossalacetato. La reazione è fortemente
esoergonica e non è reversibile.
2) Deidratazione-Idratazione del citrato.
Tipo di reazione: Disidratazione / Idratazione
Reagente: Citrato
Prodotto: Isocitrato
Enzima coinvolto: Aconitasi (moonlight [job] enzyme:
che fa il doppio lavoro; inoltre regola l'omeostasi
del ferro)
Nella seconda reazione il citrato viene disidratato
dall'enzima aconitasi. Si forma un intermedio
insaturo chiamato cis-aconiato che, per mezzo dello
stesso enzima aconiato, viene idratato per formare
l'isocitrato.
3) Decarbossilazione ossidativa dell'isocitrato.
7
Tipo di reazione: Deidrogenazione / Decarbossilazione
ossidativa
Reagente: Isocitrato
Prodotto: alfa-chetoglutarato, anidride carbonica.
Enzima coinvolto: Isocitrato deidrogenasi,
Catalizzatore: Mn++
Nella terza reazione l'isocitrato viene prima
deidrogenato ad opera dell'enzima isocitrato
deidrogenasi. A seguito di questo evento si verifica
una decarbossilazione dovuta al riarrangiamento
interno della molecola e viene a formarsi l'alphachetoglutarato. I protoni strappati dall'isocitrato
vengono convogliati verso il NAD ossidato (NAD+)
Meccanismo della decarbossilazione ossidativa
dell'isocitrato:
Nel primo passaggio l'isocitrato deidrogenasi strappa
due protoni all'isocitrato trasferendoli al NAD+.
Segue un riarrangiamento coadiuvato dal catalizzatore
Mn++ che, in quanto elettron-attrattore, veicola
verso sé gli elettroni del doppio legame alphacarbonilico. A questo punto l'ossigeno carbossilico,
che ha tre doppietti, cede una coppia di elettroni
per formare il doppio legame carbonio-ossigeno. Il
carbonio carbossilico legato in gamma, in quanto
pentavalente ed ibridizzato sp2 tende a liberarsi
degli elettroni coinvolti nel legame i quali si
localizzano tra i carboni alpha e beta. A questo
8
punto si forma un doppio legame tra carbonio alpha e
beta che attrae un protone, fortissimo elettrofilo,
per formare un legame covalente con il carbonio
gamma. La molecola così formata e stabile e prende il
nome di alpha-chetoglutarato.
4) Decarbossilazione ossidativa dell'alphachetoglutarato.
Tipo di reazione: Deidrogenazione / Decarbossilazione
ossidativa
Reagente: Alfa-chetoglutarato, Coenzima A
Prodotto: Succinil-CoA, anidride carbonica, NADH
Enzima coinvolto: Complesso di deidrogenasi
dell'alpha-chetoglutarato
Nella quarta reazione avviene una decarbossilazione
ossidativa preceduta da una deidrogenazione
dell'alpha-chetoglutarato operata dal complesso di
deidrogenasi dell'alpha-chetoglutarato.
Contemporaneamente alla decarbossilazione una
molecola di Coenzima A viene addizionata per formare
Succinil-CoA. L'anidride carbonica viene liberata dal
sistema.
5) Fosforilazione a livello del substrato del
Succinil-CoA.
Tipo di reazione: Fosforilazione a livello del
substrato.
Reagente: Succinil-CoA, Fosfato inorganico, GDP
9
Prodotto: Succinato, Coenzima-A
Enzima coinvolto: Succinil-CoA sintetasi
La quinta reazione avviene al livello del substrato.
L'enzima Succinil-CoA sintetasi toglie dal SuccinilCoA il CoA e coadiuva la formazione di un gruppo
carbossilico. Il Coenzima A viene reso disponibile e
la molecola di GTP è immediatamente disponibile per
la sintesi di ATP a partire da ADP.
Meccanismo di sintesi del succinato:
L'enzima Succinil-CoA sintetasi nel residuo di
Istidina è capace di catturare il fosfato inorganico
e veicolarslo verso il CoA legato al Succinile. A
questo punto avviene una prima sostituzione e si
forma un intermedio fosfosuccinico ad alta energia.
L'enzima stesso catalizza il trasferimento del gruppo
fosforico dal succinilfosfato al GDP formando GTP.
Dopo questa reazione l'enzima è libero e viene
rilasciato, proprio come viene rilasciato il GTP
appena formato assieme al succinato.
6) Deidrogenazione del Succinato (avviene all'interno
della membrana mitocondriale; il FADH2 rimane
attaccato ad una proteina della membrana).
Tipo di reazione: Deidrogenazione reversibile
Reagente: Succinato, FAD
Prodotto: Fumarato, FADH2
Enzima coinvolto: Succinato deidrogenasi
10
Nella sesta reazione il succinato viene ossidato a
fumarato. Interviene l'enzima succinato deidrogenasi
che strappa dal succinato due protoni trasferendoli
al FAD che diventa FADH2. Il fumarato viene, dunque,
sintetizzato.
La reazione è modestamente esoergonica per cui è
reversibile.
7) Idratazione del fumarato.
Tipo di reazione: Idratazione, reversibile
Reagente: Fumarato, acqua
Prodotto: Malato
Enzima coinvolto: Fumarato idratasi
La settima reazione vede la sintesi dell' L-Malato a
partire dal fumarato. L'enzima fumarato idratasi
addizione al doppio legame acqua per formare la
molecola di L-Malato.
La reazione è modestamente esoergonica per cui è
reversibile.
8) Deidrogenazione del L-Malato.
Tipo di reazione: Deidrogenazione, reversibile
Reagente: Malato, NAD+
Prodotto: Ossalacetato
Enzima coinvolto: Malato deidrogenasi
L'ottava tappa vede la deidrogenazione del malato per
11
formare ossalacetato. Gli idrogeni strappati vengono
trasferiti, mediante l'aiuto fornito dall'enzima
malato deidrogenasi, al NAD+ che diventa NADH. A
questo punto l'ossalacetato può ripartire dalla tappa
numero uno con la condensazione del Coenzima A.
La reazione è modestamente esoergonica per cui è
reversibile.
Bilancio energetico globale (2 x [3NADH + 1 GTP +
2CO2 + 1FADH2])
Di per sé il ciclo di Krebs non produce energia
liberamente utilizzabile, se non nella reazione tra
Succinil-Coa e Succinato dove si assiste alla
formazione di GTP facilmente scambiabile in ATP. Il
ciclo, però, fornisce due tipi di cofattori ridotti
capaci di trasportare elettroni ad alta energia
ovvero il NADH ed il FADH2 che possono essere
agilmente utilizzati nella catena respiratoria.
Tenendo conto che per ogni molecola di NADH e FADH2,
possono essere sintetizzate circa 2,5 molecole di ATP
e che una molecola di ATP è facilmente sintetizzabile
da GTP nel ciclo di Krebs vengono formate un numero
di molecole sufficienti per sintetizzare ben 11
molecole di ATP.
CONSIDERAZIONI SUL CICLO DI KREBS
- C'è una teoria secondo cui prima il ciclo di Krebs
era aperto a metà, dividendo le reazioni riducenti
(12 - 6) dalle ossidanti (6-12).
- CoAS-COCH3 ---> 2CO2; complessivamente ho coinvolto
reazioni 4 molecole di ossigeno: 2 provenienti
dall'acqua, 1 dall'acetil-CoA e 1 dal fosfato
inorganico.
- Il ciclo di Krebs a produrre energia (dai riducenti
e sotto forma di ATP e a ossidare ulteriormente il
piruvato (è centrale perché i CO2 ottenuti sono forme
più ossidate rispetto al sistema iniziale).
- Quasi tutti i composti del ciclo di Krebs hanno
altri destini (producono intermedi di altri cicli,
tipo il malato, che sa attraversare la membrana
interna del mitocondrio).
- Ci sono anche intrusi nel ciclo di Krebs, tipo il
glutammato, che, togliendogli +NH3, introduco a ore 3
12
nel ciclo di Krebs.
- Il ciclo ha uno scopo di riciclo e donazione:
reazioni anaplerotiche (di rifornimento) ossalacetato riprocessato con carbossil piruvato
biotina dipendente.
- Un ciclo di Krebs mi dà ZERO molecole in più di
ossalacetato; se invece il ciclo inizia a metà, da
alfa-chetoglutarato per mezzo di amminoacidi
glucogenici guadagno una molecola di ossalacetato
(una specie di "OSSALNEOGENESI").
- REGOLAZIONE NELLE REAZIONI IRREVERSIBILI; blocco a
feedback per concentrazioni eccessive di acetil-CoA,
NADH e ATP;
- Avvelenamento (blocco in anticamera del ciclo): se
all'acido lipoico si attacca l'arsenico (AsO)
deprotonando i due zolfi, legandosi quindi ad
entrambi.
CICLO DI CALVIN
Nelle piante c'è il gliossisoma, un organello che
prende 2 molecole di acetil-CoA e ne manda una nel
ciclo di Krebs, mentre all'altra gli fa fare quasi un
ciclo di Krebs.
13