AVVERTENZA
Il presente materiale didattico viene fornito allo scopo di facilitare la
comprensione degli argomenti trattati e costituire il raccordo tra lezioni e
studio individuale
NON E’ PERTANO DA INTENDERSI COME SOSTITUTIVO DEL LIBRO DI TESTO
Inoltre, nonostante la massima scrupolosità nella preparazione, è pur sempre
possibile che siano presenti inaccuratezze e imprecisioni. E’ quindi necessario
il costante controllo con i testi di riferimento
Si invita a non diffondere, fotocopiare o utilizzare tale materiale per scopi
diversi dalla preparazione individuale dell’esame
Dr Monica MONTAGNANI – CdL Medicina e Chirurgia
Esame Farmacologia – V Anno/II Semestre - Canale LZ
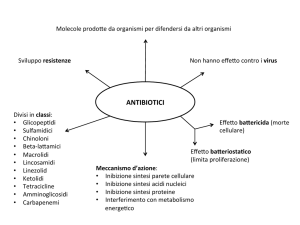
CLASSIFICAZIONE DEGLI ANTIBIOTICI ANTIINFETTIVI
Secondo il MECCANISMO D’AZIONE
INIBIZIONE DELLA SINTESI
DELLA PARETE BATTERICA
INIBIZIONE DELLA FUNZIONE DELLA
MEMBRANA CELLULARE
INIBIZIONE DELLA SINTESI PROTEICA
INIBIZIONE DELLA SINTESI DI DNA / RNA
INIBIZIONE DEL METABOLISMO
INIBITORI DELLA SINTESI PROTEICA
La maggior parte di
questi
antibiotici
interagisce con i
ribosomi
batterici,
diversi dai ribosomi
eucariotici, ed hanno
azione
specifica
contro i batteri.
Ribosomi
Coefficiente di
sedimentazione
Subunità
n°
proteine
specie di
RNA
batterici
70S
30S + 50S ~ 50
23, 16, 5 S
eucariotici
80S
40S + 60S ~ 80
28, 18, 5.8,
5S
INIBITORI DELLA SINTESI PROTEICA
Cloramfenicolo: si lega
alla subunità 50S e
inibisce la formazione del
legame peptidico
catena polipeptidica in
accrescimento
Subunità
50S
Eritromicina: si lega alla
subunità 50S e previene la
traslocazione sul ribosoma
tRNA
mRNA
Streptomicina: modifica la
struttura della subunità 30S e
causa delle distorsioni nella catena
del messaggero che non può
essere letto correttamente
Subunità
30S
Tetracicline: interferiscono con l'attacco del
tRNA al complesso:
mRNA-ribosoma.
direzione dello scorrimento del
mRNA sul ribosoma
INIBIZIONE DELLA SINTESI PROTEICA
RIBOSOMA 30S
INIBIZIONE DEL COMPLESSO DI INIZIAZIONE ED ERRATA
LETTURA DEL mRNA (Aminoglicosidi: Gentamicina, etc).
INIBIZIONE DEL LEGAME DELL' AMINOACIL-tRNA AL
RIBOSOMA (Tetracicline: Tetraciclina ).
RIBOSOMA 50S
INIBIZIONE DELLA PEPTIDILTRANSFERASI E INIBIZIONE
DELLA FORMAZIONE DI PEPTIDI (Cloramfenicolo )
(Streptogramine)
INIBIZIONE DELLA TRASLOCAZIONE E LIBERAZIONE
DELL' OLIGOPEPTIDIL-tRNA (Macrolidi: Eritromicina;
Lincosamidi: Lincomicina) (Streptogramine)
AMINOGLICOSIDI
Streptomicina
Kanamicina
Amikacina
Neomicina
Gentamicina
Tobramicina
Netilmicina
AMINOGLICOSIDI
•Gli aminoglicosidi consistono di due o più aminozuccheri uniti da un
legame glicosidico a un nucleo esoso che generalmente è in posizione
centrale.
•Sono antibiotici ad ampio spettro attivi nei confronti di batteri sia Grampositivi che Gram-negativi.
•Sono generalmente molto polari e non passano facilmente gli involucri
esterni dei batteri. Però sinergizzano con i -lattamici e quando la parete è
danneggiata viene facilitato l’assorbimento dell’aminoglicoside.
STRUTTURA E CARATTERISTICHE CHIMICHE
Sono delle basi deboli solubili in acqua.
Sono policationi a pH corporeo e passano in quantità ridotte la
membrana cellulare.
Provengono da:
Micromonospora actinomyctes
Gentamicina (gentamicin and netilmicin)
Streptomyces griseus
Streptomicina (streptomicina e diidrostreptomicina)
Kanamicina (kanamycina, amikacina, e tobramicina)
Neomicina (neomicina)
Apramicina (farmaco veterinario)
MECCANISMO DI AZIONE
Gli aminoglicosidi
inibiscono la sintesi
proteica legandosi
alla porzione 16S
rRNA del ribosoma
batterico
interferendo con il
legame
della
FORMILMETHIONYL-tRNA
nelle subunità 30S.
Questo impedisce
l’inizio della sintesi
proteica portando a
morte le cellule
batteriche.
IPOTESI SULL’AZIONE BATTERICIDA
DEGLI AMINOGLICOSIDI
AMINOGLICOSIDI – Meccanismo d’azione
Ingresso attraverso le porine
-----------------------------------------------------------Spazio periplasmico
-----------------------------------------------------------Trasporto attraverso la membrana interna
(energia dipendente fase I)
Legame alla subunità 30S
(Interferenza con la sintesi proteica)
*Blocco dell’iniziazione della sintesi proteica
*Errata lettura del RNAm
*Prematura terminazione della traslazione RNAm
Sintesi di Proteine anomale
Le Proteine anomale possono essere inserite nella
membrana cellulare, inducendo alterata permeabilità
e ulteriore stimolazione del trasporto dell’aminoglicoside
(energia dipendente fase II)
Distruzione della membrana cellulare
Morte cellulare
AMINOGLICOSIDI – Spettro antibatterico
AEROBI
GRAM +
Staphilococcus aureus
Corynebacterium, Listeria monocytogenes
GRAM Haemophilus influenzae Escherichia coli,
Salmonella sp, Shigella sp Klebsiella
pneumoniae, Enterobacter, Serratia
marcescens Proteus mirabilis, Proteus sp,
Providencia sp Pseudomonas aeruginosa,
Acinetobacter, Alcaligenes
MICOBATTERI
M. tubercolosis hominis, M. tubercolosis bovis
(Streptomicina, Kanamicina, Amicacina)
Poiché la loro penetrazione dipende da un trasporto attivo
ossigeno-dipendente, gli aminoglicosidi hanno un’azione
minima sui microrganismi anaerobi
AMINOGLICOSIDI – Farmacocinetica
Somministrazione
Intramuscolo Endovena
Assorbimento
Non assorbimento gastroenterico
Distribuzione
Legame proteico : 5 - 30%
Volume di distribuzione : 14 - 20 L
Diffusione tissutale scarsa, limitata ai liquidi
extracellulari Scarso il passaggio nel LCR, nella
prostata, nell'umore acqueo
Attraversano la
barriera placentare Emivita plasmatica : 2 ore
Metabolismo
Non biotrasformazione metabolica
Eliminazione
Renale: (Filtrazione Glomerulare)
Clearance renale : 80 - 120 ml/min
Gli aminoglicosidi sono dializzabili
AMINOGLICOSIDI – Indicazioni terapeutiche
Endocarditi da streptococco ed enterococco
(in associazione con Penicillina G o Ampicillina)
Infezioni da Pseudomonas o da Acinetobacter
(in associazione con una Betalattamina antipseudomonas)
Sepsi ed endocarditi da stafilococco
(in associazione con una Cefalosporina di Ia generazione)
(in associazione con Vancomicina + Rifampicina)
Trattamento iniziale di tipo empirico degli
stati febbrili in pazienti neutropenici
(con una Betalattamina a spettro molto ampio)
Sepsi di origine urinaria da enterobatteri o
pseudomonas
(con una Betalattamina ad ampio spettro)
Infezioni polmonari nosocomiali da bacilli
aerobi Gram-negativi
(con una Betalattamina ad ampio spettro)
AMINOGLICOSIDI – Indicazioni terapeutiche
Meningiti batteriche da Gram negativi ,
Listeria o stafilococco
(per via intrarachidea o ventricolare)
Osteomieliti da bacilli Gram negativi
(con una Betalattamina ad ampio spettro
o con un Fluorochinolone)
Infezioni da flora mista in chirurgia
addominale e pelvica
(in associazione con Antibiotico antianaerobi)
Trattamento iniziale di tutte le infezioni gravi
(con Betalattamina ad ampio spettro)
Riduzione dell'ammoniogenesi nella grave
insufficienza epatica
(Neomicina in associazione con Lattulosio)
Amebiasi, giardiasi ,criptosporidosi
intestinale
(Paramomicina)
AMINOGLICOSIDI – Tossicità
Blocco neuromuscolare
Depressione respiratoria, Apnea, Aggravamento di miastenia g.
(Inibizione della liberazione di acetilcolina a livello presinaptico)
Nefrotossicità
Accumulo degli aminoglicosidi nell'orletto a spazzola delle cellule
tubulari
Accumulo nei mitocondri e nei lisosomi
Inibizione delle fosfolipasi e delle sfingomielinasi lisosomiali
Eliminazione di enzimi lisosomiali
(Lesioni degenerative)
Ototossicità
*Vestibolare (Vertigini, Atassia)
(Streptomicina, Dibekacina)
*Cocleare (Acufeni,
Sensazione di occlusione dell'orecchio, Ipoacusia)
(Kanamicina, Amikacina)
Sindrome di malassorbimento
Atrofia dei villi, Steatorrea)
(Neomicina, Paramomicina)
Reazioni allergiche
AMINOGLICOSIDI – Tossicità
AMINOGLICOSIDI – Ototossicità
Fig. 1. Proposed mechanism of aminoglycoside (AG)
toxicity at the level of the hair cell in the cochlea and
utricle of the inner ear.
After the AG enters the hair cell through mechano-electrical
transducer channels, it forms a complex with a transition
metal, in this case iron (Fe). These redox active complexes
generate ROS/RNS including the superoxide anion radical,
hydrogen peroxide, hydroxyl radical, peroxynitrite anion,
etc. These reactants activate JNK (c-Jun N-terminal kinase)
which then translocate (straus locates) to the nucleus to
activate genes in the cell death pathway; these products are
then transferred to the mitochondria (mito) where they
promote the release of cytochrome c (Cyt c). In the cytosol,
Cyt c triggers the activation of a series of caspases followed
by apoptosis (programmed cell death) via what is referred
to as caspase-dependent cell death. In addition to this
caspase-dependent apoptotic pathway, AG may also kill
cells via caspase-independent mechanisms
Fattori di rischio per la Tossicità
AMINOGLICOSIDI
Pazienti con funzionalità renale instabile
Pazienti con Ipotensione
arteriosa/Ipovolemia
Pazienti con sintomi di ototossicità
Pazienti con precedenti esposizioni o con
contemporanea esposizione a farmaci
ototossici o nefrotossici
Pazienti sottoposti a terapia con alte dosi
Pazienti con eccessive concentrazioni
seriche di aminoglicoside
Pazienti sottoposti a terapia di lunga
durata con aminoglicoside
Pazienti geriatrici
Dose cumulativa di aminoglicoside
Dose totale giornaliera di aminoglicoside
Fattori che possono influenzare le
concentrazioni seriche di aminoglicoside:
Obesità, Disidratazione, Febbre, Ustioni gravi
MECCANISMI DI RESISTENZA
1) Produzione di enzimi che inattivano gli
aminoglicosidi
per
adenililazione,
acetilazione e fosforilazione
2) Incapacità ad entrare nella cellula batterica
3) Target proteico alterato
RESISTENZA BATTERICA AGLI AMINOGLICOSIDI
STREPTOMICINA
IL PRIMO ANTITUBERCOLARE CLINICAMENTE EFFICACE
(1947 1952)
SPETTRO ANTIBATTERICO
Mycobacterium tubercolosis
(Mic = 10 g/ml)
Mycobacterium Kansasii
Altri Micobatteri atipici
Frequente resistenza.
FARMACOCINETICA
Somministrazione
Assorbimento
intramuscolare
non assorbito per os
Distribuzione
Cmax = 30 g/ml (dose 1 g im)
Legame proteico: 30%.
Diffonde scarsamente e
non passa nel Liquido cerebro spinale
Emivita plasmatica . 2,5 ore.
Eliminazione
Renale (Fg). Clearance renale = 70ml/min.
For Waksman the discovery of streptomycin in 1944 and
its effect on the tubercle bacillus accomplished with the
collaboration of A. Schatz and confirmation by E. Bugie
was a rich and satisfying fulfillment of many of his
personal and altruistic aims. Ever practical, he
established effective and congenial relations with Merck
and Company, which developed liquid culture methods
for production of bulk quantities of the microbial
products during World War II. Patenting and licensing the
promising ones, notably streptomycin, provided funds,
80 percent of which was assigned to Rutgers University
to support research and eventually an associated
Institute of Microbiology. He also soon arranged to have
animal tests and clinical trials carried out at the Mayo
Clinic to expedite the possible use in treating
tuberculosis. Of the 20 percent of license funds accruing
in his own name, one-half was later consigned to a
foundation for research support.
The first clinical trial with a randomized intake in the history of medicine was
started in 1946 by the British Medical Research Council. Because only a limited
amount of SM was available in the United Kingdom, patients with advanced
pulmonary disease could ethically be randomized to treatment with bed rest alone
or bed rest plus 2 g SM daily. The results (Table 1) showed a substantial immediate
advantage to the SM arm, but most patients developed Sm/resistant strains, and
the results of a 5-year follow-up indicated that they had little eventual benefit
compared with the control arm.
STREPTOMICINA
TOSSICITA’
Neurotossicità VIII n.c.
Reazioni allergiche
Blocco neuromuscolare
Intolleranza locale
(meningite chimica)
NETILMICINA
Nettacin,
Zetamicin
Antibiotico Aminoglicoside semisintetico
derivato dalla Sisomicina. Battericida
E’ attivo su ceppi aminoglicosidi-resistenti che
posseggono l’enzima aminoglicoside-adenilante
ANT (2) e anche su molti ceppi che posseggono
enzimi acetilanti AAC(3)-I e AAC(3)-III
SPETTRO ANTIBATTERICO
AEROBI
GRAM +
Staphylococcus aureus, Staphylococcus
epidermidis Corynebacterium, Listeria monocytogenes
GRAM Neisseria meningitidis, Neisseria gonoreae
Haemophilus influenzae Escherichia coli, Salmonella
sp, Shigella sp Klebsiella pneumoniae, Enterobacter,
Serratia marcescens Proteus mirabilis, Proteus sp,
Providencia sp Pseudomonas aeruginosa,
Acinetobacter, Alcaligenes
ANAEROBI
Resistenti
AMFENICOLI
Cloramfenicolo
Tiamfenicolo
CLORAMFENICOLO
Il cloramfenicolo è un antibiotico a largo spettro d’azione
che è usato largamente in applicazioni topiche in
oftalmologia e dermatologia.
CLORAMFENICOLO
(Chloromycetin Chemicetina)
Antibiotico batteriostatico-battericida
Streptomyces Venezuelae – Sintetico
MECCANISMO D’AZIONE
Si lega alla subunità ribosomiale 50S
e inibisce l’enzima Peptidil-transferasi
Inibizione della sintesi proteica
RESISTENZA
Resistenza plasmidica
Degradazione enzimatica
Acetilasi Acetilazione
(Salmonella typhi, Klebsiella, Enterobacter, Serratia)
(Neisseria meningitidis, Haemophilus influenzae)
(Staphylococcus aureus, Streptococcus pyogenes , Streptococcus faecalis)
(Bacteroides fragilis)
Diminuita permeabilità cellulare
Insensibilità ribosomiale
CLORAMFENICOLO
Cloramfenicolo -
Spettro antibatterico
(Chloromycetin Chemicetina)
AEROBI
Gram +
Streptococcus pyogenes, Streptococcus pneumoniae
Staphilococcus aureus, Staphilococcus epidermidis
Corynebacterium difteriae, Bacillus antracis
Actinomyse israeli
GramNeisseria meningitidis, Neisseria gonorrhoeae
Haemophilus influenzae
Brucella, Legionella pneumophila, Bordetella pertussis
E. coli, Salmonella, Shigella
Klebsiella, Enterobacter, Serratia marcescens
Proteus mirabilis
ANAEROBI
Gram +
Peptococcus, Peptostreptococcus
Clostridium perfrigens
GramFusobacterium fusiforme , Bacteroides, Campylobacter
fetus
ALTRI
Leptospira, Treponema pallidum
Chlamidiae; Mycoplasma, Rickettsie
Cloramfenicolo -
Farmacocinetica
Preparati farmaceutici: 250 mg /cps; Sospensione 2,5%
1g / fl (CAF-succinato)
Somministrazione Orale: 50 mg/kg/die (in 4 somm)
Endovenosa:
Intramuscolo:
Topica
Assorbimento
Biodisponibilità orale: 90-100%
Distribuzione
Legame proteico: 50-80%
Volume distribuzione. 0,5 - 1 L /kg
Ampia distribuzione
Passa nel Liquor Cerebro Spinale
Passa la barriera placentare
Passa nel latte
Emivita plasmatica: 1,6 - 3,3 ore
Metabolismo
Epatico-: 90%. (Glicuroniltransferasi)
Glicuronazione
CAF- monoglicuronide
Eliminazione
Renale: metaboliti (glicuronidi)
immodificata: 5 - 15 %
Biliare Fecale: 2-4%
Cloramfenicolo -
INDICAZIONI
Gravi infezioni del sistema nervoso centrale
Meningite da Haemophilus influenzae
Oftalmiti batteriche e da Chlamidiae
(Uso topico)
Infezioni da Salmonelle
Tifo
Infezioni da anaerobi
Rickettsiosi
Brucellosi
Cloramfenicolo -
Tossicità
Tossicità gastrointestinale
Nausea , Vomito, Diarrea
Stomatite (Candidosi)
Tossicità ematologica
Anemia, Leucopenia, Trombocitopenia
Anemia emolitica
(in deficit di Glucosio 6 fosfato deidroigenasi)
Agranulocitosi, Anemia aplastica
Reazione tipo Jarisch- Herxheimer
Distrurbi da immaturità metabolica
(Deficit di glicuroniltransferasi)
“Grey Baby Syndrome”
“Sindrome grigia neonatale”
Collasso cardio respiratorio
Disturbi neurologici
Cefalea, Confusione, Neuropatia periferica
Allergia
Orticaria, Rash cutaneo
TETRACICLINE
Clortetraciclina
Ossitetraciclina
Tetraciclina
Demeclociclina
Metaciclina
Doxiciclina
Minociclina
TETRACICLINE
DOXICICLINA
(Vibramicin, Bassado)
(Doxycycline hyclate : gel 10% Atridox)
cps Periostat
Tetraciclina di 3a generazione
MECCANISMO D’AZIONE
Inibizione della sintesi proteica
La doxiciclina si lega alla subunità 30 S e inibisce il
legame dell’aminoacil-t RNA
Inibisce la collagenasi che contribuisce alla patogenesi
della distruzione periodontale
AEROBI
DOXICICLINA – Spettro antibatterico
Gram+
Streptococcus
pyogenes
(R
44%),
Streptococcus
pneumoniae,
Streptococcus
faecalis
(R
74%),
Streptococcus faecium Streptococchi alfa emolitici (gruppo
viridans) Bacillus anthracis
Gram Neisseria gonorrhoeae, Acinetobacter species
Haemophilus influenzae, Haemophilus ducreyi
E. coli (R) , Shigella, Klebsiella (R), Enterobacter (R),
Vibrio cholera Francisella tularensis (Pasteurella
tularensis) Yersinia pestis (Pasteurella pestis)
ANAEROBI
Gram+
Clostridium
israeli
Propionbacterium
acnes,
Actinomyces
GramFusobacterium fusiforme, Bacteroides sp
ALTRI
Mycoplasma pneumoniae, Ureaplasma urealyticum
Treponema pallidum, Borrelia recurrentis
Chlamydia trachomatis, Chlamydia psittaci, Rickettsiae
Plasmodim falciparum, Entamoeba species
DOXICICLINA – Farmacocinetica
Preparati farmaceutici
100 mg /cps, 20 mg/cps
Gel 10%
Somministrazione Orale: 100 mg x 2 /die (primo giorno)
100 mg x 1 /die
Endovenosa
Topica: gel 10%
Assorbimento
Biodisponibilità orale: buona
Distribuzione
Legame proteico: 80 – 93 %
Volume distribuzione: 0,75 L/kg
Ampia la distribuzione:
polmonare, bronchiale, urogenitale,
ossea
Passa nel Liquor Cerebro Spinale
Passa nel latte
Emivita plasmatica: 15 - 24 ore
Metabolismo
Epatico: 50%
Eliminazione
Renale: 35 – 45%
Biliare: scarsa
DOXICICLINA – Indicazioni
Infezioni dell’apparato respiratorio
Polmonite atipica
(Micoplasma, Clamidie, Rickettsiae)
Infezioni dell’apparato urogenitale
Prostatiti, Uretriti
Trattamento e profilassi dell’antrace
Terapia dell’acne volgare
Periodontite
(Trattamento topico e sistemico a bassa dose)
DOXICICLINA – Tossicità
Nausea
Candidosi orale o vulvovaginale
Fotosensibilizzazione
Epatotossicità
Nefrotossicità
Ritardo di crescita e di sviluppo
per fissazione a livello osseo
Discromie dentali
MACROLIDI
Famiglia di antibiotici, estrattivi e semisintetici, caratterizzati da
Anello lattone a 14 - 16 elementi, a cui sono legati degli
aminozuccheri e zuccheri.
MECCANISMO D’AZIONE
Esplicano la loro azione a pH alcalino
Inibizione della sintesi proteica per legame delle sostanze a livello
ribosomiale 50S, ed inibizione della traslocazione e peptidiltranferasi
MACROLIDI
A 14 atomi di carbonio
Eritromicina
Oleandomicina
Roxitromicina
Claritromicina
Fluritromicina
A 15 atomi di carbonio
Azitromicina
A 16 atomi di carbonio
Spiramicina
Iosamicina
Miocamicina
Rokitamicina
MACROLIDI
FARMACOCINETICA
Assorbimento gastroenterico
Alte concentrazioni tissutali e nei liquidi
Penetrazione nei macrofagi e nei polimorfonucleati
Metabolismo a livello epatico ed eliminazione biliare
Scarsa eliminazione renale
TOSSICITÀ
Gastrointestinale – Epatica reversibile
Interazioni con altri farmaci
(Teofillina, Carbamazepina)
ERITROMICINA
Instabile a pH gastrico. Formulata come estolato. Metabolizzata ed eliminata per via biliare
INDICAZIONI
Infezioni streptococciche - Infezioni stafilococciche - Profilassi malattia reumatica
(IIa scelta) - Infezioni da Mycoplasma P. - Polmonite da Legionella P - Difterite Pertosse - Tetano - Sifilide - Acne - Amebiasi
TOSSICITA’
Disturbi gastrointestinali Epigastralgie, Nausea, Vomito
Epatotossicità Aumento transaminasi, ittero, febbre, leucocitosi (Estolato)
Reazioni allergiche - Interferenze farmacologiche (Inibitore enzimatico)
A 14 atomi di carbonio
CLARITROMICINA
(Clacid)
Stabile in ambiente gastrico. L'attività della Claritromicina è potenziata in vivo
dalla sua favorevole distribuzione (alta concentrazione nei tessuti e organi e
penetrazione intracellulare), che le conferisce un vantaggio nel trattamento di
microorganismi che proliferano nelle cellule come Legionella, Clamydia e
Toxoplasma.
La sua biotrasformazione epatica avviene attraverso meccanismi enzimatici che
possono andare incontro a saturazione. Dosi elevate aumentano l’emivita
FARMACO DI PRIMA SCELTA NELLA ERADICAZIONE DI H.Pylori
RESISTENZA
Modificazioni ribosomiali riducenti l’affinità di legame
A 15 atomi di carbonio
AZITROMICINA
(Zitromax)
L’azitromicina è un macrolide con attività di poco inferiore rispetto
all’eritromicina sui batteri Gram positivi, ma ha un’efficacia maggiore su
alcuni Gram negativi compreso H. influenzae.
A somiglianza della claritromicina, è stabile in ambiente gastrico. Le
concentrazioni plasmatiche sono molto basse, ma quelle tessutali sono
molto più alte.
Ha una lunga emivita tessutale (70
monosomministrazione giornaliera
ore)
ed è consigliata
la
A 16 atomi di carbonio
Spiramicina
Antibiotico naturale. Biodisponibilità 30% dopo somministrazione orale.
Eliminata nel latte, nel sudore e nella saliva. Scarsa penetrazione BFP.
IMPIEGO ELETTIVO NELLA TOXOPLASMOSI IN GRAVIDANZA
Iosamicina
Miocamicina Rokitamicina
Stesse indicazioni della eritromicina
KETOLIDI
Meccanismo correlato a quello dei macrolidi.
Legano anche i ribosomi mutati (cocchi resistenti)
TELITROMICINA
INDICAZIONI
La telitromicina possiede una spiccata attività nei confronti dei
patogeni respiratori, in particolare, lo streptococco
pneumoniae e lo streptococco pyogenes.
Usata nel trattamento di infezioni dell’apparato respiratorio
quali polmoniti di comunità, esacerbazione delle bronchiti
croniche, sinusiti acute, tonsilliti e faringiti.
EFFETTI INDESIDERATI E CONTROINDICAZIONI
Diarrea, nausea, vomito, flatulenza, dolore addominale, alterazioni del gusto, vertigini e
cefalea, stomatite, vampate, palpitazioni, sonnolenza, insonnia, nervosismo, rash, orticaria,
prurito, offuscamento della vista ed eosinofilia.
Raramente sono stati osservati ittero colestatico, parestesie, aritmie, ipotensione, colite da
antibiotico.
Controindicata durante l’allattamento, in soggetti con QT lungo e in concomitante terapia
anti-aritmica.
LINCOSAMIDI
Inibizione della sintesi proteica per legame alla subunità 50S
del ribosoma batterico
LINCOMICINA
(Lincocin, Cillimicina)
Streptomyces linconensis
CLINDAMICINA
(Dalacin C fosfato ; Dalacin C )
Antibiotico semisintetico derivato della Lincomicina
LINCOMICINA
(Lincocin, Cillimicina)
SPETTRO ANTIBATTERICO
AEROBI
GRAM +
Staphylococcus aureus MS
Staphylococcus epidermidis MS
Streptococcus pneumoniae
Streptococcus pyogenes
Streptococcus viridans
Corynebacterium diphtheriae, Coryn acnes
Nocardia
B. anthracis
GRAM Resistenti
ANAEROBI
GRAM +
Peptococcus
Peptostreptococcus
Propionbacterium
Eubacterium
Actinomyces israelii
Clostridium perfringens, Clostridium tetani
GRAM Bacteroides fragilis
Fusobacterium
Viellonella
LINCOMICINA
(Lincocin, Cillimicina)
INDICAZIONI
Trattamento delle infezioni da Batteri
Aerobi Gram positivi
e
Anaerobi Gram positivi e negativi
In Odontoiatria come sostituto della
penicillina
Buona penetrazione nel tessuto osseo
TOSSICITA’
Tossicità gastrointestinale
Diarrea
Colite pseudomembranosa
(Clostridium difficile)
Diarrea, Feci muco-sanguinolente, Dolori
addominali
Febbre, Leucocitosi, Disidratazione, Tachicardia
(Vancomicina: 125 mg x 4/die o Metronidazolo 250 mg x 4/die)
Aritmie cardiache (alte dosi)
Effetti dermatologici
Rash, Orticaria, Fotosensibilizzazione
Interazioni farmacologiche (Bloccanti neuromuscolari)
STREPTOGRAMINE
MISCELE NATURALI
Pristinamicina: prodotta da Streptomyces pristinaespiralis e
costituita da varie molecole in proporzioni irregolari.
Virginiamicina: prodotta da Streptomyces virginiae e lievemente
differente dalla Pristinamicina.
DERIVATI SEMISINTETICI
Quinupristin (RP 57669):
(derivato dalla Pristinamicina IA naturale).
Dalfopristin
(RP 54476):
(derivato dalla Pristinamicina IIB naturale).
Synercid
(RP 59500) :
(una miscela in rapporto 30/70 di Quinapristin e Dalfopristin).
STREPTOGRAMINE
MECCANISMO D’AZIONE
Le Streptogramine di gruppo A e di gruppo B si
legano ai ribosomi batterici e inibiscono la
translazione del RNA messagero (RNAm) alla tappa
della elongazione.
Le Streptogramine di gruppo A inattivano i siti donatore e
accettore della peptidiltrasferasi , interferendo con la funzione di
questo enzima.
Esse bloccano 2 tappe della elongazione della catena peptidica:
1) l’aminoacil-trasfertRNA (tRNA) al sito A dei ribosomi
2) la formazione del legame peptidico con il peptidil-tRNA al sito P.
Le Streptogramine di gruppo B interferiscono con il corretto
posizionamento del peptidil-tRNA al sito P.
Esse inibiscono la formazione del legame peptidico, risultandone la
liberazione di catene peptidiche incomplete.
Questi processi sono template-dipendenti (selettivamente
influenzano l’RNAm per la codifica di aminoacidi basici e prolina).
(Synercid) (RP 59500)
QUINUPRISTIN - DALFOPRISTIN
QUINUPRISTIN
DALFOPRISTIN
RP 57669
RP 54476
Derivato semisintetico
della Pristinamicina IA
Derivato semisintetico
della Pristinamicina IIB
Streptogramin di
gruppo B
Streptogramin di
gruppo A
Esadepsipeptide ciclico
p.m. 800
idrosolubile
Macrolattone
poliinsaturo
p.m. 500
idrosolubile
30 parti
70 parti
Inibizione della sintesi
proteica
Inibizione della sintesi
proteica
Legame con la sub
unità ribosomiale 50S
Legame con la sub
unità ribosomiale 50S
Formazione di complesso ternario
quinapristin-ribosoma-dalfopristin
Inibiscono la traslazione del mRNA alla
tappa della elongazione
Interferisce con il
corretto
posizionamento del
peptidil-tRNA al sito P.
Inibizione dei siti
donatore e accettore
della peptidil-tranferasi
Inibizione della
formazione del legame
peptidico con
liberazione di catene
peptidiche incomplete
Blocco dell’aminoaciltRNA al sito A e della
formazione del legame
peptidico con
peptidil-tRNA al sito P
BATTERICIDA
sinergismo di potenziamento
DALFOPRISTIN
RP 57669
30 parti
RP 54476
70 parti
Somministrazione
7,5 mg/kg x 2 o 3 volte al dì endovena
(Synercid) (RP 59500)
QUINUPRISTIN - DALFOPRISTIN
QUINUPRISTIN
Assorbimento
Distribuzione
Cinetica lineare
Ampia distribuzione nei tessuti ad eccezione
del SNC e dei tessuti fetali
Clearance plasmatica
1 L/h/kg
0,8 L/h/kg
Emivita plasmatica
0,6 - 1 h
0,3 - 0,4 h
Metabolismo
2 metaboliti attivi
1 metabolita attivo
Eliminazione
biliare 75%
biliare 77%
QUINUPRISTIN - DALFOPRISTIN
(Synercid)
(RP 59500)
INDICAZIONI
Infezioni da stafilococco meticillino-resistente
Infezioni da pneumococco penicillinoresistente
Infezioni da enterococco vancomicina
resistente
TOSSICITA’
Irritazione venosa locale
Cefalea
Nausea , vomito, diarrea
aumento delle transaminasi
STREPTOGRAMINE
RESISTENZA
RESISTENZA INTRINSECA
Caratteristiche della membrana batterica.
I Bacilli Gram-negativi (Enterobatteriacae) sono resistenti perchè
hanno una membrana esterna che limita l’entrata di molecole
idrofobiche e relativamente grosse ( peso molecolare > 500).
Questo tipo di resistenza interessa tutti gli antibatterici MLS (=
Macrolidi, Lincosamidi, Streptogramine)
RESISTENZA ACQUISITA
Modificazione del target
Alterazione (metilazione) RNA ribosomiale 23 S. I batteri risultano
resistenti a tutti i Macrolidi, Lincosamidi e Streptogramine di gruppo
B (MLSB fenotipo della resistenza)
Inattivazione del farmaco
Produzione di Streptogramina A acetilasi (genotipo lsa oppure
saa) (Stafilococchi)
Produzione di Streptogramina B idrolasi (genotipo sbh oppure
vgb) (Stafilococchi)
Attivo efflusso del farmaco
In Staphylococcus epidermidis è stata descritta una resistenza MLS
interessante i Macrolidi con anello a 14 elementi e le
Streptogramine di gruppo B.