Alcoli, Fenoli, Tioli, Eteri
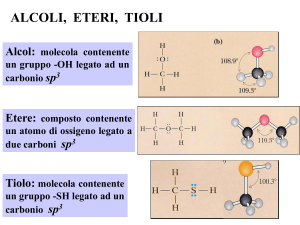
Alcoli:
Struttura Nomenclatura
Proprietà Usi
Preparazione
Classificazione
Reazioni
Eteri
Fenoli
Tioli
Alcoli
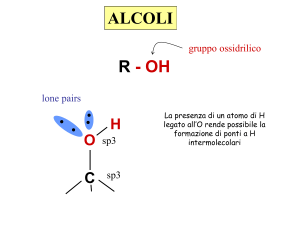
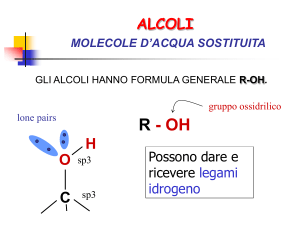
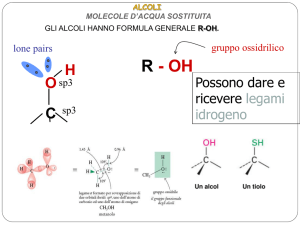
ALCOLI
gruppo ossidrilico
R - OH
lone pairs
H
O
C
sp3
sp3
La presenza di un atomo di H
legato all’O rende possibile la
formazione di ponti a H
intermolecolari
Alcoli
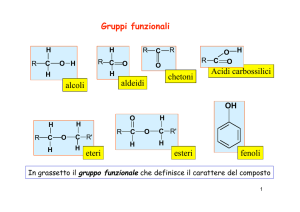
gruppo funzionale - OH ( ossidrile)
nome : idrocarburo con desinenza - olo
CH3OH metanolo
CH3CH2OH etanolo
Proprietà degli alcoli
• Teb > di quelle degli alcani corrispondenti
(molecole polari - legame idrogeno)
H
H
l
l
H-C-H
H-C-H
l
l
O-H----- O-H-----
Proprietà degli alcoli
• Teb > di quelle degli alcani corrispondenti
• Solubilità completa in solventi polari
fino a C4
• Comportamento anfotero
Alcoli
Formula
solubilità in
peb (°C)
H2O %
metanolo
CH3OH
64,5
etanolo
CH3CH2OH
78,3
n-propanolo CH3(CH2)2OH
97
n-butanolo
CH3(CH2)2OH
118
7,9
n-pentanolo CH3(CH2)3OH
138
2,3
n-esanolo
156
0,6
CH3(CH2)4OH
Usi
Metanolo
CH3OH
Il 90% del metanolo, come primo passaggio, viene ossidato ad
aldeide formica la quale successivamente subisce trasformazione ad
acido formico. Il restante 10% del metanolo viene eliminato invariato
per via renale (tempo di emivita: 22 ore circa).
Lo step da metanolo a formaldeide può avvenire in due modi:
1. nei perossisomi (sono un altro tipo di organelli specializzati per
l’utilizzo dell’ossigeno, e si trovano nelle cellule eucariotiche e sono il sito
di produzione maanche della degradazione del perossido di idrogeno
(H2O2) vari enzimi ossidoreduttasi partendo da diversi substrati RH2
portano alla formazione di H2O2 (acqua ossigenata o perossido
d'idrogeno) che poi, tramite l'enzima catalasi, ossida il metanolo
2. nel citosol epatico tramite l'enzima ADH (questa ossidazione è in
equilibrio reversibile)
La dose tossica di metanolo varia in relazione a vari fattori (età, sesso,
presenza di etanolo...), negli adulti la tossicità è proporzionale al tasso
ematico.
La dose letale è compresa tra 50 - 250 ml, 4 – 10 ml possono causare
cecità permanente.
Il metanolo come tale causa ebbrezza, in seguito ad intossicazione acuta,
poi vertigini, nausea, vomito, dolori addominali, cefalea e depressione del
SNC, ma ben più pericolosi sono i sintomi e i danni causati dai suoi due
metaboliti, aldeide formica e acido formico.
Essi causano gravi sintomi quali grave acidosi metabolica, atassia*,
vertigine, dilatazione delle pupille (che divengono poco reattive),
congiuntivite, gonfiore del disco ottico, danni al nervo ottico, al SNC e al
fegato.
Acidosi metabolica: nei primati la conversione metanolo => acido formico
è più rapida dell'eliminazione del acido formico, cosicché nelle 24 ore
seguenti l'assunzione di metanolo si ha un graduale accumulo di acido
formico, che causa una diminuzione del pH plasmatico fino a 6.8
(l'acidosi viene analizzata in laboratorio non dosando l'acido formico ma
misurando la diminuzione di concentrazione di vari anioni plasmatici.
•
Terapia Lavanda gastrica (se la si può fare entro due ore dall'assunzione) e/o
somministrazione di NaHCO3 per contrastare l'acidosi e somministrazione di
etanolo* (se il tasso ematico del metanolo e 3,50 mg/dl e se non si manifestano
disturbi della visione) per sottrarre al metanolo l'enzima ADH (si riduce così la
formazione dei metaboliti tossici del metanolo). La concentrazione di etanolo
prevede una prima dose di attacco di 700 mg/dl e poi deve mantenersi pari a
100 mg/dl per tutto il tempo necessario a far scendere la concentrazione di
metanolo sotto i 25 mg/dl.
•
Nei casi in cui la concentrazione di metanolo sia prossima o superiore a 100
mg/dl, o nel caso si manifestino disturbi della visione, allora si ricorrerà a
dialisi peritoneale o ad emodialisi, valide per allontanare non solo il metanolo
ma anche i suoi metaboliti.
•
Inoltre, per limitare i danni sul SNC, si può bloccare l'ossidazione del metanolo
a formiato somministrando 2-metil-pirazolo (o simili) endovena; si tratta di
sostanze efficaci ma epatotossiche; necessitano di somministrazione
immediata dopo l'avvelenamento.
Etanolo - Alcol Etilico
H H
l l
H-O -C-C-H
l l
H H
Potere antisettico perché? A quale concentrazione?
Usi In
medicina
Come
antisettico
(denatura le
proteine)
Usato come antisettico solo al 70%
Etanolo - Alcol Etilico
preparazione : fermentazione degli
zuccheri
C6H12O6
glucosio
2 C2H5OH + 2 CO2
etanolo
contenuto di etanolo:
birra circa 4 %
vini
circa 12%
gin, whisky, brandy dal 40 al 50 %
Alcoli polifunzionali, (polioli) - Glicoli
OH OH
l l
H-C-C-H
l l
H H
1,2 - etandiolo
(glicole etilenico)
Uso : anticongelante
OH OH OH
l l l
H-C-C-C-H
l l l
H H H
1,2,3 propantriolo
(glicerolo , glicerina)
nitroglicerina
Il glicerolo o glicerina è importante perché costituente dei grassi (utilizzato
nella preparazione dei cosmetici e supposte Trattato con acido nitrico
forma la nitroglicerina (potente esplosivo, ma anche utilizzato in medicina
come stimolatore cardiaco perché vasodilatatore)
L’alcol aromatico più semplice ed utilizzato è il fenolo (idrossibenzene)
impiegato specialmente nella produzione di materiali polimerici (adesivi e
materiali plastici).in medicina utilizzato come disinfettante degli strumenti
chirurgici, pavimenti,biancheria e bagni Utilizzato come standard di
riferimento per l’attività germicida Una soluzione germicida all’1% uccide i
batteri come una soluzione di fenolo al 5% si dice che ha COEFFICIENTE di
5
primario
H3C—CH2 —OH
etanolo
secondario
terziario
OH
|
H3C—CH —CH3
OH
|
H3C—C —CH3
|
CH3
2-propanolo
ter-butanolo
2-metil-2-propanolo
Caratteristiche deducibili
dalla struttura
L’immagine mostra il potenziale elettrostatico del
metanolo. Più rossa è un area, maggiore è la
densità elettronica; più blu è un area, minore è la
densità elettronica.
•L’atomo di ossigeno mostra una regione ad
alta densità elettronica (rosso) dovuta alla
presenza di due doppietti elettronici solitari.
dO
H
d+
•Quindi gli alcoli possono comportarsi sia
come basi che come nucleofili.
•L’atomo di idrogeno della funzione alcolica
mostra una bassa densità elettronica (blu),
quindi ha debole carattere acido.
•Quindi gli alcoli sono acidi debolissimi
(pKa ~ 16).
•La dissociazione di un protone genera un
alcossido.
•Il gruppo –OH è un cattivo gruppo uscente e
deve essere convertito in un buon gruppo
uscente perché si possa avere una reazione di
sostituzione o di eliminazione.
Gli alcoli sono acidi molto deboli.
In assenza di gruppi elettron-attrattori (che ne
aumentano l’acidità) e di gruppi elettron-repulsori
(che ne diminuiscono l’acidità) i valori di Ka sono
intorno a 1·10-15.
H
C H
H
O H
H
H
O
H
pKa 15.5
C H
H
O
H
H O
H
Preparazione o sintesi degli alcoli
Dagli alcheni (Idratazione favorita in ambiente acido ) (addizione elettrofila)
Dagli algenuri alchilici per Sostituzione nucleofila
REAZIONI DEGLI ALCOLI
Tipiche degli alcoli sono: disidratazione e ossidazione
Poi ci sono altre reazioni ma che sono caratteristiche di altri gruppi
funzionalii
Disidratazione
Reazioni alcoli
Ossidazione degli alcoli
Gli alcoli (o meglio il carbonio che lega il gruppo OH) possono venir ossidati
R
C OH
H2
alcol I° da un’aldeide
O
R
C
H
R
H
C
OH
alcol II° da un chetone
R
C
C
R
R
R
R
OH
Alcol III° non da niente
O
L’ossidazione è una deidrogenazione che diventa
Reazioni di ossido-riduzione (Nel nostro organismo ci sono le deidrogenasi)
carbonile
(aldeide o chetone)
alcol
carbossile
-H2
Numero di ossidazione del C crescente
N.B.
alcol 1° aldeide carbossile
alcol 2° chetone X
alcol 3° X
La variazione di colore dello ione dicromato nella reazione di ossidazione degli
alcoli (e delle aldeidi) viene sfruttata nell’esame estemporaneo del tasso di
etanolo nell’alito (test del palloncino)
OH
H C H
Ione dicromato
(rosso-arancio)
Cr2O7-- (H+)
O
C
H
H C H
Cr+++
H C H
H
Ione cromo
(verde)
H
etanolo
Alcol
etilico
Aldeide
acetica
etanale
Le ossidazioni con Cr6+ sono caratterizzate da cambiamento di colore da arancio-rosso a
verde, Cr3+.
•Si sfrutta questo cambiamento di colore per verificare il contenuto alcolico del sangue:
l’ossidazione di etanolo con K2Cr2O7 arancio forma CH3COOH and Cr3+ verde.
• Si soffia in un tubo contenente K2Cr2O7, H2SO4, e un
solido inerte. Maggiore è la concentrazione di etanolo nel respiro,
maggiore è l’estensione della fascia verde nel tubo. Il Cromo è cancerogeno
il test non si dovrebbe più usare ora si sfruttano altri indicatori
2-propanolo
• Nel corpo l’etanolo viene ossidato nel fegato, attraverso la
catalisi dell’alcool deidrogenasi, ad acetaldeide CH3CHO
e poi ad acetato CH3COO−.
• Se l’etanolo è in eccesso si ha un aumento di acetaldeide
che è tossica.
• Se si ingerisce metanolo, esso viene metabolizzato a
formaldeide e acido formico che sono estremamente
tossici: il pH del sangue diminuisce, segue cecità e morte.
L’etanolo viene eliminato per il 10% con respiro, sudore, urina
90 % Metabolizzato nel fegato
in piccola parte nella mucosa gastrica: M>F, cala con l’età,
NAD+
NADH + H+
CH2OH
I
- alcol deidrogenasi
CH3
citosolica
H-C=O
I
CH3
- MEOS microsomiale
NAD+
acetalaldeide deidrogenasi
NADH + H+
HO-C=O
I
CH3
C=O~SCoA
I
acetil CoA sintasi CH3
Metabolismo dell’etanolo
sintesi dell’acetaldeide
due diverse vie metaboliche in base al consumo
1. Consumo moderato
ALCOL DEIDROGENASI (enzima costitutivo)
ADH Enzima citosolico Zn2+ dipendente; Km = 1mM
Può ossidare anche il metanolo
CH3CH2OH + NAD+
CH3CHO + NADH + H+
2. Consumo elevato
SISTEMA MICROSOMIALE CHE OSSIDA L’ETANOLO
(MEOS microsomal ethanol oxidizing system) sistema inducibile
CH3CH2OH + NADPH + H+ + O2
CYP2E1
CH3CHO + NADP+ + H2O
Reazioni alcoli
Una disidratazione
Disidratazioni biologiche
• Su composti b-idrossicarbonilici (gruppi OH in b a C=O),
meccanismo E1
-H2O
Come nella sintesi degli acidi grassi
Gli alcoli possono inoltre dare altri due tipi di reazioni
R-O-H
R-O-H
Rottura del legame C-O
L’ossigeno è molto elettronegativo ed il legame è polarizzato come
negli alogenuri alchilici: SOSTITUZIONI NUCLEOFILE
Rottura del legame O-H
L’ossigeno può usare i suoi elettroni per comportarsi da
nucleofilo,(cioè RO- è un nucleofilo) riprendendo poi gli elettroni
del legame O-H
Sostituzione nucleofila negli alcoli
Negli alcoli il gruppo uscente OH- è una base forte quindi
la sostituzione nucleofila è difficile
si può forzare sull’equilibrio chimico (non facile)
usando un catalizzatore
CH3-CH2-OH + H+
CH3-CH2-OH2+
In questo caso il gruppo uscente è una base molto debole ( H2O) e la reazione è facile
CH3-CH2-OH + CH3-CH2-OH + H+
CH3-CH2-O-CH2-CH3 + H2O + H+
etere
Alcuni gruppi funzionali attivi come
nucleofili all’interno delle cellule
nucleofilo
Quanto più debole è un
nucleofilo tanto meglio
si comporterà come
gruppo uscente
Forza del nucleofilo
gruppo
uscente
Per condensazione in
ambiente acido
(ad es. H2SO4)
di due molecole di
etanolo
si ottiene un etere
H OHH
CH3
C
H OHH
2
H2O
C
C
H OHH
2
H+
1a fase: Protonazione dell’alcol
2a fase: Sostituzione
nucleofila
C
CH3
H OHH
(La reazione decorre con
meccanismo SN2)
CH3
CH3
CH3
CH3
C
H OHH
H
C
H
CH3
H+
C
H OH
H
C
H
CH3
dietiletere
(o etere etilico)
Eteri
ETERI
gruppo etere
R–O–R
Il legeame etere lo
troviamo nei carboidrati
lone pairs
C
sp3 O
C
sp3
sp3
Gli eteri sono molecole si comportano
da solventi polari aprotici (mancano
atomi di idrogeno disponibili a formare
ponti ad H)
Eteri
Il gruppo funzionale è R-O-R
Il nome dell’etere deriva da quello dei due radicali alchilici:
CH3-O-CH2-CH3
metil etil etere
CH3 CH2 O CH3 CH3
Dietiletere (etere etilico o comune etere)
Gli eteri sono pochissimo reattivi:
in presenza di acidi forti e acqua
Danno una reazione di idrolisi formando due alcoli
Gli EPOSSIDI sono ETERI ciclici a tre termini di cui uno è
l’ossigeno
2 HC
CH2
O
Gli eteri devono essere considerati delle basi : in ambien
te acquoso acido sono facilmente protonati ed idrolizzati
H
H
R
C
H+
RH
C
H
protonazione
H O
C H
H
R
O
C H
H
R
H
H
R
C
H
H
R
C
H O
C H
H
R
O
H2O
H
H
+
H O
C H
H
R
H+
RH
C
H
O
H
idrolisi
EPOSSIDI (ETERI)
O
gruppo epossido
R — R
lone pairs
sp3
O
Csp3
C
sp3
Forte tensione di legame
Alta reattività
Reazione tipica degli epossidi:
Sostituzione nucleofila
Meccanismo di reazione in ambiente acido
Nu-H = H2O, R-OH, R-NH2
Gli alcoli possono poi comportarsi da reattivi nucleofili e reagire con
Aldeidi
Il C dell’aldeide è
parzialmente positivo
R
d O H
C
O
R'
H
l’ossigeno ha elettroni spaiati
H
O
R
C
R'
OH
R
H
O
R'
semiacetale
OH
R
O
H
C
O
R'
H
O
Acidi carbossilici
R
O
C
R'
OH
+ H2O
R
OH
O
O
R
H
C O
OH
R'
R
O
H
C
O
O
H
R'
R'
estere
Fenoli
Fenoli - alcoli aromatici
Debolmente acidi Ka circa 10-10
C6H5OH
fenolo
Uso: materia prima per la sintesi di
materiali plastici e come disinfettante
L’anione fenato è stabilizzato
dalla risonanza fra più forme
limite. Ciò comporta la
conseguenza che i fenoli
sono acidi più forti degli alcoli.
O
H
H
O H
O
H
H O
pKa 10.0
O
O
H
H
H
C
H
H
H
O
O
Na
H
H
C
H
H
O
O
H
Na
Gli alcoli non reagiscono con gli idrossidi dei metalli
alcalini (l’equilibrio è completamente spostato a sinistra),
mentre i fenoli si convertono quantitativamente in fenati
H
H
O
Na
O
H
O
O
H
Na
2 CH3OH
2 Na
2
2 Na
2 CH3O Na
2
H2
H2
O
O
H
Na
Sia gli alcoli che i fenoli reagiscono con i metalli
alcalini (molto più reattivi)dando,
rispettivamente alcolati e fenati.
Nota però che queste reazioni non sono reazioni
acido-base ma reazioni redox.
Tioli
TIOLI
gruppo sulfidrilico
R - SH
lone pairs
H
S
C
sp3
sp3
Tioalcoli o Tioli
o
mercaptani
Formula generale R-SH
Nome:
uguale a quello dell’alcol corrispondente con il suffisso -tiolo
alcano con il prefisso mercapto
Sono presenti in natura ed hanno un odore sgradevole
Quando si taglia la cipolla viene rilasciato il propantiolo, l’aglio deve il suo odore ai tioli
Al gas naturale essendo inodore viene aggiunto un tiolo per identificarlo in caso di fughe
CH3-CH2-OH
CH3-CH2-SH
etanolo
etantiolo
mercapto etano
Reazioni
I tioalcoli danno le stesse reazioni degli alcoli, formando i
corrispondenti tioderivati
Come H2S è più acido di H2O,
i tioalcoli sono acidi deboli
gli alcoli sono acidi debolissimi
Reazione dei soli tioalcoli: ossidazione del gruppo tiolo
lo zolfo di SH può essere ossidato, l’ossigeno di OH non può
R-SH + R-SH + 1/2 O2
ossidazione blanda
R-SH +
3/
2
O2
ossidazione spinta
R-S-S-R + H2O
disolfuro
Gli acidi
R-SO3H
solfonici sono
acido solfonico acidi forti
Reazione redox
Tioli liberi
Ossidazione
- 2H
Riduzione
+ 2H
Ponte disolfuro
Nei capelli esposti a acqua calda (vapore) le α-cheratine cambiano
strutture, diventano una forma β estesa.
Con un composto riducente è possibile aprire i ponti disolfuro, piegare
i capelli, e riossidare le cisteine creando ponti disolfuro in posizioni
nuovi.
I legami covalenti mantengono la piega dei capelli in modo
permanente.
Proteina insulina in cui sono evidenziati
i ponti disolfuro che si formano fra
gruppi R dell'aminoacido cisteina