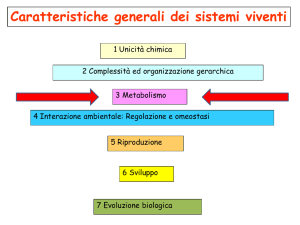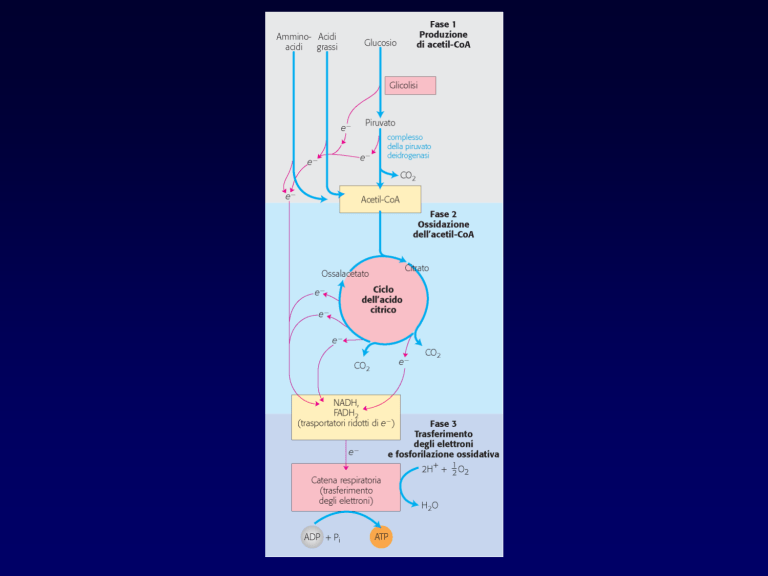
•1
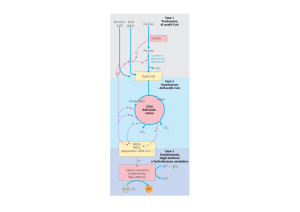
Le macromolecole vengono
scisse nelle loro unità costitutive
•2
Le unità costitutive vengono
degradate ad un prodotto
comune: il gruppo acetilico dell’
acetilCoA
Glicolisi
AcetilCoA
prodotto
catabolico
comune
•3
Le vie cataboliche
convergono attraverso il Ciclo
dll’acido citrico nei 3 principali
prodotti finali: acqua, anidride
carbonica e ammoniaca (urea
negli animali terrestri)
Prodotti finali del catabolismo
Ciclo di Krebs
In condizioni
aerobiche il piruvato
viene ossidato ad
acetil-CoA e CO2 dal
complesso
enzimatico piruvato
deidrogenasi
A) Decarbossilazione ossidativa del Piruvato ad Acetil ~ CoA
Avviene nella matrice mitocondriale, costiutisce un punto d’unione tra la glicolisi
e il ciclo di Krebs
-
O
O
1C
2C
O
COMPLESSO
PIRUVICO
CH3
O + HS CoA + NAD+
C
DEIDROGENASI
3 CH3
Piruvato
~S
CoA
+ NADH
+ CO2
Acetil-CoA
Il C1 si ossida da carbossilico a CO2
Il C2 si ossida da chetonico a carbossilico
Il complesso multienzimatico piruvico deidrogenasi è formato da tre enzimi che
lavorano in succesione e richiedono la presenza di 3 vitamine: Ac.Pantotenico –
Tiamina (vitamina )B1 – Acido Lipoico.
E’ regolato dalla carica energetica:
• E’ inibito da: [ATP]
• E’ attivata da: [ADP] o/e [ AMP],
[Piruvato]
COMPLESSO DELLA PIRUVATO DEIDROGENASI
D. L. Nelson, M. M. Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER 4/E, Zanichelli Editore S.p.A. Copyright © 2006
Tiamina (vitamina B1): la tiamina è il precursore della tiamina pirofosfato, coenzima di
enzimi che intervengono nel ciclo di Krebs (decarbossilasi). Data la sua importanza,
deficit di vitamina B1 non sono frequenti. Il beriberi (alterazioni del sistema nervoso
accompagnate anche da problemi cardiovascolari e gastrointestinali) si manifesta nelle
popolazioni orientali che si cibano di riso o nei casi di alcolismo gravi, in quanto
l'assunzione di alcool fa diminuire l'assorbimento dei questa vitamina (sindrome di
Wernicke-Korsakoff).
Tiamina
1) Condensazione dell’ Acetil-CoA con l’Ossalacetato
-
COO
H2O
CH2
HO
-
COO
C
CITRATO
SINTASI
+ HS - CoA
CH2
-
COO
Acetil ~ CoA
Ossalacetato
Citrato
• Reazione irreversibile (DG0’ = -32,2 kJ/mol), punto di controllo principale del ciclo
inibita da:
[ATP]
• La citrato sintasi è un enzima allosterico
attivata da:
[ADP] o/e [ AMP],
[Acetil~CoA],
[Succinil~CoA]
2) Isomerizzazione del Citrato ad Isocitrato
H
C
H2O
-
COO
C H
-
COO
Citrato
COO
COO
CH2
HO
-
-
-
COO
CH2
C
ACONITASI
CH2
H2O
-
COO
ACONITASI
CH
-
-
H
C
COO
H
C OH
-
COO
COO
Cis-Aconitato
Isocitrato
3) Ossidazione e Decarbossilazione dell’Isocitrato ad
a-Chetoglutarato
-
COO
CH2
H
H
C
NAD
+
NADH
-
COO
CH2
CH2
HC
COO
C OH
-
COO
-
ISOCITRATO
DEIDROGENASI
-
COO
C O
H
C H
+
+
H + CO2
C O
-
-
COO
COO
Isocitrato
-
COO
Ossalsuccinato
a- Chetogluatarato
• Reazione reversibile
inibita da:
[ATP],
[NADH]
• La isocitrato deidrogenasi è un enzima allosterico
attivata da:
[ADP] o/e [ AMP]
4) Ossidazione e decarbossilazione dell’a-Chetoglutarato
a Succinil~CoA
-
-
COO
COO
CH2
CH2
CH2 + NAD
+
a- CHETOGLUTARATO
+ HS - CoA
CO2
~
-
+ NADH +
C O
C O
COO
DEIDROGENASI
CH2
a- Chetogluatarato
S CoA
Succinil ~ CoA
• Reazione irreversibile (DG0’ = -33,5 kJ/mol), punto di controllo, controllata
dal complesso multienzimatico
a-chetoglutarato deidrogenasi. Richiede la presenza di 3 vitamine:
Ac. Pantotenico – B1 – Ac. Lipoico come coenzima oltre al NAD+ e al CoA-SH
5) Trasformazione del Succinil~CoA a Succinato
-
-
COO
COO
CH2
CH2
SUCCINIL – CoA
SINTETATASI
+
Pi + GDP
GTP
+ CoA -SH
COO
~
GTP + ADP
+
CH2
-
C O
S CoA
CH2
Succinil ~ CoA
GDP + ATP
Succinato
Fosforilazione a livello del substrato
6) Ossidazione del Succinato a Fumarato
-
-
COO
COO
SUCCINATO
DEIDROGENASI
H C H
+ E FAD
H C H
-
COO
Succinato
C H
+ E FADH2
H C
-
COO
Fumarato
7) Idratazione del Fumarato a Malato
-
COO
C H
FUMARSI
+ HO H
HO
C H
H C H
H C
-
COO
Fumarato
-
COO
H2O
-
COO
Malato
8) Ossidazione del Malato a Ossalacetato
-
-
COO
HO
COO
C H
+ NAD
CH2
+
MALATO
DEIDROGENASI
C
O
CH2
-
-
COO
COO
Malato
Ossalacetato
+
+ NADH + H
1 giro del ciclo di Krebs
3 NADH
DG0’ = - 40 kJ/mol
1 FADH2
1 GTP
(ATP)
2 CO2
L’energia
rilasciata
dalle 4
reazioni di
ossidazione
viene
conservata
nei
coenzimi
ridotti
Si producono anche intermedi metabolici
precursori di vie biosintetiche
Energia (ATP) dal Piruvato
2 piruvato
1 NADH
2 piruvato
2 acetil CoA + 2 CO2 + 2 NADH
(fosforilazione ossidativa)3 ATP
2 acetil CoA + 2 CO2 + 6 ATP
Energia (ATP) dal ciclo dell’acido citrico
Un giro del ciclo dell’acido citrico (1 acetilCoA)
3 NADH x 3 ATP =
9 ATP
1 FADH2 x 2 ATP =
2 ATP
1 GTP
x 1 ATP =
1 ATP
Totale
=
12 ATP
1 molecola di glucosio fornisce 2 molecole di
acetil CoA, quindi
2 acetil CoA
24 ATP + 4 CO2
Gli elettroni provenienti dalle ossidazioni cataboliche
sono incanalati verso gli accettori di elettroni
(NAD+, NADP+, FAD)
La fosforilazione ossidativa consiste nella riduzione
dell’O2 a H2O attraverso il trasferimento degli elettroni dai
coenzimi ridotti (NADH e FADH2)
Il trasporto degli elettroni è accoppiato alla sintesi di ATP
Per ogni coppia di elettroni che riduce l’O2 si producono 3
molecole di ATP
NADH + 4H+ + 1/2 O2 + 3 ADP + Pi
NAD+ + H2O + 3 ATP
La fosforilazione e l’ossidazione non sono
direttamente accoppiate
NADH + 4H+ + 1/2 O2
ADP + Pi
NAD+ + H2O
DG = -220 kj/mol
ATP
DG = + 31 kj/mol
MITOCONDRI
Possibile
origine
simbiontica?
Contengono
DNA circolare
per la sintesi di
alcune proteine
mitocondriali
Ribosomi 70S
DNA
Creste
Matrice
Ribosomi
Membrana
interna
Membrana
esterna
Possono
muoversi e
dividersi
Si riproducono
per scissione
da un
mitocondrio
preesistente
Membrana esterna
permeabile a ioni e piccole
molecole
La fosforilazione ossidativa ha
luogo nei mitocondri
Membrana
interna
Impermeabile alla
maggior parte delle
piccole molecole e
ioni (H+)
La catena respiratoria
mitocondriale è costituita da
una serie di trasportatori di
elettroni
Matrice
La maggior parte dei
trasportatori di elettroni sono
delle proteine integrali di
membrana organizzate in
complessi sopramolecolari
inseriti nella membrana interna
mitocondriale
Gli elettroni fluiscono dai trasportatori a potenziale minore
verso quelli a potenziale maggiore
Le proteine
trasportatori di
elettroni contengono
dei gruppi prostetici
in grado di accettare
e donare 1 o 2
elettroni
L’ubichinone o
coenzima Q (Q) è un
composto piccolo e
idrofobico che può
muoversi all’interno
del doppio strato
lipidico e trasferire
gli elettroni a
trasportatori meno
mobili
Gli elettroni possono essere trasferiti dai trasportatori
secondo 3 modalità
Trsferimento diretto di elettroni
Fe 2+ + Cu 2+
Fe3+ + Cu+
Trasferimento di un atomo di idrogeno
H+ + eTrasferimento di uno ione idruro (:H-) che porta 2 elettroni
• Il complesso I accetta gli elettroni dall’NADH
• Il complesso II (succinato deidrogenasi) è l’unico enzima del ciclo di
Krebs legato alla membrana mitocondriale interna
• I complessi I e II cedono elettroni al Coenzima Q (trasportatore mobile)
• Il complesso III (citocromi bc1) accetta elettroni dal Coenzima Q
• Il complesso IV (citocromi c ossidasi) accetta elettroni dal Coenzima Q e
li cede all’O2 riducendolo a H2O
Spazio intermembrana
(lato P)
Matrice (lato N)
L’energia liberata dal trasporto di elettroni alimenta un
sistema di trasporto attivo che espelle i protoni dalla matrice
verso l’esterno (pompa protonica)
Per ogni
coppia di
elettroni
vengono
espulsi 4
protoni
I protoni non possono
attraversare la
membrana esterna e
quindi rimangono nello
spazio intermembrana
Il flusso protonico
produce un potenziale
elettrochimico tra i
due lati della
membrana
L’interno risulta
essere più negativo e
l’esterno più acido di
circa 1 unità di pH a
causa della maggiore
[H+]
Flusso degli elettroni attraverso il complesso III
Il complesso IV cede
gli elettroni all’O2
che si riduce a H2O
Il complesso F0 F1 contiene un canale protonico e l’enzima
che sintetizza l’ATP
Gli H+ rientrano
attraverso un
canale specifico
(F0)
L’energia rilasciata dal passaggio degli H+
(forza motrice protonica) viene sfruttata per
la sintesi di ATP, catalizzata
dall’ATP sintasi
Complesso dell’ATP sintasi (F0F1)
Matrice (lato N)
Spazio
intermembrana
(lato P)
Il passaggio dei
protoni attraverso il
canale F0 induce dei
cambiamenti
conformazionali
provocando la
rotazione della
subunità c e della
subunità g .