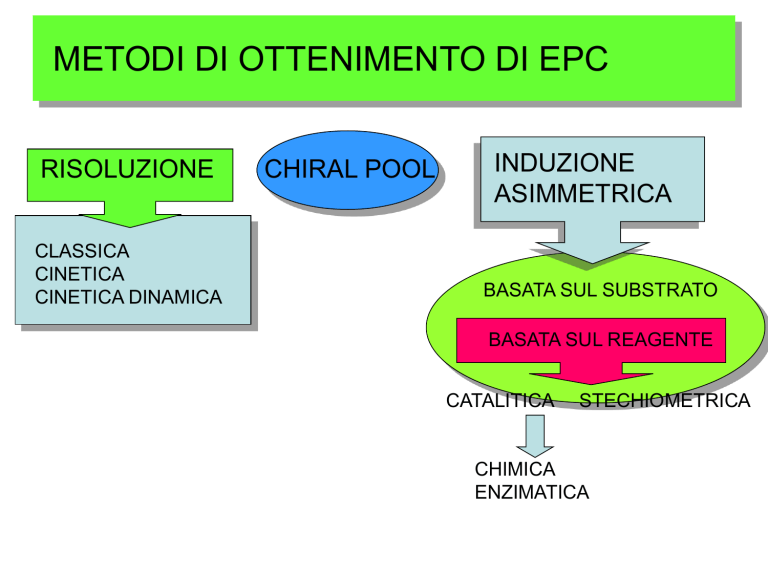
METODI DI OTTENIMENTO DI EPC
RISOLUZIONE
CLASSICA
CINETICA
CINETICA DINAMICA
CHIRAL POOL
INDUZIONE
ASIMMETRICA
BASATA SUL SUBSTRATO
BASATA SUL REAGENTE
CATALITICA
STECHIOMETRICA
CHIMICA
ENZIMATICA
RISOLUZIONE DI RACEMI
1. RISOLUZIONE CLASSICA
Formazione di diastereoisomeri
Agente derivatizzante
(risolvente)
enantiomericamente puro
Miscela di diastereoisomeri
Diastereoisomeri
separabili
Libero l’agente
derivatizzante
1. RISOLUZIONE CLASSICA
Formazione di sali diastereoisomeri
NH2
chirale racemo
Ph
+
HO
HO2C
HO
OH
CO2-
nelle acque madri HO2C
agente risolvente
otticamente puro
CO2H
R,R
OH
HO
OH
CO2-
HO2C
NH3+
NH3
cristallizza
+
Ph
Ph
NaOH
NaOH
NH2
NH2
Ph
(R)-(+)
Ph
(S)-(-)
1. RISOLUZIONE CLASSICA
Formazione di composti diastereoisomeri
O
Agente derivatizzante
Ph
O
O
OH
O
+ HO2C
OMe
Ph
O
OMe
O
OMe
()
separabili per cromatografia
O
Ph
O
NaOH, H2O
OH
+ HO2C
OMe
OMe
O
O
Ph
NaOH, H2O
OH
OMe
+ HO2C
OMe
separati
si recupera
Ph
OMe
1. RISOLUZIONE CLASSICA
Risoluzione fisica
O
Ph
NH
OH OH
Si
O O Si O
O
O
O Si
Si
O
O O
Si
O O
Si
O O Si O
O
O
O Si
Si
O
O O
NO2
NH
O
NO2
1. RISOLUZIONE CLASSICA
Risoluzione fisica
GC e HPLC chirale
Interazione
favorevole
Interazione
sfavorevole
Miscela racema da
separare
Fase stazionaria
chirale
Per misure di e.e.
Enantiomero
trattenuto dalal
fase
stazionaria
Enantiomero
eluito
1. RISOLUZIONE CLASSICA
Risoluzione fisica
GC e HPLC chirale
Regola dei tre punti di attacco
1. RISOLUZIONE CLASSICA
Risoluzione per inclusione
CICLODESTRINE
1. RISOLUZIONE CLASSICA
Risoluzione per inclusione
CICLODESTRINE
RISOLUZIONE CINETICA
Reagente o catalizzatore chirali enantiomericamente puri
R1
R
X
kR
R2
R1
R
Y
R2
kR >> kS
R2
kS
S
R2
S
X
R1
Y
R1
R enantiomero “veloce” o eutomero; S enantiomero “lento” o distomero
RISOLUZIONE CINETICA
Agente risolvente: enzima
kR
kS
R enantiomero “veloce” o eutomero; S enantiomero “lento” o distomero
Selettività della risoluzione
E=
kR
Rapporto enantiomerico
kS
eeP (1 - eeS )
eeP eeS
E
ee (1 eeS )
ln P
eeP eeS
ln
R enantiomero “veloce”. Coincide con P (prodotto) della seconda relazione.
S enantiomero “ lento”. Coincide con S (substrato non reagito) della seconda relazione.
E
10
19
49
100
e.e.
P
%
83
90
95
98
E = 1 nessuna stereoselettività
E fino a 10: bassa selettività
E 15 – 30 modesta – buona
E > 200 eccellente
Selettività della risoluzione
–
–
–
–
E.e. dipende dalla conversione
E.e. Del prodotto diminuisce al di sopra del 50% conversione
E.e. Del substrato è basso sotto il 40% conversione
La conversione è la frazione di substrato convertita nel prodotto
c conversion
P S0 S
S0 S0
Selettività della risoluzione
Selettività della risoluzione
Risoluzioni cinetiche (KR)
Resa teorica massima del 50%
Separazione dei prodotti necessaria
Eventuale smaltimento dell’enantiomero
indesiderato
KR VIA EPOSSIDAZIONE ASIMMETRICA
DI SHARPLESS
Risoluzione cinetica
R3
R2
R2
R
R3
veloce
OH
R1
R
OH
R1
H
O
H
L-(+)-dialchiltartrato
R3
R2
R2
H
R3
lento
H
OH
R1
R
R1
O
L-(+)-dialchiltartrato
R
OH
KR VIA EPOSSIDAZIONE ASIMMETRICA
DI SHARPLESS
E
i-Pr
O
i-Pr
O
O
EtO
R
O
O
O
O
O
Ti E
TiE
O
O
O
O
t-Bu
E
i-Pr
i-Pr
R
O
O
EtO
R
O
Ti E
TiE
O
O
R
O
O
t-Bu
O
EPOSSIDAZIONE ASIMMETRICA DI
SHARPLESS
Risoluzione cinetica
OH
L-(+)-DET
t-BuOOH
Ti(OPr-i)4
OH
+
O
OH
ENZIMI
Sintesi asimmetrica: l’enzima agisce asimmetricamente su un substrato prochirale
Risoluzioni cinetiche: l’enzima riconosce la chiralità del substrato
(Riconoscimento chirale)
Composti che possono essere convertiti in singoli enantiomeri
ENZIMI
ENZIMI
Free
energy
Enzymetransition
state
complex
EX‡
Transition
state
X‡
Substrate
S
Enzyme +
Substrate
E+S
Enzyme
substrate
complex
ES
Enzyme –
product
complex
EP
Product
P
Enzyme+
Product
E+P
Reaction coordinate
ENZIMI
Accelerazione: effetti di prossimità
Specificità: interazioni con i siti di binding
Specificità della famiglia delle Ser-proteasi
Trypsin
Chymotrypsin
Elastase
cuts at Lys, Arg
cuts at Trp, Phe, Tyr
cuts at Ala, Gly
O
O
–C–N–C–C–N–
C
O
O
–C–N–C–C–N–
CH3
Shallow and
non-polar
pocket
Non-polar
pocket
Active Site
Juang RH (2004) BCbasics
Deep and negatively
charged pocket
O
O
–C–N–C–C–N–
C
C
C
C
NH3
+
COOC
Asp
ENZIMI
IDROLASI
ESTERASI. Substrato naturale: esteri di acidi grassi.
Esempi PLE (Porcine Liver Esterase), HLE (Horse Liver Esterase)
LIPASI substrato naturale: trigliceridi (esteri del glicerolo e di acidi grassi).
Esempi PPL (Porcine Pancreatic Lipase), PFL (Pseudomonas Fluorescens Lipase),
PROTEASI substrato naturale: peptidi, proteine
Esempi: a-chimotripsina
ENZIMI
IDROLISI ENZIMATICHE
Me
R
O
Me
lipasi
O
R
H2O
pH 7
O
Me
+ AcOH
+
O
R
OH
Idrolisi di esteri di alcoli chirali (enzimi preferiti: lipasi)
O
R
MeO
Me
O
esterasi
H2O
pH 7
O
R
MeO
R
HO
+
Me
+ MeOH
Me
Idrolisi di esteri di acidi carbossilici chirali (enzimi preferiti: esterasi)
Me
R
N
H
O
Me
proteasi
R
H2O
pH 7
N
H
O
Me
+
+ AcOH
R
NH2
Idrolisi di ammidi di acidi carbossilici chirali (enzimi preferiti: proteasi)
ACILAZIONI ENZIMATICHE
Me
R
OH
Me
lipasi
solvente
R
O
Me
+
O
+ CH3CHO
R
OH
OCOCH3
Acetilazioni di alcoli secondari chirali (enzimi preferiti: lipasi)
Me
R
NH2
Me
lipasi
solvente
CH3COOEt
O
Me
+ EtOH
R
N
H
+
R
NH2
Acetilazioni di ammine primarie chirali (enzimi preferiti: lipasi)
RISOLUZIONE CINETICA DINAMICA
Reagente* o catalizzatore*
R1
X
kR
R2
R1
Y
R2
kRAC
kR >> kS
R2
kS
R2
S
X
R1
R
Y
R1
Risoluzione classica accoppiata alla racemizzazione in situ dell’enantiomero “lento”
RISOLUZIONE CINETICA DINAMICA
Per una DKR efficiente
La corrispondente KR deve essere irreversibile
La stereoselettività deve essere alta (kS >> kR o
kR>> kS), (es. E = kR/kS > 20)
La velocità di racemizzazione deve essere maggiore
della velocità di reazione
La racemizzazione del prodotto deve essere
trascurabile
Metodi di racemizzazione
Catalizzata da metalli di transizione e loro complessi
OH
R
H
R'
R
Ph
O
R'
H
Ph
Ru
OC OC
R
H
R'
racemo
Ph
O
Ph
Ph
Ph
OH
H
[Ru]
H
O
[Ru]
Ph
Ph
Ru
CO CO
Ru2(CO)4(-H)(C4Ph4COHOCC4Ph4)
Shvo’s catalyst
SHVO’S CATALYST
SHVO’S CATALYST
In combination with enzymes:
Racemization
3. Schiff-base mediated racemization
R
4. Racemization via SN2 processes
Racemizzazione
Racemizzazione basica
Dynamic kinetic resolution DKR
Racemizzazione basica
hydantoinase
Racemizzazione In situ
R = Ph
Racemization
1. Base racemization
proteasi
Ketorolac
S-enantiomero
Ee 85%, resa 92%
antiinfiammatorio
Racemization
4. Metal catalyzed racemization
Racemizzazione via intermedi p-allile
M = Pd(II)
Racemizzazione via intermedi sp2
Ru(II)
ENZIMI - Desimmetrizzazioni
Sintesi asimmetrica: l’enzima agisce asimmetricamente su un substrato prochirale
Risoluzioni cinetiche: l’enzima riconosce la chiralità del substrato
(Riconoscimento chirale)
Composti che possono essere convertiti in singoli enantiomeri
DESIMMETRIZZAZIONI
Substrato: un composto prochirale A
Resa massima teorica: 100%
E
k1
k2
ee
R S E 1
R S E 1
DESIMMETRIZZAZIONI
1. Differenziazione di gruppi enantiotopici
pro-R
R
X
1
R2
R
1
R2
X
pro-S
X
X>R2>R1
Y
Preferenza per la funzione X pro-S
e.e. fino al 99.9%
Ph
pro-R
Ph
k1
R
CO2Me
pro-S
CO2H
CO2Me
>>
CO2Me
k2
Ph
S
Esterasi
CO2Me
CO2H
preferenza per la funzione pro-R
k1>k2
DESIMMETRIZZAZIONI
1. Differenziazione di gruppi enantiotopici
Esterasi
Asimmetrizazioni di
glutarati prochirali
e.e. fino a 99.9%
DESIMMETRIZZAZIONI
1. Differenziazione di gruppi enantiotopici
pro-S
Ph
k1
Ph
R
OAc
OAc
OH
OAc
pro-R
k3
Ph
k4
k2
Ph
S
OH
OH
OH
OAc
preferenza per la funzione pro-R
k1>k2
DESIMMETRIZZAZIONI
1. Differenziazione di gruppi enantiotopici
DESIMMETRIZZAZIONI
Sharpless epoxidation
O
OH
slow
fast
O
OH
OH
O
OH
slow
fast
O
99.4%ee al 50%conv
99.9% ee al 99%conv
kfast/kslow = 104
DESIMMETRIZZAZIONI
1. Differenziazioni di gruppi enantiotopici: STRATEGIA «MESO»
Asimmetrizationi di
1,2-dicarbossilati ciclici a
monoesteri chirali
DESIMMETRIZZAZIONI
1. Differenziazioni di gruppi enantiotopici: STRATEGIA «MESO»
CO2H
CO2Me
k1
CO2Me
1R,2S
CO2Me
CO2Me
k2
CO2H
1S,2R
OH
k1
OAc
OAc
k3
OH
1S,2R
OAc
k4
k2
OAc
OH
1R,2S
OH