I BATTERI SPORIGENI
[email protected]
• Bacilli sporigeni anaerobi: Il genere
Clostridium. Meccanismo d'azione delle
tossine tetanica e botulinica.. Patogenesi del
tetano, botulismo, gangrena gassosa.
Epidemiologia, diagnosi, prevenzione e
terapia.
• Bacilli sporigeni aerobi: Il genere Bacillus.
Esotossine di B. anthracis, struttura
antigenica, malattia provocata, epidemiologia
e prevenzione. Intossicazione alimentare da
B. cereus.
sono bacilli Gram positivi aerobi e
anaerobi, che in determinate
condizioni ambientali sfavorevoli
danno luogo alla formazione di cellule
strutturalmente e funzionalmente
differenziate cui si da il nome di
SPORE.
• Tra i batteri di interesse medico i
bacilli sporigeni appartengono ai
generi :
• Clostridium (anaerobi )
• Bacillus (aerobi)
GENERE: Clostridium
BACILLI, GRAM +,
Bastoncellari di 3-8 mm
Sporigeni
Catalasi-negativi
•
ANAEROBI OBBLIGATI:
non producono enzimi in grado di inattivare i prodotti tossici dell’azoto e
dell’ossigeno (catalasi, perossidasi, superossido dismutasi ecc.);
hanno enzimi che operano bene solo allo stato ridotto.
•
UBIQUITARI:
si moltiplicano nel lume intestinale degli erbivori e le spore, emesse con
le feci, contaminano l’ambiente sopravvivendo a lungo (possono essere
sparse con il vento e sono presenti nella polvere)
•
ALCUNE SPECIE ELABORANO POTENTI ESOTOSSINE
GENERE: Clostridium
•
•
•
Raramente capsulati,
ENDOSPORE con caratteristica posizione terminale o
subterminale a diametro eccedente quello delle cellule che le
contengono.
In gran parte sono mobili per la presenza di flagelli peritrichi
•
•
•
•
Clostridium tetani
Clostridium botulinum
Clostridium perfrigens
Clostridium difficile
1 scissione dei perossidi
Le infezioni nell’uomo sono dovute a
introduzione accidentale nei tessuti
profondi dei clostridi o delle spore o
dell’assunzione con alimenti di tossine
Bastoncello (BACCHETTA DI TAMBURO)
GRAM +
Sporigeno
Mobile (per flagelli peritrichi)
Anaerobio obbligato
TOSSINA TETANICA : TETANOSPASMINA
Clostridium tetani
Il tetano (tetanos = rigidità) è caratterizzato da spasmi muscolari (paralisi
spastica) con concomitante paralisi flaccida (muscoli oculari).
Compromissione della funzionalità muscolare a livello respiratorio
(soffocamento dovuto al rigurgito del contenuto dello stomaco).
C. tetani produce 2 tossine:
Tossina tetanica
150Kd
Tetanolisina
è un’emolisina ossigeno labile il cui
significato é ancora sconosciuto
Tetanospasmina
Lisiuna
delneurotossina
batterio termolabile
Proteasi intrinseca
L50Kd
H100Kd
A-B sintetizzata come un unico peptide di 150Kda
che viene poi tagliato in una subunità leggera
(catena A) ed una subunità pesante (catena B) ad
opera di una endonucleasi endogena quando la
cellula rilascia la neurotossina. Le due catene sono
unite tra loro da un ponte disolfuro e da forze non
covalenti
Si lega ai gangliosidi delle
cellule nervose (B)
Porzione attiva (A): blocco sinapsi inibitorie
Liberazione impulsi eccitatori
(qualsiasi contrazione muscolare si accompagna alla contrazione della muscolatura
antagonista)
Paralisi spastica
Meccanismo d’azione
•
La tossina può penetrare nel SNC lungo i nervi motori periferici o può risultare veicolata dal sangue
al tessuto nervoso.
•
La porzione carbossiterminale della
sulle membrane dei neuroni.
•
La catena leggera della tossina A, una zinco-endopeptidasi, viene quindi internalizzata e si
muove dalle terminazioni periferiche verso il SNC mediante trasporto assonico retrogrado. Viene quindi
rilasciata dai dendriti post sinaptici, attraversa le giunzioni sinaptiche e si localizza nelle vescicole delle
terminazioni nervose pre-sinaptiche.
catena pesante B si lega ad un recettore di superficie presente
La TETANOSPASMINA blocca l’impulso nervoso che inibisce il riflesso da stiramento
muscolare per cui ad ogni contrazione muscolare segue la contrazione simultanea del muscolo antagonista.
Ne consegue una paralisi di tipo spastico
•
Il legame della tossina è irreversibile per cui la guarigione
dipende dal tempo necessario per la formazione
di nuove terminazioni assoniche
•
Neurotrasmettitori eccitatori
STIMOLAZIONE
CONTINUA
Neuro–trasmettitori inibitori
Diffonde lungo i cilindrassi dei nervi
motori e raggiunge il midollo spinale
dove blocca la trasmissione a livello
delle sinapsi inibitorie dando luogo ad
impulsi eccitatori (paralisi spastica)
BLOCCATI:
Tale blocco da via libera agli impulsi eccitatori.
il blocco degli impulsi inibitori
provoca una serie di spasmi generalizzati che interessano i m. estensori e flessori PARALISI
SPASTICA
Caratteristiche cliniche
•L’infezione tetanica si verifica in seguito a una ferita molto profonda specie se è contaminata da terreno,
letame o metallo arrugginito
•L’ infezione può anche insorgere in seguito a ulcere, circoncisioni, iniezioni intramuscolari, peercing e tattoo
ecc.
Il periodo di incubazione (va dal tempo di inoculazione al primo sintomo) dura 7-10 giorni. Generalmente,
più breve è il periodo di incubazione più grave è il decorso clinico.
•Il periodo di esordio (dai primi sintomi all’inizio degli spasmi) va da 1 a 7 giorni
•Il quadro clinico è dominato da contrazioni muscolari che di solito iniziano dal capo, e progrediscono poi verso
il tronco e gli arti. Un caratteristico sintomo iniziale è il TRISMA (o mandibola serrata), cioè la contrattura
del muscolo massetere, che dà al volto del paziente un aspetto caratteristico (riso sardonico), seguito da
rigidità del collo, difficoltà di deglutizione, rigidità dei muscoli addominali. Altri sintomi includono febbre,
sudorazione, tachicardia, ipertensione ecc.
•Il paziente rimane conscio e gli spasmi muscolari, provocati da stimoli anche minimi, causano dolore.
Diagnosi
•
La diagnosi è fatta clinicamente , in un paziente con rigidità muscolare o con spasmi è molto
indicativa l'anamnesi di una ferita pregressa.
•
Il tetano può essere confuso con meningo-encefalite di origine batterica o virale.
•
Il trisma va distinto da ascessi peritonsillari o retrofaringei o altre cause locali.
•
Le fenotiazine (tranquillanti) possono provocare una rigidità simil-tetanica.
•
Il reperimento microscopico o isolamento di C.tetani è facile ma di scarso successo. Soltanto il
30% dei pazienti con tetano risulta positivo alle colture poichè la malattia è causata da
relativamente pochi microrganismi e i batteri a lenta crescita sono facilmente uccisi quando
esposti all’aria.
•
Inoltre spesso il tetano lo si confonde con altre sindromi es. il tetano neonatale è difficilmente
distinguibile da ipoglicemia, meningite ecc.
•
Lo “spatola test” aiuta nella diagnosi. Esso consiste nella stimolazione della faringe
con una spatola che provoca un intenso spasmo dei masseteri nei pazienti affetti tant’è che
mordono la spatola.
ANTITOSSINA: i benefici dell'antisiero dipendono dalla quantità di tetanospasmina che si sia già legata alle membrane sinaptiche.
Per gli adulti, è generalmente raccomandata una singola dose IM di 3.000 U di
immunoglobulina tetanica umane con una concentrazione variabile da 1.500 a
10.000 U, a seconda della gravità della ferita.
Le antitossine di origine animale sono meno preferibili in quanto non viene
mantenuto in maniera adeguata il livello di antitossina nel siero del paziente ed
esiste un significativo rischio di malattia da siero. Se tuttavia è necessario far uso
di siero di cavallo, la dose abituale è di 50.000 U IM o EV
Terapia
•Il trattamento del tetano richiede la pulizia della ferita e la
terapia con il METRONIDAZOLO per eliminare le forme vegetative
dei batteri che producono la tossina.
•Il metronidazolo e la penicillina hanno attività equivalente nei
confronti di C. tetani.
•la terapia degli spasmi tetanici è essenzialmente sintomatica, e si avvale di
sedativi o anestetici generali, neuroplegici, farmaci curaro-simili.
•Nessun antibiotico sembra poter prevenire le infezioni secondarie
(p. es., la polmonite). Se queste si sviluppano bisognerà prelevare
campioni per gli esami colturali, effettuare test di antibiotico-sensibilità e
quindi somministrare, se necessario, un antibiotico adeguato.
PROGNOSI
Il tetano ha un tasso mondiale di mortalità
del 50%; la mortalità è massima nei pazienti
giovani e anziani e nei tossicodipendenti.
La prognosi è peggiore se il periodo di
incubazione è breve e se i sintomi progrediscono
rapidamente oppure se la terapia è ritardata.
•
C. botulinum (dal lat. botulus: salsiccia).
•
Spora ovale in posizione da subterminale a paracentrale, che
deforma lo sporangio.
•
Questa specie è largamente distribuita in natura nel suolo e nella
polvere e quindi può facilmente contaminare vegetali, frutti e
alimenti di origine animale e marina.
•
Le spore sono notevolmente resistenti al calore: infatti occorre una
temperatura di 121°C per 30 minuti perché siano distrutte;
•
possono sopravvivere ai processi di cottura dei cibi e
successivamente, in ambiente anaerobico, germinare nella forma
vegetativa del germe con eventuale produzione di tossina da parte
di quest'ultima.
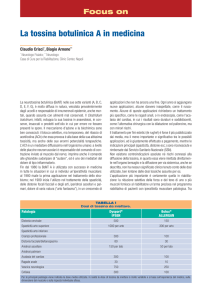
La tossina botulinica
La tossina botulinica è uno dei piu potenti veleni naturali esistenti al mondo, basti
pensare che 75 ng di tossina pura sono in grado di uccidere un essere umano,
mentre 450 grammi sarebbero più che sufficienti a sterminare ogni essere umano
vivente sul pianeta.
È una neurotossina,è presente nel suolo
in tutto il mondo, nelle acque costiere e nei
laghi e talvolta nelle feci degli animali.
Durante lo crescita del microrganismo la
tossina si mantiene nel terreno in scarsa
quantità fino a quando in fase avanzata è
rilasciata in seguito a lisi cellulare.
Sierotipi della tossina
•
Esistono 7 sierotipi di tossina denominati BoNT / A
Causano una patologia detta Botulismo
•
I tipi A, B ed E (talvolta F) risultano più frequentemente associati con la
malattia umana.
I tipi A e B sono stati associati con una varietà di alimenti; il tipo E
prevalentemente con prodotti ittici.
Il tipo C provoca botulismo aviario; e il tipo D botulismo nei mammiferi.
Il seriotipo G non è associato a patologie nell’uomo.
•
Esiste anche una particolare distribuzione geografica dei sierotipi: il tipo A
è quello più diffuso negli USA, mentre il tipo B è maggiormente diffuso in
Europa.
G.
Struttura della tossina
La tossina è prodotta come una singola catena
polipeptidica di 150 kDa.
Un successivo taglio proteolitico da parte di una
proteasi rilascia la forma attiva della tossina
costituita da una catena pesante di 100 kDa e
una catena leggera di 50 kDa unite da ponti
disolfuro.
La catena pesante lega in maniera specifica la
superficie di cellule target e permette
l’internalizzazione della tossina; la catena
leggera è responsabile dell’azione tossica vera
e propria della tossina.
Meccanismo d’azione
La tossina una volta nell’organismo non
è inattivata da acidità gastrica o enzimi
di stomaco e
duodeno. Nel lume
dell’intestino si lega alla superficie
apicale delle cellule epiteliali (transport
cell)
e mediante un processo di
endocitosi e transcitosi è trasportata e
rilasciata dalla superficie basolaterale
delle cellule stesse.
Questo permette alla tossina di
raggiungere la circolazione generale e le
cellule target
Neuroni colinergici presinaptici nelle
giunzioni neuromuscolari
Vescicole contenenti acetil-colina
B
A
A
Fibra muscolare
La tossina impedisce il rilascio dell’acetilcolina dalle
vescicole
Stimolazione muscolare BLOCCATA
PARALISI FLACCIDA
Morte per paralisi della muscolatura respiratoria
•
1) il botulismo di origine alimentare, un'intossicazione causata
dall'ingestione di tossina botulinica preformata in cibi contaminati (il
nome Clostridium botulinum deriva dal fatto che gli insaccati sono tra gli alimenti più frequentemente
contaminati, insieme con le conserve alimentari)in condizioni di anaerobiosi,basso
contenuto salino o zuccherino e valori di pH ≥5
•
2) botulismo di ferite (la forma più rara), che si verifica in seguito
all'elaborazione di tossina botulinica in vivo dopo la crescita di
Clostridium botulinum dalle spore che hanno contaminato una
ferita infetta, con un periodo d'incubazione di 4-14 giorni;
•
3) botulismo infantile, in cui la tossina botulinica è elaborata in vivo
nel tratto intestinale di bambini colonizzati con Clostridium
botulinum in seguito all'ingestione di spore in conseguenza
dell’immaturità della flora intestinale e che può essere causa di
morte improvvisa nei bambini di età compresa tra un mese e un
anno;
• 4) Intestinale dell’adulto, forma rara, in
pazienti con anomalie anatomiche o
funzionali dell’intestino o che sono stati
sottoposti a terapie antibiotiche
prolungate che ne permettono la
colonizzazione.
• 5) Iatrogeno, erronea iniezione di tossina
botulinica
sintomi
• I sintomi insorgono dopo 1-2 giorni dal consumo dell’alimento
contaminato, i pazienti manifestano :
• debolezza,
• vertigini,
• stato confusionale,
• vista offuscata,
• pupille dilatate e fisse,
• bocca secca,
• incapacità di deglutire,
• difficoltà a parlare,
• dolori addominali,
• la febbre è assente.
Progressivamente si ha paralisi flaccida che può portare alla
morte per paralisi dei muscoli respiratori.
La mortalità è circa del 60%.
DIAGNOSI MICROBIOLOGICA
Se il campione è contaminato da altri microrganismi lo si scalda per 10
minuti a 80° C per uccidere le forme vegetative,
il campione trattato al calore viene coltivato su terreno arricchito in
anaerobiosi per far germinare le spore.
Caratteristiche colturali: la crescita ottimale si ha a 35°C in condizioni
anaerobie dopo 1-2 giorni di incubazione.
Su agar sangue si osserva emolisi. Se si utilizza agar a base di rosso
d’uovo le colonie presentano una pellicola iridescente dovuta alla
produzione di lipasi.
L’identificazione può anche avvenire in base alle caratteristiche
biochimiche, ad es. fermentazione del glucosio, oppure mediante
l’analisi dei prodotti metabolici mediante gas cromatografia.
La ricerca di C.botulinum si può anche fare in immunofluorescenza,
oppure si può ricercare la tossina da esso prodotta, nell’alimento
ingerito, mediante tecnica ELISA.
DIMOSTRAZIONE DELL’ATTIVITÀ DELLA TOSSINA SU
ALIMENTO, FECI, E SIERO DEL PAZIENTE
Si fa in laboratori di riferimento tramite uno studio in
vivo sul topo:
• il campione è suddiviso in due parti e una viene
trattata con antitossina, entrambe vengono inoculate
nel topo per via intraperitoneale.
•
I topi trattati con la tossina da sola muoiono per
paralisi flaccida, se il trattamento con antitossina
protegge il topo si ha conferma dell’attività della
tossina.
TERAPIA
·
Ventilazione
·
Metronidazolo o penicillina
·
Antitossina botulinica polivalente (contro A, B, E) Serve a
legare la tossina ancora circolante nel sangue e deve
avvenire il più precocemente possibile perché una volta
che la tossina si è legata alla membrana delle cellule
nervose non è più neutralizzabile dall’antitossina.
• C. perfringens (dal lat. perfringens: che infrange, che spezza).
•
Spora ovale in posizione centrale o subterminale, che
generalmente non deforma lo sporangio.
•
E una specie ubiquitaria in natura: Clostridium perfringens è
stato infatti isolato da frutti e verdure, dal suolo e da cibi a
base di carne di vari animali (vitelli, buoi, agnelli,
maiali).
•
La flora fecale del 95% degli adulti sani contiene Clostridium
perfringens, ma esso si incontra anche in una larga varietà di
circostanze cliniche: semplici contaminazioni di ferite
traumatiche o chirurgiche, mionecrosi traumatiche o
chirurgiche, ascessi cerebrali ed epatici, colecistiti
gangrenose, infezioni post-abortive con setticemia ed emolisi
intravasale, polmoniti necrosanti, empiemi, endometriti.
• Clostridium perfringens costituisce la specie
più frequentemente isolata (circa 1'80% dei
casi) quale agente eziologico di gangrena
gassosa.
• In quest'affezione il meccanismo patogeno è
svolto da diverse tossine, di cui le più
importanti sono quelle α [alfa ]'β [beta], ε
[epsilon] e τ [iota].
• Tra queste è indubbio che il ruolo patogeno
principale nella gangrena gassosa umana
sia svolto dalla α
•
•
La tossina α [alfa] è costituita da una fosfolipasi C, cioè un enzima
che attacca tutti i fosfolipidi, con maggiore affinità verso la lecitina
(o fosfatidilcolina), che è largamente distribuita nelle membrane
delle cellule animali e che viene scissa in fosforilcolina e in un
digliceride.
L'idrolisi di questo maggiore costituente provoca un
danneggiamento dell'integrità funzionale e forse anche strutturale
della membrana cellulare.
•
la presenza di edema nella gangrena gassosa significa
proprio un'alterazione nella permeabilità degli endoteli dei
capillari.
•
L'alfa-tossina da sola può produrre la mionecrosi e può anche
causare
emolisi
Tossina alfa di C. perfrigens
• Determina la gangrena gassosa (lesione traumatica)
La zona circostante il focolaio di infezione appare
edematosa e alla palpazione si avverte un crepitio dovuto
all’accumulo di gas (H2) nel sottocutaneo. Tutte le ferite
sono potenzialmente a rischio di contaminazione
Essendo i clostridi poco virulenti
la loro moltiplicazione è consentita solo da estese zone di
necrosi.
La malattia è caratterizzata da edema, necrosi, colliquazione
e formazione di gas della parte infetta; si ha anche
sovrapposizione di infezione da piogeni in grado di
aumentare la gangrena. La necrosi può estendersi con
tossicosi generale
Coinvolgimento tessuto muscolare
mionecrosi anaerobica. Questa situazione è facilitata dalla
contaminazione di terriccio contenente sali di calcio
solubili (la tossina è una fosfolipasi C che necessita di Ca
per il suo funzionamento).
Identificazione anaerobiosi e identificazione biochimica.
38
Clinica della gangrena gassosa
Incubazione
Da tre ore ad alcune settimane
Ferita con aspetto gangrenoso e crepitio per
presenza di gas
Tossiemia con febbre ≥38°C, tachicardia, sintomi
gastrointestinali,
emolisi
massiva,
insufficienza
renale,delirio
Coma, con successivo exitus del paziente
39
Clostridium perfrigens
Intossicazioni alimentari
Ingestione di cibi in cui sia presente la tossina (p.i. 8 a 24 ore,
mediamente 12 ore)
Sintomatologia: diarrea e vomito
Alcuni stipiti di C. perfrigens sono in grado di elaborare una
tossina enterotossica che si produce solo in condizioni in cui sia
possibile la sporificazione.
Questa tossina è infatti associata alla tunica sporale con
caratteristica di super antigene.
40
Il C. difficile è un bacillo Gram positivo, anaerobio, sporigeno.
I ceppi di interesse clinico sono tossinogenici, produttori di due potenti tossine: A
e B.
La tossina A è una enterotossina con lieve attività citotossica. Provoca: danno alle
mucose, infiammazione (in vitro richiama i granulociti polimorfonucleati e ciò giustificherebbe
la marcata infiammazione nella CPM) e secrezioni intestinali.
Inizialmente danneggia i villi intestinali distruggendo gli orletti a spazzola della membrana.
Il danno alla mucosa può arrivare all’erosione.
La tossina B è una citotossina. Ha un effetto citopatico con azione patogena 1000 volte più
potente della tossina A.
E’ una delle più potenti citotossine conosciute: un solo picogrammo (1g x 10-12 cioè un millesimo di
miliardesimo di grammo) può produrre l’effetto citotossico.
La tossina B sembra che agisca distalmente dall’intestino, oltrepassando la mucosa intestinale
danneggiata.
I principali effetti citotossici sono: perdita di potassio intracellulare, inibizione della sintesi proteica e degli
acidi nucleici.
Vi sono ceppi di C. difficile non produttori di tossine che non sono patogeni.
Clostridium difficile : Colite pseudomembranosa
•
•
In seguito ad intensi trattamenti antibiotici che modificano la
popolazione batterica intestinale creando condizioni idonee alla
moltiplicazione dei Clostridi
Tossina A
Rottura delle giunzioni inter-cellulari (epitelio mucoso)
Distacco della membrana basale
Eliminazione di liquidi nel lume intestinale
Emorragie (diarrea muco-sanguinolenta)
42
HABITAT E DIFFUSIONE
Si ritrova nel suolo, nella sabbia, nelle feci di cani, gatti e uccelli domestici.
Fa parte della normale flora intestinale e vaginale.
Nell’adulto è presente in bassa percentuale mentre è molto più abbondante
nel bambino. I neonati, per cause non accertate, sono refrattari alla colite
pseudomembranosa anche nel caso che presentino una elevata carica
di ceppi tossinogenici di C. difficile ed alti livelli di tossine.
È stimato che il 50% o più dei neonati vengano colonizzati con C. difficile
tossinogenico e sono, ciononostante, asintomatici.
In ambiente ospedaliero la contaminazione ambientale
(suppellettili, pavimenti) e del personale (soprattutto
mani) è particolarmente pericolosa ed insidiosa
nell’ambiente il C. difficile può persistere per mesi
essendo sporigeno.
BACILLUS
Bastoncini
Gram-positivi o Gram-variabili
Aerobi o anaerobi facoltativi
Sporigeni
Mobili (con l’eccezione di B.antrhacis che è immobile)
Le cellule sono allungate con la parte terminale arrotondata o quadrata, si
presentano singoli o in catenelle di diversa lunghezza a seconda della specie.
Le endospore hanno di norma posizione centrale o paracentrale e il loro diametro
non eccede mai quello della cellula madre o sporangio.
Attualmente il genere Bacillus comprende 51 specie ben descritte di cui la sola
specie altamente patogena per l’uomo è il Bacillus anthracis , agente eziologico
del carbonchio .
•
Bacillus anthracis ha fatto la storia della batteriologia in tutti i campi:dalla
microbiologia industriale, a quella del suolo a quella di interesse clinico sia
umano che veterinario.
•
Bacillus anthracis è stato uno dei primi batteri patogeni isolati e di cui si sia
dimostrata la correlazione con la malattia infettiva nota come carbonchio o
antrace.
•
Su questa specie sono stati formulati i famosi postulati di Koch
•
.Questi postulati definiscono i criteri per attribuire a un agente patogeno la
causa di una determinta malattia infettiva.
•
In questo caso Bacillus anthracis = carbonchio.
•
Sono criteri ancora applicati.
•
Bacillus anthracis è tra i primi nella lista dei potenziali patogeni utilizzati nel
bioterrorismo
HABITAT
Per la maggior parte sono saprofiti, ampiamente distribuiti nel suolo,
nell’acqua e nell’aria. Alcune specie sono termofile, acidofile o alofile,
sono in grado di sopravvivere in forma di spore in condizioni ambientali
estreme.
SIGNIFICATO CLINICO
La maggior parte dei microorganismi del genere Bacillus è raramente
associata a malattie nell’uomo, le principali eccezioni riguardano il
B.antrhacis e B.cereus
Bacillus anthracis
Il CARBONCHIO O ANTRACE è una malattia che colpisce
principalmente gli erbivori e che può essere trasmessa
all’uomo.
Le spore che si trovano nel suolo o sulla vegetazione
vengono ingerite o inalate, oppure raggiungono il
sottocutaneo attraverso abrasioni della cute o delle mucose.
Le spore germinano nei tessuti e se i bacilli raggiungono il
sistema linfatico o la circolazione può sopravvenire una
setticemia fatale.
Nell’uomo la malattia è considerata un rischio professionale
per agricoltori, veterinari (carbonchio agricolo) o addetti alla
lavorazione industriale delle pelli, della lana o del cuoio
(carbonchio industriale).
FATTORI DI VIRULENZA
Per essere completamente virulento B.antrhacis deve produrre:
Una CAPSULA PROTEICA che rende il batterio in grado di eludere la
fagocitosi, ma non la produzione di anticorpi protettivi .
Una ESOTOSSINA
L’esotossina proteica è formata da tre fattori:
fattore edemigeno (EF)
antigene protettivo (PA)
fattore letale (LF)
Separatamente non esplicano attività tossica
PA e LF costituiscono la tossina letale, LeTx, che è la maggior responsabile della
reazione simile allo shock, caratteristica degli stadi finali dell’antrace.
MANIFESTAZIONI CLINICHE
Vi sono tre diverse forme di antrace:
- Antrace cutaneo in cui il batterio penetra nell’organismo attraverso lesioni
di continuo della cute.
Le spore germinano e dopo un periodo di incubazione di 2-5 giorni, si
sviluppa una lesione papulosa infiammatoria che evolve in vescicola,
la quale si rompe e viene sostituita da un’escara nera circondata da edema.
Nelle forme gravi si ha ingrossamento dei linfonodi regionali ed infine
invasione del circolo sanguigno.
la malattia localizzata è
benigna.
Residua solo una cicatrice.
• È la forma più grave della patologia e presenta un
decorso rapido e difficilmente curabile.
•
Le spore di B. anthracis hanno un diametro di 1-2
μm, ottimale per la loro deposizione a livello degli
alveoli polmonari, in seguito ad inalazione.
• le spore vengono fagocitate dai macrofagi alveolari,
trasportate verso i linfonodi del mediastino e
peribronchiali, e già all’interno dei macrofagi
possono germinare e dare origine alla forma
vegetativa del bacillo.
• Il periodo di incubazione può variare da dieci giorni
a sei settimane
la prima fase, che dura tre o quattro giorni, è
caratterizzata da sintomi non specifici, simili a
quelli dell’influenza, con febbre, disturbi
gastrointestinali (nausea, vomito, diarrea, dolori addominali),
cefalea, tosse, dolori toracici.
•
La seconda fase comprende dispnea, febbre,
shock settico e conseguente morte del
paziente.
• Già nei primi stadi della malattia, sono evidenti
mediastiniti emorragiche e marcate effusioni
pleurali.
Antrace gastrointestinale
•
si manifesta in seguito
all’ingestione di carne poco
cotta proveniente da animali
infetti.
•
La tossina prodotta
nell’intestino forma una
lesione necrotica dell’ileo o
del cieco; l’indice di
mortalità è elevato.
•
Il trattamento farmacologico standard per l’antrace prevede la
somministrazione di antibiotici, solitamente penicillina o doxiciclina, ma
possono essere utili anche streptomicina, eritromicina o cloramfenicolo
[Barlett et al., 2002], tuttavia tali terapie antimicrobiche sono efficaci
soltanto nei casi della forma cutanea dell’antrace.
•
Per quanto concerne la forma da inalazione, raramente la malattia
viene diagnosticata prima che si stabilisca la setticemia e quindi la
terapia risulta spesso inefficace.
•
La durata della terapia non è definita, può variare da 60 a 100 giorni:
durante l’esposizione, il microrganismo può persistere sottoforma di
spore, che possono germinare alla fine della terapia e causare i sintomi
letali.
•
La profilassi può rivelarsi utile nel caso in cui ci sia il sospetto di
esposizione a spore di B. anthtracis, e comprende un trattamento per
sei settimane con doxiciclina o ciprofloxacina, antibiotici cui
generalmente il bacillo è sensibile
PREVENZIONE
Il vaccino disponibile per uso umano è prodotto da BioPort Corporation,Lansing, Michigan, ed è
un vaccino costituito da un filtrato di colture di un ceppo di B. anthracis privo di capsula e non
virulento che produce l’antigene protettivo (vaccino vivo attenuato).
Esso viene somministrato per via sottocutanea in 6 dosi, rispettivamente a 0, 2, 4 settimane e
dopo 6, 12 e 18 mesi con necessità di un richiamo annuale.
L’efficacia dimostrata è del 92.5%.
La vaccinazione è raccomandata nei seguenti gruppi:
• personale di laboratorio a contatto con B. anthracis,
• persone a contatto con animali o con prodotti animali provenienti da aree ad elevata incidenza
di antrace o dove le misure di controllo siano insufficienti,
• militari impiegati in aree ad alto rischio.
Per essere efficace il ciclo vaccinale deve essere eseguito almeno 18 mesi prima del contatto a
rischio.
Non vi è necessità di isolamento dei pazienti affetti da antrace.
Grazie per l’attenzione
•
La profilassi può rivelarsi utile nel caso in cui ci sia il sospetto di
esposizione a spore di B. anthtracis, e comprende un trattamento per
sei settimane con doxiciclina o ciprofloxacina, antibiotici cui
generalmente il bacillo è sensibile.
•
Attualmente il vaccino impiegato per le persone a rischio di
esposizione a livello professionale, è costituito da supernatante di
colture di B. anthracis tossinogenici e privi di capsula, precipitato con
idrossido di alluminio, (AVA, ‘anthrax vaccine adsorbed’). [Leppla et
al.,2002]
•
Il principale componente immunogenico è l’antigene protettivo,
PA, per questo sono in fase di studio dei vaccini costituiti da proteine
mutanti di PA, che non presentano il sito di taglio riconosciuto dalle
proteasi cellulari, tali mutanti non risultano tossici, ma sono in grado
di provocare un’intensa risposta immunitaria, simile a quella
sviluppata da PA nativo [Singh et al., 1998].
Recentemente sono state prodotte a scopo terapeutico, delle
molecole di PA mutate in alcuni residui situati nella porzione di
proteina che partecipa alla formazione del poro [Sellman et al.,
•
Bacillus antracis
Clostridium botulinum
Mortale nel 60% dei casi
Intossicazione dovuta ad ingestione di cibi (carni non cotte) contaminati e
nei quali il batterio si moltiplica producendo tossina. Raramente nelle
infezioni da ferite superficiali.
• Sono noti sette tipi di Clostridium botulinum che sono classificati con
le lettere dell’alfabeto che vanno dalla A alla G.
• Può trovarsi anche nell’intestino di animali infettati attraverso soluzioni
di continuo della mucosa orale dell’animale a causa dell’ ingestione di
foraggio contaminato
Gli alimenti epidemiologicamente più importanti sono le
conserve alimentari artigianali, carni conservate non cotte
Il batterio si moltiplica a livello intestinale e libera la tossina.
Il micro-ambiente intestinale (basso potenziale di
ossidoriduazione) permette il processo germinativo
Tossina: viene assorbita a livello intestinale (non è inattivata
dagli enzimi proteolitici) e agendo a livello della giunzione
neuromuscolare impedisce la trasmissione dell’impulso
nervoso, con conseguente paralisi flaccida
•
MANIFESTAZIONI CLINICHE
·
Il botulismo alimentare è diffuso in tutto il mondo,
maggiormente nei paesi a clima temperato e freddo.
È dovuto all’ingestione di tossina preformata presente in
cibo contaminato, ove è stata prodotta dal microrganismo
sviluppatosi in seguito alla germinazione delle spore
contaminanti.
La maggior parte dei casi è associata al consumo di cibi
inscatolati in casa.