PRINCIPI DI TOSSICOLOGIA GENERALE
La tossicologia può essere definita come quella branca delle discipline
mediche che studia la natura, gli effetti, le proprietà e le dosi delle
sostanze tossiche
E’ la disciplina che si occupa delle sostanze tossiche e delle intossicazioni
Definizione di tossico
Un tossico è una sostanza che, una volta venuta a contatto con un
sistema biologico, può causare un’alterazione omeostatica non desiderata
Intossicazione
Per “intossicazione” s’intende una malattia acuta o cronica che si produce
a seguito dell’esposizione dell’organismo ad una sostanza tossica
L’intossicazione è un fenomeno profondamente integrato tra processi
di tossificazione e detossificazione per la cui comprensione è necessario
conoscere la chimica biologica, la biologia molecolare e la medicina clinica
Intossicazione
L’elemento che differenzia l’intossicazione da patologie di altra natura
(traumatica, infettiva, degenerativa) è l’estraneità dell’agente eziologico,
intendendo come estranea una sostanza che non è normalmente presente
nel nostro organismo.
Farmaco e tossico sono entrambe sostanze estranee ma differiscono fra loro
perché mentre il tossico ha sempre effetti negativi sull’organismo, il farmaco
può evere effetti negativi in relazione alla dose.
Fattori che influenzano la risposta tossicologica
A) Fattori relativi al tossico (dose, caratteristiche molecolari, meccanismo d’azione)
B) Fattori relativi all’individuo (tossicocinetica, variazioni individuali nella sensibilità
al tossico)
C) Fattori relativi al tempo di contatto con la sostanza tossica che permettono di
distinguere la natura acuta o cronica dell’intossicazione
A) Fattori relativi al tossico
1) Dose
2) Struttura molecolare
3) Meccanismo d’azione
1) La dose DL50
Il concetto di “dose soglia” ed il riconoscimento di “dose senza effetto” furono
già enunciate da Paracelso con l’affermazione:
“Ogni sostanza è un veleno. La giusta dose differenzia un veleno da un farmaco”
Tale enunciato contiene i concetti di dose-soglia e relazione dose-effetto che
segnano la nascita della tossicologia moderna.
La dose letale 50 (DL50) rappresenta la quantità di una sostanza, per unità
di peso corporeo, capace di provocare la morte del 50% della popolazione
sperimentale in oggetto.
Il valore della DL50 è espresso in mg/Kg e sono specificate: la specie animale,
la via di somministrazione ed il tempo di osservazione sperimentale.
La DL50 è ottenuta da animali da laboratorio (topo, ratto, cavia, coniglio) ed
è una definizione tossicologica iniziale che autorizza solo tentativi di estrapolazione nell’uomo.
Classificazione delle sostanze tossiche in categorie correlate alla loro tossicità
Indice di tossicità
6
5
4
3
2
1
Terminologia di uso corrente
supertossiche
altamente tossiche
molto tossiche
moderatamente tossiche
leggermente tossiche
praticamente atossiche
Probabile dose letale
in uomo di 70 kg
<5mg/kg
5-50 mg/kg
50-500 mg/kg
0,5-5 g/kg
5-15 g/kg
>15 g/kg
Le dosi sono estrapolate da osservazioni cliniche e dai valori delle DL50
ottenute in varie specie animali
Classificazione delle sostanze tossiche in relazione al loro potenziale tossico
Livello di Tossicità
Esempio
Leggermente tossico
(5-15 g/kg)
Etanolo
8.000
Moderatamente tossico
(0,5-5 g/kg)
Cloruro di sodio
Solfato ferroso
Malathion
Metanolo
4.000
1.500
1.300
1.000
Molto tossico
(50-500 mg/kg)
Acido acetilsalicilico
Acetaminofene
Diazinone
Fenobarbitale
Imipramina
Estremamente tossico
(5-50 mg/kg)
Teofillina
Difenidramina
Super tossico
(<5 mg/kg)
Cianuro di potassio
Metotressato
Stricnina
Nicotina
Digossina
d-Tubocurarina
Tetrodossina
TCDD (diossina)
Tossina botulinica
DL50 (mg/kg)
300
300
200
150
65
50
25
3
3
2
1
0.2
0.05
0.01
0.001
0.00001
2) La struttura molecolare
La struttura molecolare può modulare la cinetica e l’attività tossica di una
sostanza.
Le caratteristiche molecolari e fisico-chimiche di una sostanza condizionano
la risposta tossicologica ed influenzano la tossicocinetica della sostanza.
Per tossicocinetica s’intende l’evolversi temporale delle concentrazioni tissutali
del tossico dovuto all’equilibrio tra cinetiche di assorbimento, distribuzione ed
eliminazione
Ad esempio il paraquat ed il diquat sono due erbicidi dipiridilici di struttura
molecolare simile ma differiscono nella loro tossicità per motivi tossicocinetici.
1) Il paraquat, una volta assorbito si accumula negli alveoli polmonari causando
una grave tossicità polmonare.
2) Il diquat è invece sprovvisto di tossicità polmonare
La configurazione elettronica iniziale è molto importante nel determinare
il grado di tossicità di una sostanza
La presenza di un numero spaiato di elettroni nell’orbita periferica di una
sostanza chimica le conferisce la caratteristica di radicale libero
Questa caratteristica si trova sia in molecole di natura organica, i chinoni,
che inorganica, i radicali liberi dell’ossigeno.
I radicali liberi hanno una grandissima capacità di combinarsi con:
1) I fosfolipidi di membrana
2) Le proteine recettoriali e/o di struttura
3) Gli acidi nucleici (DNA,RNA)
In questo modo producono una grave tossicità cellulare attraverso
svariati meccanismi (necrosi, inibizione di proteine enzimi, mutagenesi, teratogenesi, cancerogenesi).
3) Meccanismo d’azione
Meccanismo d’azione: la risposta tossicologica può essere recettoriale e non
recettoriale.
Dalla conoscenza del meccanismo d’azione del tossico dipendono:
1) La corretta interpretazione dei sintomi clinici (diagnosi)
2) L’ intervento terapeutico razionale
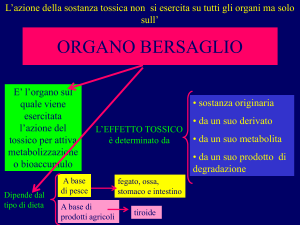
L’esposizione a dosi tossiche di una sostanza chimica
omeostatiche locali o sistemiche.
alterazioni
1) Le azioni tossiche locali sono causate dal contatto tra sostanza tossica e la cute
o le mucose e portano a necrosi locale e a fenomeni reattivi conseguenti la
necrosi
2) Le azioni tossiche sistemiche sono causate dalla diffusione del tossico
nell’organismo e si verificano quando vengono raggiunte alte concentrazioni
in alcuni organi e distretti.
Le azioni tossiche sistemiche si possono classificare in funzione dell’organo
prevalemtemente coinvolto:
Neurotossicità
Cardiotossicità
Epatotossicità
Nefrotossicità
etc.
La tossicità sistemica può essere sostenuta da meccanismi recettoriali o non
recettoriali
N.B. Il concetto di recettore in tossicologia non è limitato a quei complessi
macromolecolari che mediano gli effetti dei neurotrasmettitori, ormoni e
fattori trofici, ma è esteso ad ogni struttura molecolare capace di legare il
tossico e che, da questo suo legame, subisca un’alterazione della sua normale
funzione
Meccanismi d’azione recettoriali
Esempi di tossici recettoriali che agiscono attraverso recettori per i neurotrasmettitori sono sostanze usate sia a scopo terapeutico che voluttuario come:
1) Benzodiazepine
2) Barbiturici
3) Alcool
4) Nicotina
5) Oppiacei
Benzodiazepine, barbiturici e alcool, a dosi non appropriate, sono in grado di
provocare un’intossicazione acuta a diversi livelli di rischio con progressiva
depressione del S.N.C. fino allo stato di coma.
Queste tre sostanze causano intossicazione attraverso un meccanismo
recettoriale comune che è l’azione sul recettore GABA A.
1) In condizioni fisiologiche il GABA modula l’apertura del canale per il
cloro intrinseco al recettore
iperpolarizzazione che è
responsabile della riduzione dell’eccitabilità neuronale
2) A dosi non appropriate, benzodiazepine, barbiturici ed alcool
potenziano l’effetto neuroinibitore del GABA
coma.
La nicotina è un alcaloide i cui effetti tossici (tachicardia, ipertensione,
convulsioni) sono dovuti all’attivazione del recettore nicotinico (ACHR)
neuronale ed alle conseguenti depolarizzazioni e risposte eccitatorie.
La sindrome nicotinica del tabagismo acuto è un’intossicazione che si
verifica attraverso un meccanismo recettoriale
Gli oppiacei sono causa di una tossicità sul S.N.C. che riconosce un
meccanismo recettoriale
La morfina si lega ai recettori oppioidi e la loro eccessiva attivazione
inibisce i circuiti neuronali essenziali al mantenimento dello stato di
veglia
Il naloxone, antagonista competitivo puro, alla dose di 0.4 mg I.V.
immediata ripresa della coscienza
N.B. Benzodiazepine, barbiturici, alcool, nicotina e narcotici oppioidi, sono
esempi di sostanze che producono effetti tossici legandosi agli stessi recettori
che operano la loro azione farmacologica.
I recettori per queste sostanze sono proteine recettoriali
Gli insetticidi organofosforici riconoscono nel sito esterasico della
proteina enzima acetilcolinaesterasi, il recettore per l’effetto tossicologico
L’eccessivo accumulo di Ach a livello sinaptico è causa di una
grave intossicazione caratterizzata da una profonda distorsione
della funzione S.N.C. e periferico.
I glicosidi digitalici si legano al gruppo di isoenzimi indicati come Na+/K+ ATPasi
L’inibizione di questa attività enzimatica
accumulo intracellulare
di ioni Ca2+ e di altre cariche positive che sono responsabili dell’aumento
della forza di contrazione (inotropismo positivo) e dell’eccitabilità (effetto
batmotropo positivo)
L’intossicaziione da digitalici (tachiaritmia fino alla fibrillazione ventricolare)
può essere quindi ricondotta ad un meccanismo recettoriale
Due famiglie di ciclopeptidi tossici presenti nei funghi causa di
intossicazioni mortali, appartengono al genus amanita phalloides,
verna e virosa e riconoscono come bersaglio gli acidi nucleici.
1) Il 1° gruppo ha come capostipite l’α-amanitina che si lega all’RNA
polimerasi II che è localizzata nel nucleolo dell’epatocita a cui
segue l’inibizione della sintesi proteica.
2) Il 2° gruppo ha come capostipite la falloidina che si combina con le
molecole di actina a cui segue la lesione della membrana con rottura
dell’equilibrio dinamico tra actina filamentosa ed actina glomerulare.
La morte della cellula epatica deriva pertanto dall’insieme dei due
processi dovuti all’α-amanitina ed alla falloidina.
Meccanismo d’azione di tipo non recettoriale
I radicali liberi sono un esempio di sostanze tossiche che agiscono con
meccanismo non recettoriale
Sono molecole estremamente reattive per la presenza di un elettrone
spaiato nell’orbitale esterno
Sono responsabili della lipoperossidazione e di alterazioni aspecifiche
della permeabilità delle membrane plasmatiche; possono reagire con
le proteine denaturandole ed anche intercalarsi con gli acidi
nucleici
cancerogenesi
I radicali liberi, essendo estremamente reattivi hanno un’emivita brevissima
per cui è improbabile che siano presenti come tali in concentrazioni tossicologicamente significative tra le tossine ambientali
Esistono tossine che sono di per sé radicali liberi: di rilievo è il nitrossido,
presente nello smog e nel fumo di sigaretta
L’ozono non è di per sé un radicali libero ma è così reattivo da innescarne
la produzione nei sistemi biologici
Meccanismo d’azione recettoriale e non recettoriale
I metalli (arsenico, mercurio, etc.) riconoscono i gruppi sulfidrilici delle
proteine come recettori responsabili della loro azione tossica
I metalli riconoscono anche un meccanismo di tossicità non recettoriale,
piu’ aspecifico che riguarda:
1) L’alterazione della fluidità delle membrane cellulari
2) La modificazione della struttura degli acidi nucleici
cancerogenesi (piombo, cadmio, etc.)
B) Fattori relativi all’individuo
La risposta tossicologica può essere influenzata da molti fattori relativi
all’individuo:
1) I fattori genetici
2) La specie
3) Il sesso
4) L’età
5) Le condizioni patologiche
6) L’induzione degli enzimi microsomiali epatici
1) I fattori genetici
I livelli di espressione di alcuni degli enzimi che metabolizzano xenobiotici
e farmaci, sono sotto controllo genetico: quindi la velocità di metabolizzazione (livelli plasmatici, durata d’azione) varia tra individui che esprimono
questi enzimi in modo diverso
Esempi di alcuni enzimi:
a) Pseudocolinesterasi
b) Acetiltransferasi
c) Idrossilasi
a) Pseudocolinesterasi: è l’enzima che idrolizza la succinilcolina, curaro
depolarizzante a breve azione usato in anestesia
Pertanto la tossicità da succinilcolina (apnea da succinilcolina), dipende dal
genotipo dell’individuo in cui il codice genetico della pseudocolinesterasi
può essere rappresentato normalmente, o essere atipico o completamente
assente
b) Acetiltrasferasi epatiche e intestinali:
sono gli enzimi che coniugano i vari substrati all’acido acetico
La velocità della reazione dipende anche dai livelli di enzima che sono
variabili da individuo a individuo
Ad esempio, la tossicità dell’isoniazide, chemioterapico usato nella terapia
della tubercolosi, compare in corso di terapia cronica in individui appartenenti al genotipo “acetilatore lento”:
L’isoniazide viene insufficientemente metabolizzata e forma complessi con
la vitamina B6
neuropatia da carenza di vitamina B6
c) Idrossilasi:
Sono enzimi responsabili della idrossilazione della difenilidantoina,
farmaco impiegato nell’epilessia.
La carenza di idrossilasi è responsabile della comparsa di segni di tossicità di questo farmaco a causa del suo accumulo (atassia, nistagmo, confusione mentale)
2) La specie
La risposta tossicologica è dipendente dalla specie
Le differenze possono essere imputate, nell’ambito della stessa specie, a :
a) Motivi farmacometabolici: variazione dell’efficienza dell’eliminazione,
del legame con le proteine plasmatiche o tissutali
b) Motivi farmacodinamici: tipi di recettori espressi, diversa sensibilità
dell’organo bersaglio (narcosi da esobarbitale nel topo e nel cane)
3) Il sesso:
La risposta tossicologica è influenzata dal sesso perché gli enzimi
che metabolizzano i farmaci e gli xenobiotici sono sotto controllo
degli ormoni sessuali
a) Tossicità della morfina
ratto
: tossicità 10 volte piu’ bassa rispetto al ratto
perché
gli enzimi microsomiali epatici nel maschio inattivano la morfina
piu’ rapidamente che nelle femmine
L’estradiolo
aumenta la tossicità della morfina nei ratti
riducendo l’attività enzimatica
Il testosterone
diminuisce la tossicità della morfina nei ratti
aumentando l’attività enzimatica
b) La tossicità della stricnina: c’è una maggiore tossicità nel ratto
perché il metabolismo epatico è piu’ lento rispetto a quello
del ratto
c) La tossicità del DMP (dietil-metil-fosforotioato) che è un insetticida
organo fosforico, è 10 volte piu’ tossico nel ratto
Il DMP non è attivo come tale , ma solo dopo ossidazione da
parte degli enzimi microsomiali epatici.
Nell’uomo la differenza tra maschio e femmina riguardo agli
insulti tossici sembra essere di minore importanza rispetto ad
altre specie animali.
4) L’età
La cinetica dei farmaci e degli xenobiotici è diversa nelle varie età della vita
Le differenze possono essere a carico di qualunque fase della cinetica
a) Età neonatale
b) Età senile
a) Età neonatale:
L’assorbimento dei farmaci e degli xenobiotici è funzione del pH gastrico
e del tempo di svuotamento dello stomaco.
Poiché i valori di acidità gastrica dell’adulto si raggiungono solo a tre anni,
i farmaci e le sostanze xenobiotiche con pKa acido o alcalino sono assorbiti
diversamente nel neonato rispetto all’adulto.
Il trasporto in circolo di farmaci e xenobiotici del neonato è caratterizzato da:
1) una differenza qualitativa nell’albumina fetale che è meno capace
di legare farmaci e xenobiotici
2) dalla presenza di sostanze che competono con i farmaci e gli
xenobiotici verso i punti leganti dell’albumina
3) un pH ematico piu’ acido di quello dell’adulto
Da tutto ciò deriva che:
a) nel neonato la percentuale di farmaco o xenobiotico legata
all’albumina è minore rispetto all’adulto.
b) è maggiore la quota libera del farmaco o dello xenobiotico
che può produrre effetti tossicologici piu’ intensi nel neonato
Nell’uomo, a differenza delle comuni speci animali, il corredo enzimatico
è ben rappresentato anche nel neonato che possiede una buona capacità
inattivante
b) Età senile:
Si verifica un maggior rischio di tossicità in relazione:
1) Alla ridotta capacità di escrezione
2) Alla minore capacità di metabolizzare le sostanza xenobiotiche
da parte del fegato
infatti l’emivita di molti farmaci di comune impiego (benzodiazepine,
antibiotici aminoglicosidi, digossina, etc.) è significativamente aumentata
nell’anziano rispetto all’adulto aumentando il rischio di intossicazione.
5) Le condizioni patologiche
Il digiuno, cioè uno stato di nutrizione non adeguato, è in grado
di ridurre la capacità di detossificazione dell’organismo
Patologie che compromettono la funzionalità epatica o renale
modificano la risposta tossicologica riducendo la detossificazione
epatica e ritardando l’escrezione renale
La ridotta filtrazione glomerulare aumenta la vita media plasmatica di molti antibiotici
grave tossicità
6) L’attività degli enzimi microsomiali epatici
L’induzione (aumento della sintesi enzimatica) degli enzimi microsomiali
epatici da parte dei farmaci (fenobarbitale, etc.), diminuisce la tossicità
delle sostanze che vengono inattivate mediante ossidazione oppure aumenta
la tossicità di quelle che vengono attivate mediante ossidazione.
L’importanza degli enzimi microsomiali epatici sulla tossicità di xenobiotici
e farmaci si può verificare analizzando gli effetti collaterali dell’isoniazide
e del paracetamolo.
Isoniazide: effetti collaterali
1) Neuropatia periferica da deficienza di vitamina B6 negli acetilatori
lenti
2) Epatopatia grave negli acetilatori rapidi
Patogenesi dell’epatopatia
E’ attribuita alla acetilidralazina ed alla sua ossidazione in un composto
nucleofilo altamente reattivo capace di formare un legame covalente
con le macromolecole e quindi di produrre la lesione epatica
L’epatopatia da isoniazide riconosce 2 momenti patogenetici:
1) l’acetilazione dell’isoniazide con formazione di acetilisoniazide
acetilidralazina
2) l’ossidazione dell’acetilidralazina sotto controllo degli enzimi
microsomiali epatici
Paracetamolo
E’ il metabolita attivo della fenacetina usato come antipiretico e
analgesico che, ad alte dosi
epatite tossica
La sintomatologia iniziale (nausea, vomito e pallore) può evolvere
in un quadro di necrosi epatica e renale ingravescenti
La tossicità del paracetamolo è prodotta dal metabolita
n-acetil-p-benzochinonimina che presenta caratteristiche
strutturali di un radicale libero
Questo metabolita è citotossico sugli epatociti isolati e produce
deplezione di glutatione e lipoperossidazione delle membrane
cellulari
Interazione tra rifampicina e metadone
Nei tossicodipendenti affetti da tubercolosi, in trattamento con
metadone, la rifampicina evoca il quadro clinico della sindrome
d’astinenza da oppioidi
Infatti si verifica un aumentato metabolismo del metadone dovuto
all’induzione degli enzimi microsomiali epatici ad opera della
rifampicina
C) La risposta tossicologica
fattori relativi al tempo di contatto con la sostanza tossica
La durata del contatto con la sostanza tossica permette la
distinzione tra:
1) Intossicazione cronica: deriva da ripetute esposizioni alla
sostanza tossica per un periodo di tempo piu’ o meno
prolungato.
Tale esposizione comporta un accumulo nell’organismo
della sostanza quando la quantità assorbita supera la
capacità di detossificazione e di escrezione
2) Intossicazione acuta: deriva dall’assorbimento rapido di
dosi elevate di una sostanza tossica. Si può avere una rapida
evoluzione del quadro clinico verso l’exitus o la guarigione.
Definizione di intossicazione e tossificazione
Intossicazione: la sostanza tossica è assunta dall’esterno
in forma attiva
Tossificazione: la sostanza lesiva è generata all’interno
dell’organismo a partire da un precursore non tossico
o meno tossico
I radicali liberi sono i maggiori responsabili della tossificazione
a) Tossificazione da radicali liberi dell’O2
b) Meccanismi cellulari dell’azione tossica dei radicali liberi
lo stress ossidativo
la perossidazione dei lipidi
la deplezione delle tiolo proteine
l’alterazione dell’omeostasi del calcio
c) Detossificazione
detossificazione delle sostanze xenobiotiche
detossificazione dei radicali liberi
a) Tossificazione da radicali liberi dell’O2
Il citocromo P-450 e la formazione di radicali liberi
Il sistema delle monoossigenasi citocromo P-450 dipendenti, è responsabile
della ossidazione di substrati esogeni ed endogeni (farmaci, ac. grassi,
steroidi, etc.) e della riduzione di pochi composti
Il citocromo P-450, in presenza di certi substrati, porta ad una parziale
riduzione dell’ossigeno molecolare e alla formazione di anione superossido
(O2-) e di perossido di idrogeno (H2O2)
O2 + e-
O 2 - + H 2 O2
anione superossido
A sua volta, l’H2O2, può reagire con l’O2- (reazione di Haber-Weiss)
e produrre il radicale idrossilico (OH-), o può reagire con il Fe++
(reazione di Fenton) e produrre l’OHReazione di Haber-Weiss
H2 O2
+
O2-
CuFe
OH- +
O2
radicale idrossilico
Reazione di Fenton
H2 O2
+
Fe+2
Fe+3
(Cu+)
(Cu++)
+
OH-
radicale idrossilico
La generazione a cascata dei radicali liberi dell’O2, avviene in moltissimi
casi di tossificazione. L’O2 si produce:
a) quando i composti reagiscono spontaneamente con l’O2 autoossidandosi
(catecolamine)
b) per intervento di alcuni sistemi enzimatici (xantino-ossidasi, aldeidossidasi)
c) quando la radiazione ionizzante attraversa una soluzione acquosa contenente
O2
d) durante l’attivazione della fagocitosi dei granulociti come mezzo battericida
L’H2O2 si produce sempre in concomitanza alla generazione di O2 a causa
della reazione di dismutazione mediata dalla (SOD) superossidodismutasi
Il radicale OH- si produce nella reazione di Haber-Weiss e nella reazione di
Fenton
Tra le forme dell’ossigeno i radicali idrossilici sono la specie piu’ tossica
perché altamente reattiva e priva di ogni meccanismo di inattivazione
endogena
Altri radicali liberi possono essere generati nel metabolismo intermedio
di xenobiotici e farmaci
1) Il radicale triclorometile (epatotossico) deriva dalla dealogenzione del
CCl4 catalizzata dal citocromo P-450
2) L’ossidazione del paracetamolo genera un radicale semichinonico ed il
perossido di idrogeno e successivamente l’anione superossido
3) Dal metabolismo del bromobenzene si forma un epossido reattivo che
viene convertito in un composto inerte dall’epossido idrolasi. Tuttavia,
ogni molecola non convertita forma addotti con il glutatione o con le
macromolecole tissutali
Oltre al sistema delle ossidasi a funzione mista, ci sono altri enzimi
importanti nella tossificazione degli xenobiotici
1) L’alcool deidrogenasi metabolizza l’alcool allilico ad acroleina, una
epatotossina che determina necrosi periportale
2) La tossicità della neurotossina MPTP (Metil-Feniltetraido-Piridina)
dipende dalla sua ossidazione a MPP+ (Metil-Fenil-Piridina) da parte
delle monoaminossidasi di tipo B (MAO B)
B) Meccanismi cellulari dell’azione tossica dei radicali liberi
B1) Lo stress ossidativo
B2) Perossidazione dei lipidi
B3) Deplezione delle tiolo proteine
B4) Alterazione dell’omeostasi del calcio
I radicali liberi sono un rischio di tossificazione difficilmente valutabile perché
in grado di reagire virtualmente con ogni componente cellulare causando
variazioni metaboliche e strutturali che provocano la morte della cellula
Gli effetti dannosi degli xenobiotici sono in relazione alla loro capacità di
legarsi irreversibilmente ai siti nucleofili delle macromolecole cellulari
come i gruppi sulfidrilici delle proteine
Le proteine in seguito ad arilazione o alchilazione
morte cellulare
B1) Lo stress ossidativo
Lo stress ossidativo si verifica in ogni situazione in cui si ha accumulo
di forme di O2 parzialmente ridotte o dei loro equivalenti idroperossidi
organici.
Quando la velocità di produzione del superossido supera la capacità
dei sistemi di difesa, il superossido reagisce con i materiali biologici
alterando il DNA, denaturando gli enzimi e le proteine recettoriali,
producendo la lipoperossidazione dei lipidi delle membrane cellulari.
(Stress ossidativo)
E’ stato proposto che il radicale idrossilico OH- sia la tossina definitiva
generata durante lo stress ossidativo
Il danno cellulare si ritiene dovuto soprattutto alla:
1) perossidazione dei lipidi di membrana
2) deplezione delle tiolo-proteine
3) variazione dell’omeostasi intracellulare del calcio
B2) Perossidazione dei lipidi
Comprende una complessa serie di eventi attraverso i quali le catene
di acidi grassi dei fosfolipidi di membrana sono convertiti in una serie
di prodotti di frammentazione
L’evento iniziale consiste nell’estrazione di un atomo di idrogeno da
un acido grasso insaturo da parte di radicali centrati su carbonio, zolfo,
azoto, ossigeno
(Perossidazione dei lipidi)
La propagazione dell’evento si attua attraverso la produzione di un
radicale lipoperossido che a sua volta continua il processo estraendo
un secondo idrogeno da un lipide adiacente intatto
nuovo lipoperossido e così via.
Dal processo si generano acidi grassi a basso peso molecolare, come
alcheni, alcani e chetoni e come la malonildialdeide che viene utilizzata
per il monitoraggio del processo.
(Perossidazione dei lipidi)
Risoluzione della perossidazione lipidica
Il fenomeno si arresta quando due radicali reagiscono fra loro a produrre
un non-radicale
La lipoperossidazione
perdita della integrità strutturale e funzionale
della membrana (attività enzimatica)
B3) Deplezione delle tiolo proteine
Gli xenobiotici attivati provocano una deplezione delle tiolo-proteine
Queste proteine hanno un ruolo importante nella regolazione delle
attività enzimatiche cellulari
La loro deplezione
e morte cellulare
alterazione della funzionalità enzimatica
B4) Alterazione dell’omeostasi del calcio
E’ stato dimostrato che lo stress ossidativo è accompagnato da
un aumento della concentrazione di Ca+2 dovuto:
1) a rilascio dello ione dai depositi intracellulari
2) ad influsso attraverso la membrana plasmatica
Tale aumento attiva vari enzimi degradanti calcio-dipendenti
(fosfo-lipasi, proteasi, nucleasi) ed è responsabile di alterazioni
del citoscheletro
vacuolizzazione e necrosi cellulare.
Omeostasi del calcio
Durante lo stress ossidativo l’attività di pompe e trasportatori del Ca+2
è ridotta, forse per deplezione dei gruppi SH
perdita della loro
funzione
La somministrazione di tioli previene infatti tale fenomeno
c) Detossificazione
La detossificazione esprime il concetto di difesa endogena verso
la tossificazione dovuta sia a xenobiotici che a farmaci
c1) Detossificazione delle sostanze xenobiotiche
c2) Detossificazione dei radicali liberi
c1) Detossificazione delle sostanze xenobiotiche
La metabolizzazione di uno xenobiotico avviene in 2 fasi:
1) Enzimi della fase I
2) Enzimi della fase II
1) Gli enzimi della fase I producono una biotrasformazione,
alterando la fisionomia chimico-fisica del composto attraverso l’aggiunta o l’eliminazione di gruppi funzionali
(funzionalizzazione), in modo che il metabolita sia piu’ idoneo
a reagire con gli enzimi di coniugazione della fase II
Reazione di fase I
Molti xenobiotici di interesse tossicologico sono composti lipofili,
assorbiti dal tratto gastroenterico, dal tratto respiratorio e dalla
cute che tendono a depositarsi nei tessuti, specialmente ricchi di
lipidi
Le principali reazioni di fase I sono:
1) Ossidazione
2) Riduzione
3) Idrolisi
4) Idratazione
2) Gli enzimi della fase II catalizzano reazioni biosintetiche che richiedono
energia per essere espletate e sono situati nel citoplasma
Queste reazioni convertono sostanze esogene o endogene in composti di
PM piu’ elevato, provvisti di gruppi idrofili e piu’ facilmente eliminabili
con le urine, la bile ed altri meccanismi.
Composti endogeni usati per le reazioni di coniugazione sono:
1) l’acido glicuronico
2) i solfati
3) gli aminoacidi
4) i gruppi acetili
5) il glutatione
Il glutatione ridotto (GSH) ha un ruolo di primaria importanza
nella detossificazione
E’ un tripeptide endogeno presente nel citoplasma e nei mitocondri
(concentrazioni millimolari) composto da 3 AA:
1) acido glutammico
2) cisteina
3) glicina
GSH
Il GSH intracellulare interviene nella neutralizzazione di composti di origine
endogena ed esogena in reazioni catalizzate dalla GSH-S-transferasi
coniugati corrispondenti
La GSH-S-transferasi catalizza la reazione del sulfidrile nucleofilo del glutatione
con il composto contenente un atomo di carbonio elettrofilo
La GSH-S-transferasi è ubiquitaria con massima attività nel fegato, rene, surrene,
intestino e testicoli
GSH-S-transferasi
Nell’uomo sono state trovate 5 diverse classi di GSH-S-transferasi con
specificità sovrapponibile per i substrati elettrofili ed elevata specificità
per il GSH
4 classi di GSH-S-transferasi sono localizzate nel citosol
La GSH-S-transferasi microsomiale si trova nelle membrane del reticolo
endoplasmatico ed in altri organuli cellulari e la sua specificità per i
substrati si distingue da quella degli enzimi citosolici
Le GSH-S-transferasi microsomiali sono inducibili e molto importanti
per la disintossicazione
Le GSH-S-transferasi citosoliche non sono inducibili
GSH
I coniugati vengono traspostati fuori dalla cellula e diventano substrati
delle gamma-glutamil-transpeptidasi (GGTP) che sono sulla porzione
esterna della membrana cellulare e che distaccano l’acido glutammico
Si forma così un dipeptide legato alla sostanza xenobiotica che ritorna
nella cellula legata alla cisteina
Nella cellula la sostanza viene acetilata (sintesi mercapturica) e
definitivamente allontanata dall’organismo per l’ultima escrezione con
le feci e le urine
Attraverso l’azione della GSH-S-trasferasi, il GSH interviene nella
neutralizzazione di composti elettrofilici generati dal metabolismo
di sostanze a larga diffusione (idrocarburi alogenati, paraquat,
paracetamolo, morfina) che, a dosi non tossiche, producono una
quantità di metabolita che può essere detossificata dal sistema
GSH
addotti inerti
Quando la dose dei suddetti campioni è elevata, o quando c’è una
forte induzione delle monoossigenasi epatiche, il GSH si consuma
ed il metabolita non piu’ sufficientemente neutralizzato, è libero di
compiere l’arilazione delle proteine cellulari
effetti citotossci
Altri sistemi enzimatici che operano “sintesi protettive”:
1) la glicuronil transferasi che catalizza le reazioni di glucuronoconiugazione legando l’acido glicuronico a gruppi funzionali
di solito alcoolici o carbossilici
2) la metil-transferasi che opera la metilazione
3) gli enzimi coniuganti la glicina, la glutammina e la taurina con
la formazione di peptidi
4) le solfo e acetil transferasi: generano rispettivamente solfati e
composti acetilati
5) la rodanasi: detossifica il cianuro catalizzando la sintesi di tiocianati
a partire dal tiosolfato
c2) Detossificazione dei radicali liberi
I sistemi enzimatici
Gli effetti biologici dei radicali liberi sono controllati da un
vasto schieramento di meccanismi biologici di difesa di tipo
enzimatico e non enzimatico
Le cellule eucariote hanno due distinte superossido-dismutasi
(SOD):
1) una contenente zinco e rame situata nel citoplasma
2) una contenente manganese situata nei mitocondri
Questi enzimi neutralizzano l’anione superossido (O2-) operando la
dismutazione di 2 molecole di superossido con la formazione di
perossido di idrogeno e una molecola di ossigeno
2O2- + 2H+
SOD
H2 O2
+
O2
Il perossido di idrogeno (H2O2) è successivamente detossificato, per
intervento della catalasi e della glutatione prossidasi, ad H2O
La catalasi è un’emoproteina localizzata nei perossisomi che riduce il perossido di
idrogeno senza una formazione intermedia di radicali idrossilici
La glutatione perossidasi, enzima selenio-dipendente citoplasmatico e mitocondriale,
è in grado di ossidare 2 molecole di glutatione ridotto
1 molecola di
glutatione disolfuro (GSSG), riducendo nel contempo e neutralizzando il perossido
di idrogeno
Il GSSG è in seguito ridotto a GSH dalla glutatione-reduttasi NADPH dipendente
Gli scavenger non enzimatici
I sistemi non enzimatici di difesa sono sostanze dotate di attività
neutralizzante (scavenger) i radicali liberi per la loro attività
antiossidante:
1) L’a-tocoferolo
2) L’acido ascorbico
3) Il glutatione
4) Il beta-carotene
Le sostanze che si coniugano con il glutatione sono:
1) Epossidi
2) Alo-alcani
3) Nitro-alcani
4) Alcheni
5) Composti alo-aromatici
6) Composti nitro-aromatici
Gli agenti antiossidanti inibiscono la formazione delle specie ridotte
dell’ossigeno con svariati meccanismi:
a) bloccando l’attivazione dei fagociti
b) chelando i metalli di transizione e prevenendo così la formazione di
radicali idrossilici e la decomposizione degli idroperossidi lipidici
c) riparando il danno cellulare terminando quindi la catena di reazioni
della perossidazione lipidica
L’a-tocoferolo
E’ il sistema antiossidante piu’ importante per porre fine alla catena
di reazioni di lipoperossidazione
Nella sua struttura è presente un gruppo OH- il cui atomo di idrogeno
è molto facilmente rimovibile
In presenza dell’a-tocoferolo, i radicali che si generano durante la
lipoperossidazione si combinano con l’a-tocoferolo piuttosto che
con gli altri acidi grassi
Questo fenomeno termina la catena delle reazioni in quanto il radicale
libero del tocoferolo che ne risulta è incapace di attaccare le catene
degli acidi grassi adiacenti
Il glutatione e la vitamina C intervengono donando atomi di idrogeno
ai radicali lipidici e/o perossilici prevenendo così l’ulteriore processo di
lipoperossidazione
Il mannitolo è un’altra sostanza ad azione scavenger che è in grado di
chelare lo ione ferrico che è necessario alla formazione dei radicali
idrossilici e di rimuoverli direttamente ogni volta che si formano.
In conclusione
La definizione della tossicità di una sostanza risulta da una somma
di informazioni che riguardano il suo profilo tossicologico integrato
Numerose sono le variabili capaci di modificare la reattività farmaco-tossicologica per cui valutare l’effetto tossico di una sostanza
nell’uomo partendo da dati sperimentali tossicologici può essere
difficile e rischioso
Da qui deriva la necessità di estrapolare dai dati sperimentali il livello
o il tipo di tossicità nell’uomo
Sui dati estrapolati, si basano le autorità sanitarie per fissare i limiti
d’accettazione dell’esposizione ad un tossico nella popolazione