LE PROTEINE
Le proteine o protidi sono, dopo l'acqua, il secondo componente del
corpo umano, dal momento che ne costituiscono circa il 16%. Esse
innanzitutto entrano nella costituzione dei vari tessuti, ma esplicano
anche svariate funzioni fisiologiche fondamentali. Il nostro organismo
costruisce le proprie proteine utilizzando quelle di origine animale e
vegetale presenti negli alimenti. La componente proteica della nostra
dieta ha quindi una funzione essenzialmente plastica.
ASPETTO CHIMICO E FISICO
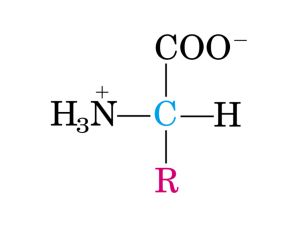
Le proteine sono costituite da catene di a-amminoacidi, tutti appartenenti alla serie L,
in quanto la configurazione dell'atomo di carbonio, al quale sono legati 1'aamminogruppo ed il carbossile, va posta in relazione a quella della L-gliceraldeide. Gli
amminoacidi si differenziano fra loro per la struttura della catena laterale R, che può
essere, ad esempio, un atomo di idrogeno, una catena alifatica, un anello aromatico,
un anello eterociclico. In soluzione acquosa essi possono comportarsi, a seconda del
pH della soluzione, sia da acidi che da basi, ossia hanno un comportamento
ANFOTERO. Per ciascun amminoacido in soluzione esiste un valore di pH, detto
punto isoelettrico, al quale esso si trova soltanto nella forma dipolare, ossia quella con
carica complessiva nulla.
a-AMINOACIDO
Struttura ionica
dipolare
Nella molecola proteica gli amminoacidi sono uniti fra loro da un legame, legame
peptidico, che coinvolge il gruppo amminico o carbossilico di ogni amminoacido
col gruppo carbossilico o amminico dell'amminoacido adiacente. Gli
amminoacidi che partecipano alla formazione delle molecole proteiche sono una
ventina. Tale numero può dar luogo a molte sequenze di amminoacidi, considerando
che la molecola proteica è formata da alcune centinaia di amminoacidi. Le catene
formate da alcune decine di amminoacidi si chiamano peptidi e più precisamente
oligopeptidi, se comprendono non più di 10 amminoacidi e polipeptidi, se gli
amminoacidi sono più di 10 e meno di 50. Nelle proteine gli amminoacidi sono più
di 50, generalmente sono compresi fra 200 e 300, ma possono arrivare anche a 500.
Il legame
peptidico
Le proteine hanno proprietà caratteristiche e specifiche, ma contemporaneamente
presentano le proprietà comuni ai polimeri ad alto peso molecolare; le loro
proprietà anfotere dipendono dai gruppi ionizzabili che non partecipano ai legami
peptidici. La differente composizione in amminoacidi determina una diversa e
specifica carica elettrica complessiva in ogni molecola proteica e un
caratteristico punto isoelettrico, ossia un valore di pH del mezzo al quale
corrisponde, nella proteina, un numero uguale di gruppi acidi e gruppi basici
dissociati. Quindi a tale pH essa ha carica elettrica complessiva nulla e in genere
la sua solubilità è minima.
ELETTROFORESI
L'esistenza di una carica elettrica complessiva nelle proteine può essere sfruttata per
la loro analisi. Ad esempio, con i metodi elettroforetici si separano le proteine
ponendole in un campo elettrico. Al punto isoelettrico una proteina presenta una
mobilità elettroforetica nulla, ma ad un altro pH essa è trascinata verso un elettrodo
dalla sua carica e la sua velocità di migrazione dipende, oltre che naturalmente dalla
forza del campo, dalla carica complessiva e dall'interazione col mezzo circostante
(attrito o resistenza) che a sua volta dipende dalla massa molecolare della proteina.
L'elettroforesi può essere condotta anche in modo da separare le proteine in base
essenzialmente alla loro massa. In questo caso si tratta la miscela proteica con
composti, che formano con la proteina denaturata complessi aventi una carica
proporzionale alla sua massa e tale da rendere trascurabile la sua carica originaria. In
questo modo più piccola è la proteina e maggiore sarà la sua velocità di migrazione.
Le proteine precipitano generalmente in ambiente acido e il pH a cui questo
avviene è specifico per ogni proteina.
Elettroforesi su carta
L'elettroforesi è una tecnica di separazione che si basa sulla diversa mobilità di
ioni (molecole che possiedono cariche) in un substrato sottoposto ad un campo
elettrico. Gli ioni si muovono più o meno rapidamente lungo il substrato in funzione della
loro carica, dimensione, forma. A seconda della tecnica usata, la strumentazione
consiste in due vaschette contenenti un elettrolita, un supporto (es: carta da filtro,
striscia di acetato di cellulosa, gel di poliacrilamide, gel di agarosio, un tubo capillare),
un alimentatore elettrico in CC e due elettrodi. L'elettroforesi viene ampiamente
utilizzata per separare sostanze quali ad esempio amminoacidi, proteine, spezzoni di
DNA, etc. Come nel caso della cromatografia, anche in questa tecnica si utilizzano
substrati e solventi diversi a seconda delle sostanze da separare e delle tecniche
seguite.
Esempio: disponete due piccole bacinelle alla distanza di alcuni centimetri. Nelle
bacinelle inserite l'elettrolita formato da una soluzione di 1 cucchiaino di sale e un
quarto di cucchiaino di bicarbonato di sodio in 300 ml di acqua di rubinetto. Fra le
bacinelle ponete un supporto formato da una lastrina di vetro.
Su questo supporto si dispone una striscia di carta da filtro bagnata con la soluzione
elettrolitica. Questa striscia di carta deve pescare ai due capi nell'elettrolita delle due
bacinelle per realizzare la continuità elettrica del circuito. Con una matita, si segna
sulla carta da filtro una linea trasversale e su questa linea si dispone una goccia di
sangue. Si copre la carta con una seconda lastrina di vetro. Si inseriscono i due
elettrodi nelle bacinelle e si applica una tensione di 45 V in corrente continua (da 4 a 8
Volt per cm). Questa tensione può essere ricavata da 5 batterie da 9V collegate in serie.
Con lo scorrere del tempo, si dovrebbero vedere 5 macchiette muoversi verso
l'elettrodo negativo. In queste macchiette vi sono differenti componenti proteiche del
plasma (globuline alfa, beta, gamma, albumina e fibrinogeno). In realtà, per rendere
meglio visibili queste sostanze occorre utilizzare un colorante, come il blu di
bromofenolo.
IDROLIZZATI PROTEICI
Per idrolizzare una proteina occorre trattarla in ambiente acido o basico
e/o a temperature elevate e per tempi prolungati. L'industria alimentare
commercializza i cosiddetti "idrolizzati proteici", miscele di peptidi
ottenuti per idrolisi acida della componente proteica di sostanze
generalmente di origine vegetale. Idrolizzati di proteine di origine
animale, ottenuti per via enzimatica, sono invece utilizzati per
l'alimentazione di neonati con allergia al latte vaccino.
LA STRUTTURA DELLE PROTEINE
La successione degli amminoacidi nella catena proteica, la planarità del
legame peptidico, la possibilità di formare legami idrogeno e le forze di
attrazione e repulsione derivanti dalle caratteristiche strutture delle catene laterali
dei diversi amminoacidi, concorrono alle varie e complesse conformazioni delle
molecole proteiche. È così possibile individuare in tali molecole fino a quattro tipi
di struttura. Infatti le diverse sequenze degli amminoacidi nella catena
polipeptidica determinano la struttura primaria. Si parla poi di struttura
secondaria quando la planarità dei legami peptidici e i legami idrogeno fra catene
adiacenti fanno assumere alla molecola proteica conformazioni spaziali
geometricamente ben definite (ad elica, a foglietto ripiegato, ecc.). La presenza di
legami disolfuro, caratteristici della cistina, di legami ionici, dovuti a gruppi
amminici e carbossilici non impegnati nel legame peptidico e di interazioni
idrofobiche, contribuisce ad una sistemazione complessiva nello spazio dell'intera
molecola proteica che determina la sua struttura terziaria. Infine l'associazione di
più catene peptidiche attraverso legami di natura non covalente, o mediante ponti
disolfuro, determina la struttura quaternaria.
LA STRUTTURA PRIMARIA
Essa è data dalla sequenza
degli
amminoacidi
che
costituiscono
una
catena
peptidica.
Ogni
proteina
possiede
una
specifica
composizione in amminoacidi
(tante unità di ciascun tipo),
ma soprattutto un ben preciso
ordine con cui questi si
susseguono, da un'estremità
all'altra, lungo la catena:
quest'ultima caratteristica è
specifica per ogni proteina e
costituisce, per così dire, la sua
«carta di identità».
Cambiamenti anche minimi (per esempio, un amminoacido sostituito) nella
struttura primaria si possono ripercuotere sulle ulteriori strutture e sulle
funzionalità biologiche della proteina stessa determinando, se questa è preposta a
svolgere compiti di vitale importanza, gravi conseguenze. Un classico esempio è
quello dell'HbS, emoglobina anomala responsabile dell'anemia falciforme, diversa
dall'HbA, normale, a causa delle sostituzioni, nelle catene 3, della valina in
posizione 6 con l'acido glutammico.
La struttura primaria è determinata geneticamente: le sequenze amminoacidiche di
tutte le proteine di un individuo si trovano già depositate, in codice, in altrettanti
tratti del suo DNA chiamati geni.
LA STRUTTURA SECONDARIA
Essa è data da conformazioni spaziali periodiche e regolari più o meno estese che
la catena peptídica può assumere. Ciò avviene quando i piani su cui giacciono i
legami peptidici si susseguono secondo precise angolazioni. Essa si può
considerare la disposizione spaziale degli atomi dello scheletro del polipeptide,
senza considerare le catene laterali.
Le principali strutture secondarie sono:
- 1'a-elica;
- il foglietto b;
- le ripiegature b o b-turn;
- l'ansa w oppure «w-loop»;
- l'elica del collagene.
a-elica
I piani dei legami peptidici sono piegati
secondo angoli di 80° e si avvolgono in
senso destrogiro attorno a un asse ideale.
Ogni spira contiene 3,6 residui di
amminoacidi, il passo dell'elica è 0,54 nm
e i gruppi R sono diretti verso l'esterno.
L'a-elica è stabilizzata da legami H che si
instaurano tra l'ossigeno del gruppo -COdi un amminoacido e l'idrogeno del
gruppo
-NHdell'amminoacido
sottostante (4 aa più avanti). Ogni 5 giri
(18 aa) si trovano amminoacidi in
posizione corrispondente.
FOGLIETTO b O STRUTTURA A PIEGHE
La catena polipeptidica, in questo tipo di
struttura, è molto più distesa: gli angoli fra i
piani di legame sono di 120°. I piani si
susseguono formando un foglio pieghettato.
Gli
R
sporgono
dagli
spigoli
alternativamente al di sopra e al di sotto del
«foglio». Nella struttura b due o più catene
polipeptidiche o altrettanti tratti di una stessa
catena vengono a trovarsi di fianco. La
stabilizzazione è affidata a ponti di H che si
instaurano tra i -CO- di una catena e gli NH- di quella adiacente. Le catene possono
decorrere in senso parallelo o antiparallelo;
in questo secondo caso, i legami a H sono
più forti perché i gruppi -CO- e -NH- si
fronteggiano. Le regioni a foglio pieghettato
sono abbastanza frequenti nelle proteine. La
fibroina della seta è costituita da più fogli di
catene antiparallele sovrapposti.
LA STRUTTURA TERZIARIA
I DIVERSI TIPI DI PROTEINE
Le diverse strutture consentono di classificare le proteine in GLOBULARI e
FIBROSE. In queste ultime il rapporto lunghezza/ampiezza è superiore a 10.
Tipici esempi di proteine globulari sono gli enzimi, mentre un importante esempio di
proteina fibrosa è rappresentato dal collagene, formato da tre catene polipeptidiche
intrecciate fra loro.
Le proteine si possono distinguere in SEMPLICI, quando sono costituite unicamente
da amminoacidi e in CONIUGATE, quando c'è una parte proteica unita ad un'altra
frazione, che ne costituisce il gruppo prostetico.
Una classificazione delle proteine semplici può essere fatta in base ad alcune
loro proprietà fisiche e chimiche:
- albumine, solubili in acqua e in soluzioni saline diluite, coagulano col
calore; sono di origine animale e vegetale (ad esempio la lattoalbumina del
latte e la ovoalbumina dell'uovo)
-globuline, insolubili in acqua e solubili in soluzioni saline diluite, sono di origine
animale e vegetale (ad esempio le immunoglobuline e numerose proteine di riserva dei
legumi);
-gluteline, insolubili in acqua e nelle soluzioni saline, solubili in alcoli e in acidi
diluiti, sono di origine vegetale (ad esempio la glutenina del frumento e l'orizanina del
riso);
-prolammine, solubili in soluzioni etanoliche (60-70%), ma insolubili in acqua e in
etanolo puro; contengono poca lisina e sono di origine vegetale (ad esempio la
gliadina del frumento e la zeina del mais);
-protammine e istoni, sono molto simili tra loro, sono solubili in acqua e contengono
un'alta percentuale di amminoacidi basici; le prime non coagulano col calore e sono
poco frequenti negli alimenti; i secondi coagulano col calore (ad esempio la globina,
che rientra nella costituzione dell'emoglobina);
-scleroproteine, sono insolubili in acqua, in soluzioni saline, in acidi e in alcali,
sono fibrose, a differenza delle precedenti che invece sono tutte globulari (ad esempio
il collagene che, per bollitura prolungata in acqua e lasciato raffreddare, diventa
gelatina e le cheratine, presenti nei peli, nelle unghie e nella pelle).
Sono proteine coniugate le cromoproteine, aventi come gruppo prostetico una
metalloporfirina. Appartengono a questa categoria, ad esempio, la clorofilla e
l'emoglobina. Quest'ultima è una proteina globulare in cui la parte proteica è la
globina e il gruppo prostetico è l'eme che, a sua volta, è formato dal sistema
eterociclico porfirinico con uno ione ferroso chelato al centro. Altre categorie
di proteine coniugate sono le nucleoproteine, le lipoproteine e le glicoproteine
o mucoproteine, contenenti rispettivamente acidi nucleici, lipidi e glucidi.
Infine appartengono alle proteine coniugate anche quegli enzimi che, oltre alla
parte proteica (apoenzima), hanno una frazione non proteica detta coenzima.
LA DENATURAZIONE DELLE PROTEINE
La denaturazione di una proteina avviene quando questa perde un qualsiasi
particolare strutturale, a parte la struttura primaria. Ciò avviene quando nella struttura
proteica viene modificato quell'equilibrio fra forze attrattive e repulsive costituite dai
legami idrogeno e dagli altri legami secondari. La denaturazione può essere
provocata termicamente: è tipica quella dell'albume durante la cottura. Si può avere
denaturazione anche variando il pH dell'ambiente, come avviene quando nel latte
inacidito, per formazione di acido lattico, precipitano, o coagulano, alcune proteine che
si trovavano in soluzione. Tale fenomeno, se è stato di modesta entità, può essere
reversibile. In tal caso, ritornando nelle condizioni iniziali, la proteina può riassumere
le sue caratteristiche strutturali. La coagulazione delle proteine del latte acidificato e
quelle dell'albume cotto sono invece esempi tipici di una denaturazione irreversibile.
Anche nel latte bollito la componente proteica viene denaturata in modo irreversibile.
La maggiore esposizione di gruppi solfidrilici, dovuta ad uno spiegamento della
molecola proteica e ad uno svolgimento delle sue catene polipeptidiche, contribuisce a
conferire il caratteristico sapore al latte sottoposto a bollitura.
Una proteina denaturata perde parzialmente o totalmente le sue proprietà
biologiche, come avviene per un enzima sottoposto a temperature di 60-70 °C. Se si
considera invece una proteina dal punto di vista alimentare, la sua denaturazione può
comportare una modificazione della sua digeribilità. In generale una leggera
denaturazione può essere positiva perché rende le proteine più facilmente
attaccabili dagli enzimi proteolitici. In altri casi, come per la carne, la
denaturazione termica può rendere più difficile l'attacco da parte degli enzimi
proteolitici del tratto gastro-intestinale.
Gli amminoacidi presenti nella struttura proteica
Gli amminoacidi presenti nelle proteine sono tutti otticamente attivi, ad
eccezione della glicina che è priva di centri chirali e quindi non si presenta nei due
enantiomeri.
Le molecole dei venti amminoacidi, che comunemente danno luogo alle catene
proteiche, sono molto differenti fra loro e la diversità riguarda, come si è detto,
essenzialmente la natura della catena laterale (R). Tuttavia alcune analogie strutturali
consentono la seguente classificazione:
a) amminoacidi alifatici monoammino-monocarbossilici, comprendenti gli
cina, alanina, leucina, isoleucina e valina;
b) amminoacidi monoammino-dicarbossilici e le relative ammidi, compren
denti acido aspartico, acido glutammico, asparagina e glutammina;
TIROSINA (Tyr, Y)
c) amminoacidi diammino-monocarbossilici, comprendenti arginina e lisina;
d) idrossiamminoacidi monoammino-monocarbossilici comprendenti serina e
treonina;
e) amminoacidi solforati, comprendenti cisteina e metionina;
f) amminoacidi aromatici, comprendenti fenilalanina e tirosina;
g) amminoacidi eterociclici, comprendenti triptofano e istidina;
h) imminoacidi rappresentati esclusivamente dalla prolina.
Nella struttura proteica si possono trovare altri amminoacidi che derivano dai venti
sopraelencati, come la cistina, costituita da due molecole di cisteina e
l'idrossiprolina (un amminoacido contenuto nel collagene).
Tutti gli amminoacidi che partecipano alla formazione delle proteine hanno la
struttura riferibile a quella classica ad eccezione della prolina e dell'idrossiprolina.
Classica struttura
aminoacidica
ASPETTO BIOLOGICO NUTRIZIONALE
Le proteine, oltre a costituire gran parte dei tessuti corporei, esplicano numerose
funzioni indispensabili per il normale funzionamento dell'organismo:
- entrano in strutture enzimatiche ed ormonali, concorrendo così alla
regolazione dei vari processi metabolici;
- intervengono nella coagulazione del sangue, in quanto alcuni fattori che
concorrono a tale processo sono di natura proteica;
- proteggono l'organismo da infezioni: infatti gli anticorpi sono di natura
proteica e pare che una dieta povera di proteine aumenti la possibilità di
contrarre infezioni, poiché l'organismo non produce una quantità sufficiente di
anticorpi;
- neutralizzano sostanze tossiche, entrando nella composizione di sistemi
enzimatici detossificanti;
- sono fondamentali per il trasporto di molecole nei fluidi organici e
attraverso le membrane biologiche (carrier).
Inoltre, ai cosiddetti "peptidi funzionali", derivati da proteine alimentari e assorbiti
come tali, si attribuiscono diverse attività benefiche per l'organismo. Ad esempio, si
ritiene che i peptidi presenti nel latte, soprattutto quando è fermentato, possano
influire positivamente sui sistemi digestivo e cardiovascolare ed aumentare le
difese immunitarie dell'organismo.
Come si è detto, tutti gli amminoacidi presenti nelle proteine sono nella forma
enantiomerica L. Solo eccezionalmente è possibile trovare in materiale biologico
amminoacidi liberi nella forma enantiomerica D. Ad esempio, la presenza di batteri
può comportare in alcuni alimenti, come i prodotti lattiero-caseari, la presenza di Damminoacidi liberi. Anche i trattamenti, cui sono sottoposti gli alimenti, possono
causare la racemizzazione degli amminoacidi proteici.
Aminoacidi e loro ruoli nell’organismo
Gli amminoacidi sono precursori di sostanze di notevole importanza biologica. Ad
esempio la lisina è impiegata dall'organismo per la sintesi della carnitina, a sua
volta necessaria per l'utilizzazione dei grassi ai fini energetici; il triptofano è il
precursore metabolico della niacina, una vitamina del gruppo B. Triptofano e
fenilalanina sono precursori di importanti neurotrasmettitori, quali la serotonina,
l'adrenalina, ecc. Gli amminoacidi solforati sono i precursori del glutatione, che
difende le cellule dai processi ossidativi.
Inoltre nell'organismo sono presenti amminoacidi che, pur non rientrando nella
struttura proteica, esplicano importanti funzioni, come la citrullina e l' ornitina,
metaboliti intermedi del ciclo dell'urea; l'acido g-amminobutirrico (GABA), che è
un neurotrasmettitore; la b-alanina, che è inserita nell'acido pantotenico, un'altra
vitamina del gruppo B; la taurina, che interviene nello sviluppo del sistema nervoso,
nella stabilizzazione delle membrane cellulari, nella detossicazione e
nell'osmoregolazione.
GLI ALLERGENI
Le proteine alimentari garantiscono all'organismo l'apporto necessario di
amminoacidi. Dal punto di vista nutritivo sono particolarmente importanti le masse
muscolari, presenti nelle carni e nel pesce, che contengono circa il 40% di actina e
di miosina, e le proteine presenti nel latte, nell'uovo, nei cereali e nei legumi.
Negli alimenti vi possono essere però anche proteine nocive per il nostro organismo.
Ad esempio possono rappresentare allergeni per alcuni individui: è il caso delle
proteine del latte vaccino e dell'uovo; oppure possono costituire vere e proprie
tossine presenti nelle piante, nei funghi e negli organismi animali, oppure prodotte da
microrganismi.
LA DIGESTIONE DELLE PROTEINE
Le proteine, una volta ingerite sono idrolizzate con l'intervento di enzimi
proteolitici, che consentono la liberazione, in condizioni fisiologiche, di di- e
tripeptidi e soprattutto di amminoacidi che vengono così assorbiti. La digestione
inizia nello STOMACO ad opera della pepsina, prosegue nel DUODENO per
azione delle peptidasi pancreatiche e si conclude grazie all'azione di amminopeptidasi contenute nei MICROVILLI della membrana degli enterociti.
Nel neonato, a differenza dell'adulto, si può avere l'assorbimento di intere molecole
proteiche, ad esempio gli anticorpi (soprattutto IgA), contenuti nel latte materno,
che sono mantenuti integri e quindi assorbiti grazie alla generale immaturità del
tratto gastrointestinale (minore attività enzimatica, maggiore permeabilità della
mucosa intestinale, ecc.). Questa capacità di assorbire intere proteine può avere
risvolti negativi, perché può portare alla sensibilizzazione e quindi alla comparsa di
allergia alle proteine del latte vaccino.
LA DIGESTIONE DELLE PROTEINE
Gli amminoacidi, una volta giunti al FEGATO, in parte vengono utilizzati come
tali e in parte vengono trasformati in altre sostanze. Ad esempio attraverso la
decarbossilazione si producono ammine biogene, come la serotonina, la
dopamina, ecc. che hanno importanti ruoli fisiologici; oppure con il
trasferimento (transaminazione) e con la rimozione (deamminazione ossidativa)
del gruppo amminico dei vari amminoacidi si ottengono intermedi del
metabolismo glucidico e lipidico. Alcuni amminoacidi sono inoltre i
precursori biosintetici dei nucleotidi; essi infatti forniscono l'azoto e il
carbonio per la sintesi delle basi puriniche e pirimidiniche degli acidi nucleici.
GLI AMINOACIDI ESSENZIALI
Le proteine alimentari forniscono tutti gli amminoacidi necessari all'organismo
umano e in particolare quelli, una decina, che l'organismo stesso non è in grado di
preparare con i suoi processi metabolici e che sono chiamati amminoacidi essenziali.
Gli amminoacidi essenziali sono nove:
fenilalanina,
leucina,
treonina,
isoleucina,
lisina,
valina.
istidina,
metionina,
triptofano,
Si ritiene inoltre che nei primi mesi di vita si debbano considerare essenziali anche la
tirosina e la cisteina. Se per la prima non sono ancora chiariti i motivi, per la
seconda invece si è appurato che l'attività dell'enzima, che catalizza la trasformazione
della metionina in cisteina, è in quantità sufficienti e/o funzionalità idonea solo dopo i
quattro mesi di vita.
Iperfenilalaninemia
o fenilchetonuria
Infine in questi ultimi anni sono stati accomunati nella categoria degli amminoacidi
"condizionatamente essenziali" quelli che possono essere sintetizzati a livello
metabolico solo se sono disponibili altri specifici amminoacidi. Ad esempio, la
tirosina ha come precursore un amminoacido essenziale, la fenilalanina, mentre
glicina, prolina e arginina hanno come precursori altri amminoacidi non
essenziali. Per tali amminoacidi "condizionatamente essenziali" la sintesi è
quindi "condizionata" dalla disponibilità di un altro amminoacido e procede
con una velocità che può essere rallentata da determinate condizioni
fisiopatologiche.
Grazie alle conoscenze che via via, nel corso degli anni, sono state acquisite in
campo alimentare, le organizzazioni internazionali, preposte all'individuazione
delle necessità alimentari delle varie popolazioni, hanno definito con sempre
maggiore precisione i livelli di amminoacidi essenziali ritenuti necessari nelle
diverse fasce d'età.
Nel 1985 un comitato misto FAO/OMS/UNU ha proposto le combinazioni
tipo di amminoacidi essenziali per le diverse fasce d'età. Successivamente,
sulla base di nuovi dati sperimentali, si è giunti a considerare come
maggiormente affidabile per quasi tutte le fasce di età, la combinazione
proposta inizialmente per i bambini in età prescolare. Per questo, per valutare
la qualità proteica dei vari alimenti si ritiene opportuno assumere come
proteina di riferimento tale combinazione anche per le altre fasce d'età.
Fanno eccezione i lattanti, per i quali è considerata ottimale la distribuzione di
amminoacidi essenziali del latte umano. I LARN, relativi ai fabbisogni di
amminoacidi essenziali per bambini in età prescolare e per adulti, ricalcano
le combinazioni riportate in Tabella 1 per quelle stesse fasce d'età. Anche da
parte della SINU si osserva che le necessità previste per gli adulti possono
essere sottostimate e che quindi è opportuno, anche per l'adulto, riferirsi
alla combinazione raccomandata per il bambino in età prescolare.
Combinazione ottimale di amminoacidi essenziali a diverse età
(mg/g di proteina)
Amminoacido
Neonati*
2-5 anni**
10-12
anni**
Adulti
**
Istidina
26
(19)***
(19)
16
Isoleucina
46
28
28
13
Leucina
93
66
44
19
Lisina
66
58
44
16
Metionina + cisteina
42
25
22
17
Fenilalanina + tirosina
72
63
22
19
Treonina
43
34
28
9
Triptofano
17
11
(9)
5
Valina
55
35
25
13
Totale
460
339
241
127
*Composizione in amminoacidi essenziali del latte umano.
**I valori riportati sono stati ottenuti dividendo il fabbisogno giornaliero di ogni amminoacido
essenziale (mg/kg di peso corporeo) per il fabbisogno proteico giornaliero, stimato in 1.10, 0.99 e
0.75 g/kg di peso corporeo all'età di 2-5 anni, di 10-12 anni e per gli adulti. ***I valori riportati tra
parentesi non sono ancora stati definiti con sicurezza. Da: La valutazione della qualità proteica, Studi
FAO Alimentazione e Nutrizione, 51, 1991, Roma.
PREPARAZIONE DI UN PRODOTTO DIETETICO e
DANNEGGIAMENTO AMINOACIDICO
Si è inoltre constatato che l'apporto proteico garantito normalmente da una dieta
mista può presentare in genere una distribuzione percentuale non ottimale di
amminoacidi essenziali limitatamente al contenuto di lisina, triptofano, treonina e
degli amminoacidi solforati nel loro insieme (metionina + cisteina). Si tratta
evidentemente di amminoacidi che non sono ben distribuiti nella componente
proteica di alcune categorie di prodotti che entrano normalmente nella nostra
alimentazione. Inoltre, alcuni di questi amminoacidi, come la lisina, la metionina e la
cisteina, possono subire modificazioni durante le trasformazioni alimentari, con
conseguente riduzione della loro biodisponibilità.
Nella preparazione di un prodotto dietetico, specie se si tratta di un alimento
importante per la sua componente proteica, come può essere ad esempio un alimento
per la prima infanzia, occorrerà controllare quindi con attenzione l'eventuale
danneggiamento amminoacidico, che si può avere, sia a seguito dei trattamenti
previsti dalle tecniche di preparazione, come pure durante il periodo di
conservazione.
Un apporto amminoacidico non ottimale può infine essere associato a diete
sbilanciate autoprescritte (diete ipocaloriche dissociate) o a una dieta vegetariana
stretta.
FATTORI CHE INFLUISCONO SULL’UTILIZZAZIONE
PROTEICA
I principali fattori che influiscono sull'utilizzazione alimentare di una proteina
sono il suo contenuto percentuale in amminoacidi essenziali e la sua digeribilità.
Più la proteina presenta una distribuzione di amminoacidi essenziali vicina a
quella necessaria all'organismo più tale proteina è utilizzabile ai fini plastici. Si
può dire che la proteina ideale è quella che, una volta "smontata" attraverso i
processi digestivi, offre all'organismo una combinazione di amminoacidi
essenziali tale che ciascuno di essi viene utilizzato unicamente per "montare"
nuove proteine corporee. Un contenuto non adeguato di alcuni amminoacidi
essenziali comporta invece l'impossibilità di utilizzare completamente gli altri che
vengono allora destinati ai fini energetici. Ciò non costituisce soltanto uno "spreco
alimentare", ma comporta anche un aggravio per l'attività metabolica
dell'organismo.
L’aminoacido limitante e
LA DIGERIBILITA’ PROTEICA
Dal momento che per la sintesi proteica devono essere disponibili
conteporaneamente tutti gli amminoacidi essenziali necessari, tale sintesi si
interrompe quando non è più disponibile l'amminoacido che è nella percentuale
meno soddisfacente. Tale aminoacido, che limita l'utilizzazione degli altri
amminoacidi essenziali, si definisce amminoacido limitante.
Per quando riguarda la digeribilità proteica (DP), essa viene in genere calcolata in
vivo sui ratti in quanto si è dimostrato che essi possiedono una DP simile a quella
dell'uomo.
La digeribilità proteica è data dal rapporto tra l'azoto proteico assorbito e la quantità
di azoto ingerito:
DP= N assorbito
N ingerito
Da cosa dipende la Digeribilità Proteica ?
La digeribilità proteica può dipendere da vari fattori. In primo luogo dipende dalle
caratteristiche dell'alimento, come l'esistenza di pareti cellulari, che ostacolano
l'aggressione enzimatica o la presenza di altri componenti della dieta che
influiscono negativamente sul processo digestivo, come, ad esempio, la presenza
di fibra. Inoltre, tra gli altri fattori, importante è la presenza di vitamine del
gruppo B, che entrano a far parte di numerosi sistemi enzimatici indispensabili per
il metabolismo proteico. Va infine ricordato che la digestione e il successivo
assorbimento degli amminoacidi presenta una certa variabilità da individuo a
individuo, specie in presenza di un'anormale disponibilità enzimatica e di
situazioni patologiche a livello gastrointestinale.
IL VALORE BIOLOGICO DI UNA PROTEINA
Il valore biologico di una proteina, o di una miscela di proteine, ossia la sua
capacità di fornire all'organismo umano l'apporto di azoto e di amminoacidi
richiesti per soddisfare le necessità dell'organismo, può essere valutato analizzando
il suo contenuto in amminoacidi e sottoponendola a test biologici. Con questi ultimi
si ottengono utili indici biologici, come il Rapporto di efficienza proteica (PER =
protein efficiency ratio), il Valore biologico (B V = biological value) e
l'Utilizzazione proteica netta (NPU = net protein utilisation). Con l'analisi degli
amminoacidi si può valutare la "qualità proteica" attraverso la determinazione del
Punteggio chimico o Indice chimico.
Il PER rappresenta l'incremento di peso corporeo di un ratto da esperimento in
rapporto alla quantità di proteina ingerita:
PER =
incremento in peso
quantità di proteina ingerita
Per BV si intende il rapporto fra l'azoto trattenuto dall'organismo, ossia quello
utilizzato nella formazione dei tessuti o per altre funzioni vitali e non escreto con
le urine e le feci e l'azoto assorbito:
BV =
N trattenuto
N assorbito
Il valore di BV è in genere moltiplicato per 100. In tal caso alla proteina
dell'uovo, scelta come proteina di riferimento, è assegnato un valore biologico
uguale a 100; il che significa che tutto l'azoto assorbito viene utilizzato.
La NPU è data dal rapporto fra l'azoto trattenuto e quello ingerito:
N trattenuto
NPU=
N ingerito
Tale indice tiene conto contemporaneamente della digeribilità e dell'efficienza di
utilizzazione degli amminoacidi assorbiti. Infatti risulta dal prodotto fra il valore
biologico della proteina considerata e la sua digeribilità.
BV x DP =
N assorbito
N trattenuto
N trattenuto
= NPU
x
=
N assorbito
N ingerito
N ingerito
Stabilisce la qualità proteica
IL PUNTEGGIO CHIMICO
Per molti anni per stabilire la qualità proteica si è ricorso alla determinazione del
PER. Si tratta però di un metodo poco preciso, perché l'accrescimento del ratto è
molto più rapido di quello dell'uomo. All'animale da esperimento necessitano
inoltre differenti apporti di amminoacidi, in particolare di quelli solforati.
Infine è difficile stabilire correttamente le quantità di mantenimento dei vari
amminoacidi. Infatti, un determinato apporto proteico può influire così scarsamente
sull'accrescimento da avere un PER praticamente uguale a zero, ma essere
ampiamente sufficiente per il mantenimento.
In questi ultimi anni, per valutare la qualità proteica di un alimento, si è andato
sempre più affermando il metodo della determinazione del punteggio chimico. Con
tale metodo si procede attraverso alcune ben precise tappe.
In primo luogo si calcola il contenuto proteico dell'alimento. A tale contenuto si
risale dal valore di azoto determinato generalmente col metodo Kjeldahl. Tale
valore compare nelle tabelle che riportano la composizione chimica degli alimenti.
Poiché, come è noto, il metodo Kjeldahl determina ìl contenuto di azoto totale
di un prodotto, la conversione azoto-proteina, viene fatta con buona
approssimazione utilizzando un giusto fattore di conversione. In generale,
considerando che la maggior parte delle proteine contiene circa il 16% di
azoto, il contenuto proteico di un alimento si ricava dal prodotto del contenuto
in azoto totale per 6.25. Dal momento però che alcune proteine presentano
valori percentuali di azoto che si discostano sensibilmente dal 16% sono stati
ricavati altri fattori di conversione. Ad esempio per farina di frumento e soia
5.70 e per latte e derivati 6.38.
Quindi si determina il contenuto in amminoacidi, ricorrendo in genere ad
idrolisi e separazione con metodi cromatografici.
Si determina, infine, il PUNTEGGIO CHIMICO, ossia si calcola il
rapporto fra la quantità, espressa in mg, di ogni amminoacido
essenziale presente in un grammo della proteina da valutare e la
quantità, sempre in mg, presente in un grammo della proteina di
riferimento (uovo). Il rapporto più basso, ossia quello relativo
all'amminoacido limitante, rappresenta il punteggio chimico di quella
proteina.
IL FABBISOGNO PROTEICO
Il fabbisogno proteico di un individuo è rappresentato dalla quantità minima di
proteine, fornite dalla dieta, necessarie per compensare le sue perdite di
azoto, mantenendo nel contempo il bilancio energetico per un'attività fisica
moderata.
La quantità di proteine necessaria quotidianamente all'uomo e alla donna adulti è
stata stabilita dal Comitato FAO/OMS/UNU, riunito nel 1985, mediamente
intorno ai 0.75 g per chilogrammo di peso corporeo, prendendo come
riferimento proteine ad alto valore biologico, ossia pienamente utilizzabili,
come quelle dell'uovo.
Tale valore rappresenta il livello di sicurezza di ingestione proteica e dovrà
essere corretto tenendo conto del tipo di proteine presenti normalmente nella
dieta. Infatti, per una dieta mista, ossia comprendente proteine di origine animale
e vegetale, tale valore dovrebbe essere incrementato di circa 0.2 g/kg.
Nella Tabella 2 sono riportati i livelli di sicurezza di ingestione proteica
indicati dalla Società Italiana di Nutrizione Umana per le diverse età.
Il fabbisogno proteico è influenzato da vari fattori, in primo luogo dall'attività
fisica e naturalmente cresce all'aumentare dell'intensità di tale attività. Vi sono
anche alcune condizioni fisiologiche particolari dell'organismo, come la
gravidanza e l'allattamento che richiedono un incremento del fabbisogno
proteico (6 e 17 g al giorno rispettivamente). Anche nel periodo di crescita
dell'organismo l'apporto proteico deve essere incrementato per consentire la
costruzione di nuovi tessuti.
Tenendo conto delle valutazioni rigorosamente scientifiche, ma anche del
livello socio-economico di paesi come il nostro, i livelli raccomandati di
apporto proteico sono leggermente superiori a quelli ritenuti di sicurezza.
INTEGRAZIONE PROTEICA
La distribuzione non omogenea degli amminoacidi essenziali nelle varie proteine
comporta inevitabilmente una diversa distribuzione di tali amminoacidi nella
componente proteica dei vari alimenti. Vi sono infatti importanti categorie di
alimenti la cui componente proteica è carente di alcuni amminoacidi essenziali.
È prevedibile che tali carenze riguardino in particolare le proteine di origine
vegetale, ossia di organismi viventi dalle caratteristiche strutturali ben lontane da
quelle umane! Le cariossidi dei cereali, ad esempio, pur contenendo una
discreta quota proteica, forniscono proteine con valori percentuali di lisina e
di triptofano inferiori a quelle ritenute ottimali per le nostre necessità. In tali
alimenti l'amminoacido limitante è la lisina, ma se si integra la quota di tale
amminoacido diventa limitante il triptofano che, come si è detto, è anch'esso in
quantità non soddisfacenti nei cereali, anche se migliori rispetto alla lisina.
Tuttavia nei diversi cereali la distribuzione degli amminoacidi non è identica,
anche per quanto riguarda quelli carenti, per cui una miscela di farine di
diversi cereali può offrire una distribuzione più soddisfacente di amminoacidi
essenziali.
Anche per questo alcuni prodotti dietetici per l'infanzia, come le pappe utilizzate
nello svezzamento, sono costituiti da miscele di farine di vari cereali, come
frumento, avena, riso.
Nei legumi, altra importante categoria di alimenti, l'amminoacido limitante è
invece la metionina. Nei latti artificiali, la cui componente proteica è costituita
dalle proteine di soia, la distribuzione di amminoacidi essenziali del legume viene
migliorata con l'aggiunta di metionina.
L'uomo fin dall'antichità è ricorso inconsapevolmente alla "complementarietà delle
proteine": pasta e fagioli, pasta e ceci, riso e piselli sono classici esempi di come
cereali e legumi insieme compensino, in una certa misura, le reciproche deficienze
in amminoacidi essenziali. Come pure si compie un'utile integrazione proteica
quando si aggiungono biscotti o fiocchi di cereali al latte, o il formaggio
parmigiano alla pastasciutta.
Nella nostra alimentazione le proteine di origine animale, come quelle della carne,
delle uova, del pesce e dei latticini compensano le deficienze in amminoacidi
essenziali delle proteine degli alimenti di origine vegetale. Tornando ai prodotti
dietetici per l'infanzia, come le citate pappe impiegate per lo svezzamento, si ricorre
spesso all'integrazione delle proteine dei cereali con quelle del latte, con la
preparazione delle cosiddette farine lattee.
LE FONTI ALIMENTARI DI PROTEINE
La necessità di disporre di quantità sempre maggiori di proteine è una questione
sempre all'ordine del giorno, in quanto i problemi alimentari del genere umano sono
ben lungi dall'essere risolti. La difficoltà di garantire a tutti proteine di origine
animale, in particolare quelle della carne, ha portato ad intensificare la coltivazione
della soia, ricorrendo anche alla sua manipolazione genetica, per garantirsi grandi
raccolti. Si tratta di un legume ricco non solo di una frazione proteica vegetale di
buona qualità, ma anche di una buona frazione lipidica.
Inoltre, ricercatori di tutto il mondo studiano l'utilizzazione di nuovi alimenti che
possano fornire proteine valide non solo per la quantità, ma anche per la qualità. In
questi ultimi anni sono stati studiati come possibili fonti proteiche anche i più piccoli
organismi viventi, quelli unicellulari. Le prime ad essere state prese in considerazione
sono state le alghe, dal momento che un organismo autotrofo dovrebbe avere costi di
"allevamento" più contenuti.
In realtà per la coltivazione delle alghe al costo del materiale nutritivo vanno
addizionati quello per l'agitazione delle acque che deve garantire una
buona esposizione dell'alga alla luce e quello per un buon essiccamento
che eviti che il prodotto finale sia maleodorante. Tuttavia alcune alghe
come la Chlorella ellipsoidea e la Spirulina maxima hanno trovato impiego in
campo dietetico per la quantità e la qualità del loro CONTENUTO
PROTEICO.
LE PROTEINE NEGLI ALIMENTI
ALIMENTO
%
LATTE DI DONNA
1
LATTE DI MUCCA
3.5
LATTE DI PECORA
4.9
FORMAGGI
25
CARNE DI VITELLO
19
CARNE DI MAIALE
15
CARNE DI POLLO
20
PESCE
17
UOVA
13
FRUMENTO
12
LEGUMI SECCHI
22
RISO
7
ORTAGGI
1-4
SOIA
37
FRUTTA
0.5-1.2
ANALISI DELLE PROTEINE
Cromatografia a Scambio ionico analitica o
preparativa
La fase stazionaria solida è una resina (macromolecole)
con siti attivi ionizzati quali anioni SO3 - o cationi N(CH3)3
+ : gli ioni di soluto di carica opposta vengono attratti
verso la fase stazionaria dalla forza elettrostatica.
La fase mobile è un liquido caratterizzata da un
controione originario della resina in alte concentrazioni.
ANALISI HPLC
Cromatografia ad Esclusione molecolare
Teoricamente non vi è alcuna interazione attrattiva. La fase stazionaria è un
solido poroso (gel) i cui pori cambiano di dimensione e comunque sono
abbastanza piccoli. Le molecole dell’analita disciolte nella fase mobile
penetrano nei pori e rimangono per più tempo intrappolate a differenza delle
molecole più grandi che escono dalla colonna in tempi brevi (cromatografia a
permeazione su gel, GPC).