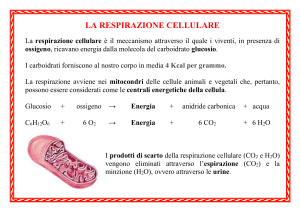
1. Spiegare perchè nella purificazione elettrolitica del rame il bagno elettrolitico deve essere fortemente
acido ed agitato, e il potenziale da applicare agli elettrodi è di 0,3 Volt.
Si aggiunge acido solforico al bagno per far regredire l’drolisi del solfato di rame: Cu(OH)2 + 2H3O+ --> Cu++
+ 4H2O. L’agitazione permette di uniformare le concentrazioni anodiche e catodiche, il potenziale di
decomposizione teorico sarebbe 0, il valore 0,3 tiene conto della resistenza della soluzione di CuSO 4.
2. Spiegare il meccanismo della reazione Na2O + CO2 -----> Na2CO3, secondo quale teoria acido-base può
essere classificata ?
O
C
O--
O
3. Spiegare perchè una lamiera di ferro zincato è protetta dalla corrosione, mentre una ramata non lo è.
Considerando che il potenziale redox dello zinco è minore di quello del ferro e questo è minore di quello del
rame; nel caso dello zinco si forma una pila zinco polo (-) ossigeno su ferro polo (+) per cui si corrode lo
zinco; nel caso del rame si forma una pila ossigeno su rame polo (+) ferro polo ( (-) per cui si corrode il ferro.
4. Spiegare perchè la pioggia non inquinata ha un pH = 5,6, mentre le piogge inquinate ne hanno uno
inferiore a 5.
Le piogge inquinate sono acide per effetto degli acidi derivanti da SO 2 ed NOx (H2SO4 ed HNO3 , mentre la
pioggia naturale è acida per effetto di CO2 il cui acido (H2CO3) è molto più debole.
1. Quale effetto ha l’UV-C sul freon12 (CCl 2F2 ).
L’ UV-C rompe il legame C-Cl secondo la reazione: CCl2F2 .CClF2 + Cl.
si forma cioè un atomo di cloro (radicale) il quale reagisce con l’ozono stratosferico secondo la reazione a
catena:
Cl. + O3 ClO. + O2
ClO. + O Cl. + O2
come si vede l’atomo di cloro consumato nella prima reazione viene rigenerato nella seconda, si calcola
che in tal modo un singolo atomo di cloro distrugga 5.000 molecole di ozono.
2. Prevedere, in base alle proprietà periodiche, il comportamento in acqua di ClOH e LiOH ?
In acqua si rompe il legame più polarizzato, per cui in base ai valori di elettronegativià avremo:
Cl-O-H + H2O --> Cl-O- + H3O+ (acido)
Nel caso di LiOH il legame è ionico, quindi avremo in acqua Li+ e OH- (basico)
3. Spiegare perchè nella sintesi industriale dell’acido solforico con il metodo di contatto si opera a
pressione atmosferica e a 420°C.
La reazione SO2 + ½ O2 = SO3 è un equilibrio poco influenzato dalla pressione vi è una variazione di solo ½
mole, per cui si opera a pressione atmosferica. La reazione è esotermica, quindi sfavorita dalla temperatura,
si opera a 420°C per aumentare la velocità di reazione pur con bassa conversione, a cui si ovvia riciclando
la SO2 non reagita.
4. Perchè la corrosione del ferro è maggiore nelle acque calme rispetto a quelle agitate ?
In acque calme si hanno forti differenze di ossigenazione e quindi corrosione per aerazione differenziale,
cosa che non avviene in acque agitate.
5. Spiegare il meccanismo della reazione CO2 + CaO --> CaCO3, come la classifichereste alla luce
delle teorie acido-base?
O
C
O--
O
O -- base di Lewis ; CO2 acido di Lewis ; Ca++ CO3- -solido ionico
10. Spiegare in quale rapporto in peso devono essere aria e gpl per trovarsi al punto lambda (gpl =
propano; aria 76% N2 , 24 % O2 in peso).
C3H8 + 5 O2 --> 3CO2 + 4H2O
1g/44 g.mol-1 = 0,0227 mol C3H8
0,0227 mol . 5 . 32 g. mol-1 = 3,6 g ossigeno O2
3,6 g/0,24 = 15,15 g aria
5. Identificare le coppie acido-base di Broensted nelle seguenti reazioni:
O - - (b) + H2O(a) OH-(b) + OH-(a) ; HCO3 - (b)+ H2O(a) H2CO3(a) + OH-(b) ; HCOOH(b) + HClO4(a)
HCOOH2+(a) + ClO4 -(b) ; CH3NH2(b) + CH3NH2(a) CH3NH3+(a) + CH3NH -(b).
6. Spiegare le condizioni della reazione (esotermica) di sintesi dell’ammoniaca dagli elementi: 250 atm e
500°C.
N2 + 3H2 2NH3
La reazione in fase gassosa procede con una diminuzione delle moli, per cui l'equilibrio (principio di Le
Chatelier) si sposta verso destra ad alte pressioni (250 atmosfere), per lo stesso principio si sposta verso
sinistra ad alte temperature (500°C), la costante di equilibrio è infatti 1,6 . 10-5 a tale temperatura; si deve
tenere conto del fatto che solo a tale temperatura la velocità di reazione e l'azione del catalizzatore hanno
valori accettabili dal punto di vista industriale. Si preferisce perciò avere una bassa conversione dei reagenti
in ammoniaca in tempi rapidi e riciclare continuamente le sostanze non reagite fino a conversione completa.
7. Prevedere il comportamento diNa2O e di CO2 in acqua.
Gli ossidi dei metalli alcalini come il sodio sono ionici, esiste lo ione ossido O -- che in acqua forma lo ione
OH- secondo la reazione O-- + H2O 2OH- base forte.
Gli ossidi dei non metalli come CO2 sono covalenti e i loro prodotti di idratazione sono acidi, in quanto in
acqua si rompe il legame più polare della molecola formatasi che è quello fra O e H
O==C(---O----H)2 il
carbonio infatti è più elettronegativo dell'idrogeno.
8. Spiegare in quali condizioni un indicatore di pH con KIn = 10-10 fornisce il pH di una soluzione ?
HIn + H2O = H3O+ + In-
K in
[ H 3O ][ In ]
10 5
[ HIn ]
Dall'espressione si vede come solo quando [In-] = [HIn] cioè al punto di viraggio [H3O+] = Kin e quindi pH =
pK = 10.
9. Che effetto hanno rispettivamente una impurezza di zinco ed una di rame sulla corrosione del ferro ?
Dalla figura si vede come il rame diventi polo positivo di una pila ossigeno/rame, mentre il ferro polo negativo
e quindi si corroda; lo zinco diventa invece polo negativo di una pila ossigeno/zinco e il ferro polo positivo e
quindi non si corroda.
10. dare una spiegazione dell’effetto serra e dire fra ottano e metanolo quale contribuisce di più a tale
fenomeno. Le entalpie di combustione sono rispettivamente 5471 e 726 KJ/mole.
Entalpia
CO2/O2
molare
KJ prod./moli CO2
KJ/mol
0,64
-5471
5471 : 8 = 684
C8H18(l) + 25/2 O2 8CO2 + 9H2O(l)
0,66
-726
726
CH3OH(l) + 3/2 O2 CO2 + 2H2O(l)
Si indica con tale termine l’effetto dei gas contenuti nell’atmosfera sull’assorbimento e la riemissione della
radiazione solare, le molecole responsabili di tale fenomeno sono per 2/3 l’acqua e per 1/3 l’anidride
carbonica, la loro azione di assorbimento e riemissione della radiazione termica mantiene la temperatura
media al livello del mare a +15°C. L’aumento della CO 2 ad opera dell’uomo fa aumentare tale temperatura
con effetti sul clima. Dalla tabella si vede come il metanolo produca più KJ per mole di CO 2 prodotta.
6. Identificare le coppie acido-base di Broensted nelle reazioni: HCN(a) + H2O(b) CN-(b) + H3O+(a) ; CO3
--(b) + H O(a) HCO -(a) + OH-(b) ; CH COOH(b) + HClO (a) CH COOH +(a) + ClO -(b ; NH (a) +
2
3
3
4
3
2
4
3
NH3(b) NH4+(a) + NH2 -(b).
7. Spiegare le condizioni di reazione del metodo di contatto di sintesi dell’acido solforico : 420°C, 1
atmosfera.
2SO2 O2 2SO3
La reazione è esotermica, quindi favorita dalle basse temperature, però per motivi cinetici (alta energia di
attivazione) e di catalizzatore (420° C è la temperatura ottimale per il V 2O5) si opera ad alta temperatura. La
reazione è favorita da un aumento di pressione, ma l’effetto della pressione è piccolo ( il raddoppio di
pressione porta ad un aumento della radice quadrata della frazione molare di SO 3 ) e dal punto di vista
industriale non conveniente; infatti il processo a più stadi nel convertitore porta, riciclando continuamente l’
SO2 non reagita, alla sua conversine totale in SO3 .
8. Prevedere il comportamento in acqua di un composto del tipo XOH.
Premesso che l'ossigeno è sempre l'elemento più elettronegativo ( = 3,5) mentre l'idrogeno ha = 2,1; nel
caso in cui X sia un elemento metallico come Na, K, Ca, Mg a bassa elettronegatività ( 1) molto minore di
quella dell'idrogeno, avremo che in acqua si romperà il legame più polarizzato secondo la reazione:
X--O--H + H2O X+aq + OHnel caso in cui X sia un elemento non metallico come S,Cl,N ad elevata elettronegatività ( 3) maggiore
di quella dell'idrogeno, in acqua si romperà ancora il legame più polarizzato secondo la reazione:X--O--H +
H2O XO - + H3O +
9. Spiegare cosa vuol dire, in termini di pH, che una soluzione è acida rispetto ad un indicatore con K In = 4
x 10-10 ?
HIn + H2O = H3O+ + In-
[ H 3O ][ In ]
4 10 10
[ HIn ]
[ Hin ]
[ H 3O ] 4 10 10
[ In ]
K in
[ HIn ] [ In ]
[ H 3O ] 4 10 10
pH 9,4
9.
Quale protezione dalla corrosione è rappresentata dal seguente schema:
Consideriamo la tubazione in ferro, lo schema riguarda la protezione catodica, l’elettrodo sacrifiziale è
costituito da magnesio, metallo con potenziale redox più basso di quello del ferro e non passivabile. Si forma
una pila in cui l’elettrodo positivo è costituito dal ferro su cui si riduce l’ossigeno secondo la reazione :
O2 + 2 H2O + 4e- 4OH - , l’elettrodo negativa di magnesio si ossida secondo la reazione Mg Mg++ + 2e-.
10. Quali sono i fattori che determinano le piogge acide ?
Piogge acide. Il pH della pioggia “naturale” cioè non inquinata risulta essere di 5,6. Tale valore deriva dalla
presenza di CO2 che, come ossido acido dà luogo in acqua ai seguenti equilibri:
CO2(g) + H2O(aq) H2CO3(aq) successivamente H2CO3(aq) H3O+(aq) + HCO3- che determinano un pH
leggermente acido. Si parla di piogge acide quando il pH risulta essere inferiore a 5. Le cause di queste
piogge sono alcuni inquinanti acidi prodotti dalle attività umane, principalmente SO 2 (diossido di zolfo) e NOx
(ossidi di azoto).
La fonte principale dell’SO2 immessa nell’atmosfera è il carbone bruciato nelle centrali termoelettriche. Il
carbon fossile contiene infatti dall’uno al cinque percento di zolfo che bruciando produce SO 2. Il petrolio ed il
gas naturale contengono 1-2% di zolfo principalmente sotto forma di H2S (solfuro di idrogeno) sostanza
altamente tossica che deve essere eliminata, a tale scopo lo si ossida per un terzo a SO2 secondo la
reazione H2S + 3/2O2 SO2 + H2O, successivamente si fa avvenire la cosiddetta reazione di Claus nella
quale i prodotti di reazione sono sostanze non tossiche come zolfo ed acqua : 2H 2S + SO2 3S + 2H2O.
11. Nel processo di contatto per la produzione dell’acido solforico tutto il calore prodotto serve sia alle
necessità energetiche dell’impianto sia a fornire un surplus di energia utilizzabile all’esterno (vapore,
energia elettrica), l’inquinamento dell’ambiente inoltre risulta minimo. Illustrare il processo e giustificare
queste due affermazioni.
La temperatura ottimale per il catalizzatore è di 420 °C, la reazione di ossidazione di SO 2 è fortemente
esotermica per cui con uno scambiatore di calore si abbassa la temperatura recuperando calore.
L’ossidazione dell’ SO2 procede a stadi riciclando il non reagito, per cui alla fine quasi tutta viene convertita
in SO3 senza rilasciare nell’ambiente l’SO2.
12. Spiegare perchè la ruggine a parità di altre condizioni si forma nelle zone del ferro dove la
concentrazione di ossigeno è minore.
si forma una pila di concentrazione nella quale il polo positivo si trova nella zona a concentrazione di
ossigeno maggiore O2 + 4H2O + 4e - --> 4OH – nella zona a concentrazione di ossigeno minore, polo
negativo si avrà l’ossidazione del ferro Fe -->Fe+++2e- .
13. L’ozono nella stratosfera protegge gli esseri viventi dalle radiazioni ultraviolette a minore lunghezza
d’onda, darne una spiegazione indicando le reazioni relative.
nella stratosfera a 25 km si hanno le seguenti reazioni:
UV-C
O2 2O
O + O2 + M (N2) O3 + M + Calore
UV-B
O3
O2 + O
l’ozono blocca gli UV C e B a minore lunghezza d’onda e quindi più dannosi perchè più energetici, in un ciclo
di formazione distruzione che lo mantiene ad una concentrazione costante.
14. Contribuisce di più all’effetto serra bruciare 1 Kg di propano C3H8 o 1 Kg di ottano C8H18 ?
C 3 H 8 + 5O2 --> 3CO 2 + 4H2O ; C 8 H 18 + 25/2 O2 --> 8CO 2 + 9H2O
1000 g/44 g . mol-1 = 22,72 mol propano --> x 3 = 68 mol CO2
1000 g / 114 g . mol-1 = 8,77 mol ottano --> x 8 = 70 mol CO2 produce di più l’ottano
15. Quale è la funzione dei metalli palladio e platino in una marmitta catalitica, e quale quella della
temperatura (250-270°C). Dare un esempio di reazione che avviene nel sistema.
2CO + O2 2CO2
(CH2)n ( idrocarburo incombusto) + O2 nCO2 + nH2O
i due metalli sono catalizzatori di ossidazione di CO e di idrocarburi portando tutto a CO 2 ed acqua,
la temperatura tiene conto dei fattori cinetici e di attività del catalizzatore.
1. Un campione di ottone (Lega Zn/Cu) del peso di 20 g trattato con una soluzione 1 M di HCl acquoso
sviluppa 1,6 litri di idrogeno misurati a 0°C ed 1 atm. Scrivere e giustificare quale reazione avviene,
calcolare inoltre la composizione % della lega.
Il potenziale redox dello zinco è negativo, quello del rame positivo, quindi lo ione idrogeno ossiderà solo lo
zinco secondo la reazione: Zn + 2H3O+ --> Zn++ + H2 + 2H2O
moli (H2) = 1,6 litri/22,41 litri . mole –1 = 0,071 mol (Zn) ; 0,071 mol . 65,4 g . mol –1 = 4,64 g (Zn). ( 4,64 g / 20)
. 100 = 23,32%
2. Nel processo di produzione dell’ammoniaca si opera in condizioni per le quali la costante di equilibrio
della reazione risulta molto piccola, spiegarne il motivo e descrivere le condizioni operative del processo
industriale.
La reazione di sintesi N2 +3H2 = 2NH3 ha luogo su catalizzatore a base di ferro finemente suddiviso a 250
atmosfere (equilibrio spostato verso il volume minore) e 500°C, la reazione è esotermica quindi sfavorita
da alte temperature, che però favoriscono la velocità di reazione (i reagenti hanno legami forti = alta
energia di attivazione). Si preferisce avere un’ alta velocità di reazione (alta temperatura), con una bassa
conversione (Keq piccola) a cui si pone rimedio riciclando la miscela di reazione fino alla conversione
completa dei reagenti nel prodotto. Nella scelta della temperatura si deve considerare inoltre che il
catalizzatore ha una temperatura ottimale di funzionamento.
3. Spiegare perchè la ruggine a parità di altre condizioni si forma preferibilmente per contatto fra il ferro ed
un metallo più nobile.
Lo schema può essere ricondotto a quello di una pila chimica in corto circuito, nella quale il polo positivo è
l’impurezza di rame (metallo più nobile), dove avviene la riduzione dell’ossigeno secondo la reazione:
O2 + 2H2O + 4e - 4OH –
mentre al polo negativo costituito dal ferro si ha la ossidazione dello stesso metallo secondo la reazione:
Fe Fe ++ + 2e gli ioni ferro reagiscono con gli ioni idrossido formando un composto insolubile, il precursore della ruggine:
Fe++ + 2OH - Fe(OH)2 Fe2O3 nH2O (ruggine)
si forma quindi una pila:
O2/OH -// Fe++/Fe
i cui potenziali standard sono E° (O2/OH -) = +0,4 V; E° (Fe++/Fe) = -0,44 V
4. Spiegare perchè i freon distruggono la fascia di ozono ?
I CFC sfuggono verso l’alta atmosfera dove per effetto degli UV-C subiscono la rottura del legame C-Cl
secondo la reazione:
CCl2F2 .CClF2 + Cl.
si forma cioè un atomo di cloro (radicale) il quale reagisce con l’ozono stratosferico secondo la reazione a
catena:
Cl. + O3 ClO. + O2
ClO. + O Cl. + O2
come si vede l’atomo di cloro consumato nella prima reazione viene rigenerato nella seconda, si calcola che
in tal modo un singolo atomo di cloro distrugga 5.000 molecole di ozono.
5. Contribuisce di più all’effetto serra bruciare 14,6 g di propano C3H8 o 16 g di metano CH4 ?
C 3 H 8 + 5O2 --> 3CO2+4H2O; 14,6 g/ 44 g.mol-1 = 0,33 mol propano
0,33 . 3 = 1 mole CO2
CH4 + 2O2 --> CO2 + 2H2O 16 g / 16 g . mol-1 = 1 mol CO2 uguale contributo
6.
Quali sono gli inquinanti che determinano le piogge acide ?
Il pH della pioggia “naturale” cioè non inquinata risulta essere di 5,6. Tale valore deriva dalla presenza di
CO2 che, come ossido acido dà luogo in acqua ai seguenti equilibri:
CO2(g) + H2O(aq) H2CO3(aq) successivamente H2CO3(aq) H3O+(aq) + HCO3- che determinano un pH
leggermente acido. Si parla di piogge acide quando il pH risulta essere inferiore a 5. Le cause di queste
piogge sono alcuni inquinanti acidi prodotti dalle attività umane, principalmente SO2 (diossido di zolfo) e NOx
(ossidi di azoto) che portano alla formazione di acidi forti come il solforico ed il nitrico.