Prof. Gian Andrea Pagnoni
www.ilnaturalista.it
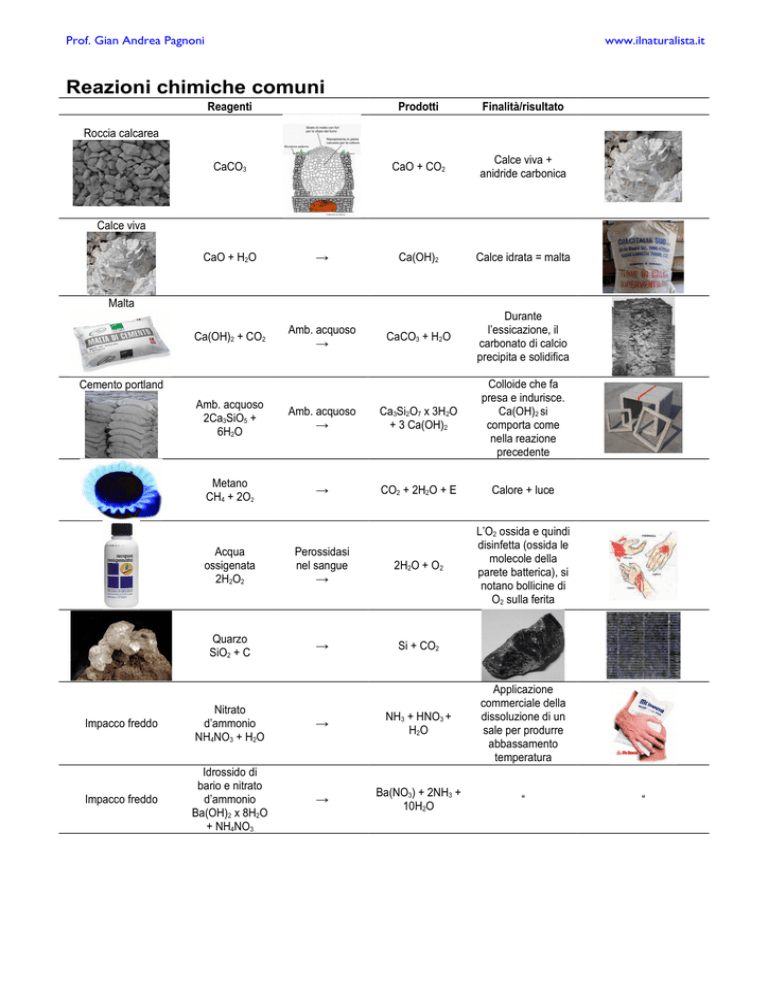
Reazioni chimiche comuni
Reagenti
Prodotti
Finalità/risultato
CaCO3
CaO + CO2
Calce viva +
anidride carbonica
Ca(OH)2
Calce idrata = malta
CaCO3 + H2O
Durante
l’essicazione, il
carbonato di calcio
precipita e solidifica
Roccia calcarea
Calce viva
CaO + H2O
→
Ca(OH)2 + CO2
Amb. acquoso
→
Malta
Amb. acquoso
2Ca3SiO5 +
6H2O
Amb. acquoso
→
Ca3Si2O7 x 3H2O
+ 3 Ca(OH)2
Colloide che fa
presa e indurisce.
Ca(OH)2 si
comporta come
nella reazione
precedente
Metano
CH4 + 2O2
→
CO2 + 2H2O + E
Calore + luce
L’O2 ossida e quindi
disinfetta (ossida le
molecole della
parete batterica), si
notano bollicine di
O2 sulla ferita
Cemento portland
Acqua
ossigenata
2H2O2
Perossidasi
nel sangue
→
2H2O + O2
Quarzo
SiO2 + C
→
Si + CO2
Impacco freddo
Nitrato
d’ammonio
NH4NO3 + H2O
→
NH3 + HNO3 +
H2O
Applicazione
commerciale della
dissoluzione di un
sale per produrre
abbassamento
temperatura
Impacco freddo
Idrossido di
bario e nitrato
d’ammonio
Ba(OH)2 x 8H2O
+ NH4NO3
→
Ba(NO3) + 2NH3 +
10H2O
“
“
Prof. Gian Andrea Pagnoni
www.ilnaturalista.it
Reagenti
Bevande scaldate
istantaneamente
Prodotti
Finalità/risultato
Applicazione
commerciale della
dissoluzione di un
sale per produrre
aumento della
temperatura
CaCl2 + 2H2O
→
Ca(OH)2 + 2HCl
CaO + 3C
Forno
→
CaC2 + CO
Carburo di calcio +
Monossido di C
Carburo dicalcio
CaC2 + 2H2O
→
Ca(OH)2 + C2H2
Calce + acetilene
2C2H2 + 5O2
→
2H2O + 4CO2
Fiamma
Bicarbonato
NaHCO3 +
HCl
(stomaco)
→
NaCl + H2O + CO2
Tampone/digestivo
Bicarbonato
NaHCO3 +
CH3COOH
Acido acetico
→
CH3COONa +
H2O + CO2
Acetato di sodio
e bollicine di CO2
Calcare
CaCO3 +
2HCl
anticalcare
→
CaCl2 +
H2O +
CO2
Cloruro di calcio
solubile in acqua e
bollicine di CO2
(risciacquo)
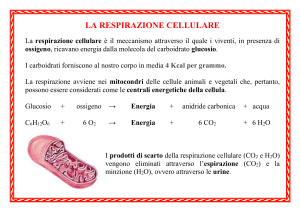
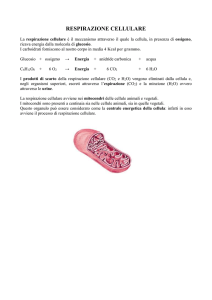
Glucosio
C6H12O6
Fermentazione
lattica
→
Acido lattico
(acido 2idrossipropanoico)
2 C2H6O3
Ca10(PO4)6(OH)2
+ 14H+
Ambiente acido
→
10Ca++ +
6H2PO4¯+ 2H2O
Glucosio
C6H12O6 + O2
Respirazione
cellulare
→
6 CO2 + 6 H2O
+ 36 ATP
Ca(HCO3)2 +
H2O
→
CaCO3 + CO2 +
2H2O
Fermenti lattici
Idrossiapatite
Carie
Mitocondri
Rocce carbonatiche
Carsismo
Stallatiti
Stalagmiti
Prof. Gian Andrea Pagnoni
www.ilnaturalista.it
Reagenti
Prodotti
Finalità/risultato
4C3H5(ONO2)
→
12CO2 + 10H2O +
6N2 + O2
Reazione
fortemente
esoergonica
Esplosione
Allumina
2Al2O3 + 3C
Grafite
Processo HallHéroult
→
4Al + 3CO2
Oro+cianuro K
4Au + 8KCN +
2H2O + O2
→
4KOH +
4KAu(CN)2
Cianuro di oro
2Au(CN)2 - + Zn
Polvere di zinco
→
2Au + Zn(CN)4=
1,2,3-trinitrossipropano
Nitroglicerina
Raffinazione alluminio
dalla bauxite in elettrolisi
con elettrodi di grafite (C)
Cianurazione rocce
auriche
Estrazione di oro in
soluzione
Cianuro doppio di
oro e potassio +
Potassa caustica