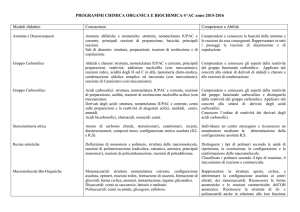
Programma del corso di Chimica Organica per il Corso di Laurea in Farmacia.
Esposizione dettagliata. 1) Richiami di struttura atomica e di teoria del legame chimico; natura
dell’ elettrone, equazione d’onda ed orbitali atomici e molecolari, principio di esclusione di Pauli,
regola di Hund, principio dell’Aufbau, strutture di Lewis, i metodi del valence bond (VB), incluse
le regole delle strutture di risonanza, e dell’ orbitale molecolare (MO), metodo LCAO, la
ibridazione, la struttura dei principali ibridi di risonanza; struttura del metano, legami singoli, doppi
e tripli nel C, geometria dei legami doppi (etilenici) e tripli (acetilenici); elettronegatività, il
momento dipolare e la sua influenza su varie proprietà fisiche, le interazioni dipolo-dipolo, il
legame ad Idrogeno, le forze di van der Waals e di London; il concetto di acido-base, teorie di
Bronsted-Lowry e di Lewis, le equazioni di dissociazione acido-base. 2) La rappresentazione delle
strutture chimiche, le strutture a scheletro e regole per il loro utilizzo, il concetto di gruppo
funzionale. 3) Il metano come molecola rappresentativa degli idrocarburi, struttura del metano e
varie rappresentazioni della stessa, formula minima e formula bruta, reazioni di ossidazione e di
alogenazione; i concetti di reazione di sostituzione e di reattività , di meccanismo di reazione e di
velocità di reazione (cenni di quest’ultimo), il meccanismo della sostituzione radicalica nel metano
e negli idrocarburi alifatici, con i concetti di reazione a catena e di inibitori, il calore di reazione,
l’energia di attivazione, lo stato di transizione, la struttura del radicale metilico. 4) Gli Alcani,
nomenclatura, serie omologhe, C ed H primari, secondari e terziari; il concetto di conformazione,
anche dal punto di vista energetico, con esempi del propano e del butano, la rappresentazione a
cavalletto, le formule di Newton, il concetto di isomeria; metodi di preparazione degli alcani:
idrogenazione degli alcheni, idrolisi dei reattivi di Grignard, riduzione con metalli degli alogenuri
alchilici, copulazione degli alogenuri alchilici con i dialchilcuprati; reazioni degli alcani:
alogenazione con Cl2 e Br2, richiamo al meccanismo ed orientamento, scala di reattività , stabilità
dei radicali liberi e relazione con la loro facilià di formazione, fattori che stabilizzano i radicali
liberi ed i radicali liberi incipienti, reattività e selettività . 5) Definizioni di stereochimica e di
stereoisomeria, dimostrazione che il C(sp3) è tetraedrico, cenni di polarimetria, gli enantiomeri, le
sostanze otticamente attive, la chiralità , il centro chirale, le miscele racemiche, la configurazione di
un C chirale, la convenzione di Cahn, Ingold e Prelog e le sue principali regole; la presenza di più di
un centro chirale, i diastereoisomeri e le loro proprietà , le strutture meso; formazione di un centro
chirale, sintesi ed attività ottica, reazioni di molecole chirali (da un punto di vista stereochimico), le
configurazioni relative, la formazione di un secondo centro chirale, la risoluzione dei racemi. 6)
Differenza tra reazioni omolitiche ed eterolitiche, gli alogenuri alchilici, loro nomenclatura e
metodo di preparazione dagli alcooli; la reazione di sostituzione nucleofila, generalità e
terminologia, cenni alla diversità tra basicità e nucleofilia, le reazioni SN1 ed SN2, la loro cinetica,
il loro meccanismo ed i vari fattori che li governano, l’ inversione di configurazione; i carbocationi:
struttura, stabilità , la trasposizione ed il suo meccanismo. 7) Gli alcooli, utilizzo, struttura,
classificazione, nomenclatura, formazione del legame ad idrogeno, fonti industriali. (Le
preparazioni di laboratorio nel capitolo degli alcheni). Reazioni: comportamento da acidi e da basi,
formazione di alogenuri alchilici, catalisi acida, meccanismi SN1 ed SN2 e fattori che li
influenzano, i solfonati alchilici, cenni al loro utilizzo, l’ ossidazione degli alcooli. Gli eteri,
nomenclatura, loro preparazione industriale e suo meccanismo; preparazione di laboratorio, la
sintesi di Williamson ed il suo meccanismo; scissione degli eteri con acidi alogenidrici, suo
meccanismo. 8) Alcheni, nomenclatura, geometria del doppio legame, isomeria Z ed E (cis/trans),
cenno al chimismo della visione. La preparazione degli alcheni, la reazione di eliminazione:
deidroalogenazione degli alogenuri alchilici, una eliminazione 1,2, suo meccanismo e sue
caratteristiche, sua cinetica, la E1 e la E2; orientamento e reattività nella E2, la regola di Saytzeff e
la sua spiegazione; il meccanismo della E1, confronto tra reazioni di eliminazione e di sostituzione,
la disidratazione degli alcoli, suo meccanismo, sua reversibilità , suo orientamento. La reazione di
addizione al doppio legame: l’ idrogenazione eterogenea ed omogenea, il calore di idrogenazione e
la sua relazione con la stabilità degli alcheni, il concetto di catalizzatore; l’ addizione di acidi
alogenidrici, il suo orientamento (regola di Markovnikov), definizione di reazione regioselettiva, la
reazione dell’acido bromidrico (anti-Markovnikov) e la spiegazione del suo orientamento, l’
autoossidazione dei composti organici; l’addizione di H2SO4 ed il suo orientamento; l’ addizione di
H2O ed il suo orientamento; meccanismo dell’addizione elettrofila al doppio legame, cenni alle sue
prove, trasposizione dei carbocationi, cenni alla reattività , razionalizzazione della regola di
Markovnikov; l’ addizione di alogeni ed il suo meccanismo, la formazione di aloidrine ed il suo
meccanismo, la dimerizzazione degli alcheni ed il suo meccanismo, l’ addizione di alcani ed il suo
meccanismo, la reazione di ossimercuriazione-demercuriazione, sua regiospecificità , la reazione di
idroborazione-ossidazione, sua regiospecificità e suo meccanismo, la formazione di 1,2-dioli. La
polimerizzazione radicalica degli alcheni, suo meccanismo, esempi di polimeri e di copolimeri,
effetti della ramificazione della catena, polimerizzazione secondo Ziegler-Natta. 9) Stereochimica
dell’ addizione di alogeni agli alcheni, definizioni di reazione stereoselettiva e di reazione
stereospecifica; le addizioni sin ed anti; stereochimica della E2, eliminazione sin ed anti.
Approfondimento dei concetti di coniugazione e risonanza tramite l’ alogenazione radicalica degli
alcheni; i radicali vinilici ed allilici, la trasposizione allilica; i dieni coniugati, struttura, proprietà e
stabilità ; l’ addizione elettrofila ai dieni coniugati, il carbocatione allilico, effetto della temperatura
su velocità ed equilibrio; la polimerizzazione radicalica dei dieni coniugati, la gomma naturale e la
vulcanizzazione. 10) Gli alchini ed il triplo legame C-C, struttura e reattività ; preparazioni
industriali, sintesi di laboratorio: deidroalogenazione dei dialogenuri alchilici, reazione degli
acetiluri metallici con alogenuri alchilici primari; reazioni degli alchini: addizione di idrogeno (sin
ed anti), addizione di alogeni, addizione di acidi alogenidrici, addizione di H2O e tautomeria chetoenolica; reazioni come acidi, acidità degli alchini. 11) I cicloalcani, nomenclatura, fonti industriali,
cenni ai metodi di sintesi, reazioni particolari dei piccoli anelli; il concetto di tensione di anello, i
calori di combustione e la scala di stabilità dei cicloalcani; conformazioni di: ciclobutano,
ciclopentano e cicloesano, legami assiali ed equatoriali, mobilità conformazionale del cicloesano,
esempio del cicloesano monosostituito; interazioni 1,3-diassiali, isomeria cis/trans nei cicloalcani;
analisi conformazionale e stereochimica dei cicloesani disostituiti, la conformazione a barca, l’
eliminazione E2 nei cicloesani, il metilene reattivo (carbene) e la cicloaddizione, eliminazioni 1,2
(eliminazioni) e 1,1 (ï•¡ eliminazioni); cenni alle molecole policicliche, gli eteri ciclici, cenni ai
crown ethers ed alla correlazione host-guest; gli epossidi, sintesi e reazioni: scissione acida e basica
e loro meccanismo, reazione con i reattivi di Grignard. 12) Il benzene, cenni storici, possibili
isomeri, la struttura di Kekulè, la reattività del benzene, la struttura del benzene, stima dell’ energia
di risonanza, l’orbitale molecolare del benzene, aromaticità ed antiaromaticità , regola di Huckel,
esempi di altri sistemi aromatici ed antiaromatici, la spiegazione della regola di Huckel attraverso
l’orbitale molecolare, il caso ciclopentadienilico; nomenclatura del benzene, cenno brevissimo al
naftalene ed ad alcuni sistemi aromatici policiclici. La sostituzione elettrofila aromatica, generalità ,
orientamento, reattività e loro origine, gruppi attivanti e disattivanti all’elettrofila aromatica per
effetto induttivo e per risonanza, il caso degli alogeni, parziale variabilità nell’orientamento, le
reattività relative, orientamento nei benzeni disostituiti, cenni di progettazione di sintesi;
meccanismo generale della sostituzione elettrofila aromatica, lo ione arenio (intermedio di
Wheland, complesso ); in particolare: meccanismo delle reazioni di nitrazione, solfonazione,
alchilazione di Friedel-Crafts ed alogenazione. 13) Gli areni, struttura e nomenclatura, loro sintesi:
alchilazione di Friedel-Crafts e suoi limiti, trasformazioni della catena laterale; reazioni degli areni:
idrogenazione, ossidazione, sostituzioni (via elettrofila aromatica) nell’ anello, sostituzioni nella
catena laterale via alogenazione radicalica, il radicale benzilico e la sua stabilità ; gli
alchenilbenzeni, preparazioni industriali e di laboratorio, l’ effetto della coniugazione; cenni alle
loro reazioni, con osservazione degli orientamenti nell’addizione di HBr. 14) Alcune spettroscopie
utilizzate in chimica organica (gli argomenti di questa sezione sono tutti trattati come cenni);
ottenimento ed utilizzazione dello spettro di massa, l’equazione di formazione dello ione
molecolare, la frammentazione, gli effetti isotopici; la radiazione elettromagnetica, relazioni tra
lunghezza d’ onda, frequenza ed energia; generalità di spettroscopia IR, vibrazioni di stretching e
di bending, unità di misura, utilizzo con riferimento al riconoscimento di gruppi funzionali; la
spettroscopia NMR, generalità , lo spin nucleare ed il fenomeno della risonanza, l’ importanza dell’
intensità del campo magnetico, utilizzo della spettroscopia NMR, 1H NMR ed i suoi parametri
(chemical shift, accoppiamento di spin, intensità relativa dei segnali), la scala  e la misura del
chemical shift, esempi di sistemi di spin del I ordine; il 13C NMR, sue caratteristiche e differenze
con l’1H NMR, suo utilizzo. 15) Il gruppo carbonilico, aldeidi e chetoni, loro nomenclatura; metodi
di preparazione delle aldeidi: ossidazione degli alcooli primari, ossidazione dei metil benzeni,
riduzione dei cloruri degli acidi, reazione di Reimer-Tiemann; metodi di preparazione dei chetoni:
ossidazione alcooli secondari, acilazione secondo Friedel-Crafts, con meccanismo, reazione dei
cloruri degli acidi con i cupro-organici, sintesi acetacetica, con meccanismo. La reazione di
addizione nucleofila al carbonile: meccanismo generale, incluso il caso con catalisi acida. Le
reazioni del gruppo carbonilico: varie ossidazioni del gruppo aldeidico, reazione aloformica dei
metil-chetoni, riduzione catalitica e con idruri, secondo Clemmensen e secondo Wolff-Kischner
(cenno), addizione di HCN, con meccanismo, addizione di derivati dell’ammoniaca, con
meccanismo, addizione di alcooli, emiacetali ed acetali, con meccanismo, reazione di Cannizzaro,
semplice, incrociata, con meccanismo, addizione di reattivi di Grignard, inclusa la reazione con gli
ossirani, con meccanismo,
-alogenazione dei chetoni, condensazione aldolica, inclusa
disidratazione (crotonica) ed aldolica incrociata, meccanismo, reazione di Wittig e formazione delle
ilidi (in particolare le ilidi del P), ossidazione con HIO4. 16) Acidi carbossilici e loro derivati, loro
nomenclatura; dissociazione degli acidi (in soluzione acquosa), fonti industriali degli acidi
carbossilici; preparazioni di laboratorio degli acidi carbossilici: ossidazione degli alcooli primari,
ossidazione degli areni, carbonatazione dei reattivi di Grignard, idrolisi dei nitrili, sintesi malonica
con meccanismo; reazioni degli acidi carbossilici: acidità e formazione di sali, formazione dei
derivati e sostituzione nucleofila acilica, con meccanismo, con particolare riferimento all’ idrolisi
sia con catalisi acida che basica: cloruri e loro reazioni principali; anidridi e loro reazioni principali;
esteri, reazioni principali, compresa reazione con i reattivi di Grignard, idrolisi acida e basica e loro
meccanismo, riduzione catalitica e con idruri, condensazione di Claisen; ammidi e loro reazioni
principali, compresa la degradazione di Hofmann; riduzione degli acidi carbossilici,
alogenazione degli acidi carbossilici (reazione di Hell-Vohlard-Zelinsky) con meccanismo; cenni
sugli acidi bicarbossilici e sulla loro sintesi, cenni sui derivati dell’ acido carbonico. 17) Le ammine,
classificazione, nomenclatura e cenni alla loro stereochimica (l’ inversione piramidale); basicità
delle ammine, scarsa basicità delle ammidi, comportamento acido delle ammine; preparazioni
industriali delle ammine; preparazioni di laboratorio delle ammine: riduzione dei nitroderivati,
sintesi dagli alogenuri alchilici, sintesi di Gabriel, ammirazione riduttiva, riduzione dei nitrili;
reazioni delle ammine: salificazione, preparazione delle ammidi, eliminazione di Hofmann e suo
orientamento, cenni alla formazione delle enammine, reazione con HNO2; i sali di diazonio ed i
loro utilizzo nella chimica aromatica, inclusa la reazione di copulazione. 18) I fenoli, nomenclatura,
carattere acido; cenni di sintesi industriale ma dettaglio della sintesi del fenolo via idroperossido di
cumene; preparazioni di laboratorio dei fenoli; reazioni dei fenoli, compresa la reazione di Kolbe;
scissione degli eteri alchilarilici, cenni brevissimi alla reazione fenolo-formaldeide ed alla bachelite
ed ai caliciareni, cenni sui chinoni. 19) La sostituzione nucleofila aromatica (esclusa la sostituzione
via benzino), importanza dei sostituenti elettronattrattivi, suo meccanismo e confronto con la SN2
alifatica, reattivitÃ
insaturi, l’ addizione nucleofila nei com
-insaturi, confronto fra le due
addizioni, l’ addizione di Michael, la reazione di Diels-Alder (generalità , senza giustificazione
teorica ma con cenni alla sua stereochimica). 20) Generalità sui composti eterociclici aromatici con
cenni di nomenclatura; struttura di pirrolo, furano e tiofene (triade) ed alcune loro sintesi industriali;
cenni alla sostituzione elettrofila nella triade, preferenza dell’ attacco alla posizione 2, la reazione di
Reimer-Tiemann nel pirrolo; la piridina, struttura, basicità e confronto con la (mancata) basicità del
pirrolo, cenni alla sostituzione elettrofila nella piridina (orientamento e reattività ), cenni alla
sostituzione nucleofila nella piridina (orientamento e reattività ), reazioni di Cicibabin e di
arilazione. 21) I lipidi, definizione e divisione in lipidi esterei idrolizzabili ed in lipidi non
idrolizzabili; cere, grassi (saturi ed insaturi), saponi e detergenti ed il loro meccanismo d’azione;
cenni brevissimi su fosfolipidi, prostaglandine e steroidi.