Metodologia Biochimica 2002 – Lez. 6
1
TECNICHE IMMUNOCHIMICHE
Le cellule fondamentali del sistema immunitario animale sono i linfociti. Queste cellule
ricircolano costantemente nell'organismo: dal sangue alla linfa, agli organi linfatici e da
questi di nuovo nel sangue, assicurando un costante controllo di tutto il corpo. Esistono
due classi di linfociti:
linfociti T: sono coinvolti nella risposta immunitaria cellulare o cellulo-mediata, hanno
un’ipersensibilità ritardata e si occupano della produzione di linfochine; stimolano o
sopprimono la produzione e la funzione di altre cellule T.
linfociti B (quelli che più ci interessano in questa sede): sono coinvolti nella risposta
immunitaria umorale, hanno il compito di sintetizzare immunoglobuline o anticorpi
solitamente sotto il controllo di cellule T regolatorie e si differenziano in plasmacellule.
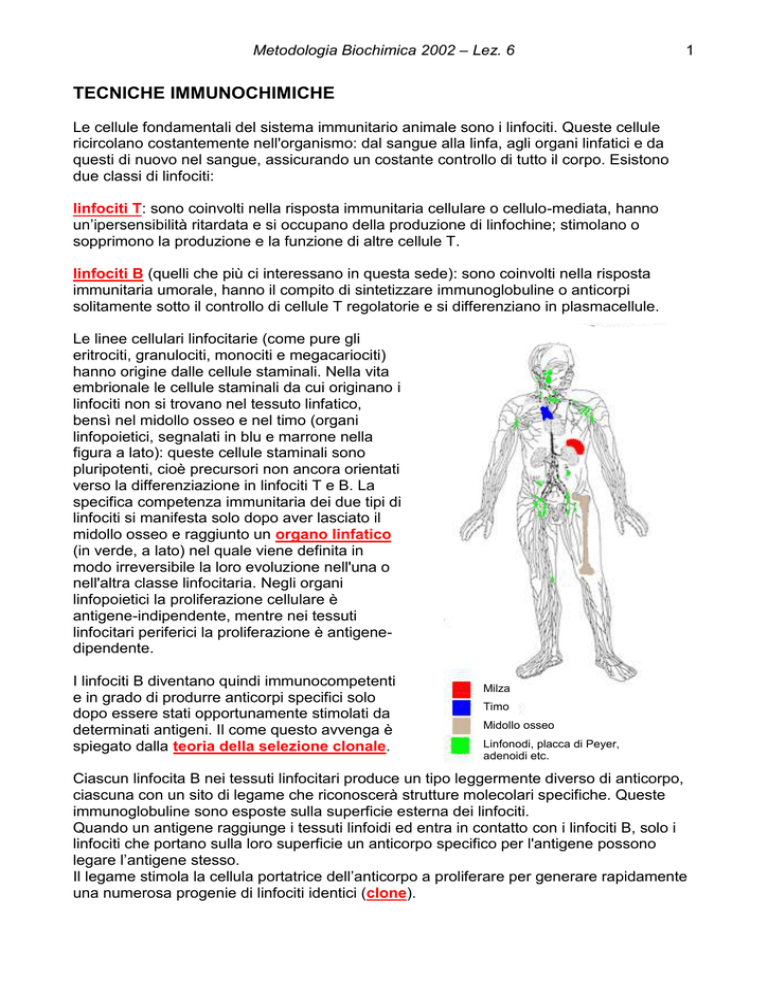
Le linee cellulari linfocitarie (come pure gli
eritrociti, granulociti, monociti e megacariociti)
hanno origine dalle cellule staminali. Nella vita
embrionale le cellule staminali da cui originano i
linfociti non si trovano nel tessuto linfatico,
bensì nel midollo osseo e nel timo (organi
linfopoietici, segnalati in blu e marrone nella
figura a lato): queste cellule staminali sono
pluripotenti, cioè precursori non ancora orientati
verso la differenziazione in linfociti T e B. La
specifica competenza immunitaria dei due tipi di
linfociti si manifesta solo dopo aver lasciato il
midollo osseo e raggiunto un organo linfatico
(in verde, a lato) nel quale viene definita in
modo irreversibile la loro evoluzione nell'una o
nell'altra classe linfocitaria. Negli organi
linfopoietici la proliferazione cellulare è
antigene-indipendente, mentre nei tessuti
linfocitari periferici la proliferazione è antigenedipendente.
I linfociti B diventano quindi immunocompetenti
e in grado di produrre anticorpi specifici solo
dopo essere stati opportunamente stimolati da
determinati antigeni. Il come questo avvenga è
spiegato dalla teoria della selezione clonale.
Milza
Timo
Midollo osseo
Linfonodi, placca di Peyer,
adenoidi etc.
Ciascun linfocita B nei tessuti linfocitari produce un tipo leggermente diverso di anticorpo,
ciascuna con un sito di legame che riconoscerà strutture molecolari specifiche. Queste
immunoglobuline sono esposte sulla superficie esterna dei linfociti.
Quando un antigene raggiunge i tessuti linfoidi ed entra in contatto con i linfociti B, solo i
linfociti che portano sulla loro superficie un anticorpo specifico per l'antigene possono
legare l’antigene stesso.
Il legame stimola la cellula portatrice dell’anticorpo a proliferare per generare rapidamente
una numerosa progenie di linfociti identici (clone).
Metodologia Biochimica 2002 – Lez. 6
Questa risposta primaria è
coadiuvata da una specifica
classe di cellule T dette cellule
T helper, che riconoscere un
antigene legato e possono,
dopo questo riconoscimento,
stimolare la proliferazione
dell’appropriato linfocita B
trasmettendogli una proteina
segnale, l’interleuchina 2.
2
Diversi cloni di linfociti
B
Un antigene si lega alla
cellula B che espone sulla sua superficie gli anticorpi affini a
quell’antigene
I linfociti appartenenti al clone
così ottenuto evolvono
rapidamente in plasmacellule
produttrici dell'anticorpo
specifico per l'antigene
attivatore.
Le plasmacellule sono
morfologicamente simili ai linfociti, ma
producono anticorpi solubili. Inoltre,
sono più ricche di citoplasma,
all’interno del quale vi è un reticolo
endoplasmatico molto sviluppato,
espressione di un’elevata sintesi
proteica inerente la produzione di
anticorpi.
La cellula è stimolata a moltiplicarsi ed
origina plasmacellule, che producono
l’anticorpo in forma solubile.
Non tutte le cellule dei linfociti B evolvono in plasmacellule, alcune di esse rimangono in
uno stato di latenza dopo essere state sensibilizzate e possono indurre una risposta
immunitaria molto rapida nel caso di un successivo contatto con lo stesso antigene.
Queste cellule sono depositarie della cosiddetta “memoria immunitaria”.
ANTIGENI
L’antigene, come suggerito dalla descrizione precedente, è semplicemente una molecola
che, introdotta in un animale per via parenterale, è in grado di attivare la risposta
anticorpale. Gli antigeni sono tipicamente macromolecole solubili in acqua e che
possiedono un alto grado di complessità chimica. Maggiore il peso molecolare, maggiori le
probabilità che funzionino come antigeni. Le proteine eterologhe (cioè, provenienti da
organismi diversi dall’animale trattato) di massa molecolare >10000 sono generalmente
degli ottimi antigeni, ma i piccoli peptidi non sono di solito antigenici. Le glicoproteine e i
polisaccaridi delle pareti cellulari batteriche sono in genere antigenici, ma i polisaccaridi
più semplici, come l’eparina (massa molecolare 17000) invece no.
L'epitopo rappresenta quella porzione di antigene riconosciuta dall'anticorpo; un antigene
può avere sulla sua superficie uno o più epitopi diversi oppure anche identici tra loro
(proteine multimeriche).
Gli apteni sono piccole molecole (ad es., farmaci o pesticidi) che non riescono, da soli, a
provocare una risposta immunitaria. Queste molecole sono però in grado di provocare una
risposta immunitaria in seguito ad un loro legame con proteine carrier (ad esempio,
l’albumina).
Metodologia Biochimica 2002 – Lez. 6
3
ANTICORPI
Gli anticorpi, prodotti dalle plasmacellule, appartengono al gruppo di proteine note come
immunoglobuline (Ig), classificabili in cinque diverse classi: IgG, IgA, IgM, IgE, e IgD.
Gli anticorpi strutturalmente
più semplici sono le IgG,
Fab
costituite da quattro catene
Catene leggere
polipeptidiche: due catene
25 KD
Hinge
220 aa
leggere identiche tra di loro e
due catene pesanti anch'esse
Catena
identiche tra loro.
leggera
Le catene leggere sono costituite da una regione variabile (VL; in giallo nella figura)
Catene pesanti
Catena
costituita da circa 110 residui
50 KD
pesante
nella porzione ammino termi440 aa
nale della molecola e da una
regione costante (CL; in azzurro) costituita da un
centinaio di amminoacidi nella
porzione carbossi terminale.
Le catene pesanti possiedono anch’esse una regione variabile di circa 110 amminoacidi
(VH) nella porzione ammino terminale e tre regioni costanti (CH1, CH2, CH3) nella regione
carbossi-terminale formate complessivamente da circa 330 amminoacidi.
Le regioni variabili sono caratterizzate da un’elevata eterogeneità strutturale legata alla
funzione anticorpale svolta dalle IgG. All’interno delle regioni VL e VH si trovano intersperse delle sequenze amminoacidiche ipervariabili (chiamate anche "complementary
determining regions", CDR): che determinano la specificità di legame dell’anticorpo.
Le catene leggere e quelle pesanti presentano, sia nelle regioni variabili sia in quelle costanti, legami disolfuro intracatena. Inoltre le due catene pesanti sono legate covalentemente tra loro da due ponti disolfuro preceduti da una regione cerniera (hinge), che permette una certa flessibilità delle due catene polipeptidiche e quindi una certa capacità di
adattamento all’antigene.
La regione di IgG detta Fab è direttamente coinvolta nel legame con l’antigene ed è costituita dall’intera catena leggera e dalle regioni VH e CH1 della catena pesante. Trattando le
immunoglobuline con papaina, è possibile rompere la catena polipeptidica H a livello
dell’hinge, staccando di fatto i 2 Fab dal resto delle catene pesanti (che rimangono unite
tra loro grazie ai legami disolfuro intercatena,
formando la cosiddetta porzione Fc).
La risoluzione della struttura cristallografica di alcuni
complessi immunoglobulina-antigene ha dimostrato
che la regione variabile di una catena leggera
interagisce con quella di una catena pesante e
l'insieme origina un dominio variabile, globulare. La
regione CL e la corrispondente regione CH1 formano
un dominio costante, globulare anch’esso, mentre le
restanti regioni costanti delle catene pesanti danno
origine ad altri due domini costanti. Così ogni singola
molecola di IgG contiene due domini variabili e
quattro domini costanti con una flessibilità limitata tra
i vari domini.
Metodologia Biochimica 2002 – Lez. 6
4
Altri tipi di immunoglobuline
(pentamero)
(dimero)
Ponte
disolfuro
Regione cerniera
Catena J
Catena J
Le IgG rappresentano circa l’80% delle immunoglobuline presenti nel siero, e sono gli
anticorpi utilizzati prevalentemente nelle tecniche immunochimiche. Gli altri tipi di anticorpi
sono mostrati nella figura sopra.
Le immunoglobuline D (IgD) hanno una funzione ancora abbastanza misconosciuta, ma
sono espresse superficialmente dai linfociti B immaturi e sembrano coinvolte nel processo
di maturazione dei linfociti stessi (in pratica, inibiscono lo sviluppo dei linfociti quando
riconoscano degli autoantigeni, prevenendo malattie autoimmuni).
Le immunoglobuline E (IgE) sono associate ai mastociti e coinvolte nei processi di
resistenza ai parassiti e nelle allergie.
Le immunoglobuline M (IgM) sono la prima classe di anticorpi che compare nel siero
dopo l’iniezione di un antigene; sono costituite da cinque subunità (cinque molecole di
IgG) unite tra loro mediante ponti disolfuro tra le catene pesanti di subunità contigue e da
una catena supplementare detta catena J legata con ponti disolfuro a due catene pesanti.
Si ritiene che la polimerizzazione delle IgM inizi proprio dalla catena J.
Le immunoglobuline A (IgA) sono immunoglobuline particolarmente importanti in quanto
presenti nelle secrezioni. Una molecola di IgA è dimerica e i due monomeri sono
contrapposti e legati con ponti disolfuro; tra le porzioni Fc contrapposte è presente una
catena J ausiliaria e anche un polipeptide aggiuntivo, avvolto a spirale, detto pezzo
secretorio. Le IgA sono presenti anche nel colostro, il primo latte secreto dalla mammella.
Metodologia Biochimica 2002 – Lez. 6
5
INTERAZIONE ANTICORPO-ANTIGENE
L’affinità dell’antigene per l’anticorpo è una misura della forza di interazione tra una
molecola di antigene ed una di anticorpo, valutata in termini di semplice equilibrio:
Ka
+
Ab
(anticorpo)
Ag
(antigene)
Ab-Ag
(complesso)
L’affinità, espressa dalla costante Ka (=1/Kd) varia in un
Interazioni
idrofobiche
ampio range (105-1012 M-1), in dipendenza dal tipo
specifico di antigene e di anticorpo, e quindi dal numero e
tipo di interazioni che si formano tra antigene ed epitopo. Interazioni di van
der Waals
Ovviamente anche la temperatura, il pH, la forza ionica etc
hanno un’influenza sull’equilibrio.
Legami
ionici
La reazione completa tra Ag ed Ab è invece descritta da
Ponti H
un parametro detto avidità, che è la misura della stabilità
globale dei complessi antigene-anticorpo, e dipende da:
- Affinità (vista sopra)
- Valenza dell’anticorpo per l’antigene e viceversa (considerate che gli anticorpi sono
normalmente multivalenti. Una molecola IgG contiene due siti di legame per il suo
epitopo; una IgM ne contiene dieci. Inoltre, molti antigeni sono a loro volta multimerici,
e presentano molte copie dello stesso epitopo.)
- Arrangiamento geometrico e spaziale dei componenti che interagiscono (se l’antigene
è molto grande, può impedire che l’anticorpo si leghi a più di un epitopo etc.).
- Formazione di macroaggregati (lattici). Se si utilizzano miscele di anticorpi (sieri
policlonali) si possono avere sullo stesso antigene epitopi multipli riconosciuti da diversi
anticorpi, con formazione di un lattice in cui la stabilità intrinseca di ciascun legame
anticorpo-epitopo è la stessa che si avrebbe in isolamento, ma poiché l’antigene è
tenuto insieme da altre interazioni, la dissociazione è globalmente sfavorita.
La formazione di questi
aggregati è alla base del
fenomeno della
immunoprecipitazione,
che consiste nella
precipitazione
Zona di equiEccesso di
Eccesso di
dell’anticorpo da parte
valenza
anticorpo
antigene
dell’antigene (o viceversa). La precipitazione
è massima per concentrazioni di anticorpo ed
Anticorpo
antigene che consentano
precipitato
la formazione degli
aggregati.
L’avidità di un anticorpo per
l’antigene è l’effettivo determinante del successo delle
tecniche immunochimiche.
Antigene aggiunto
Metodologia Biochimica 2002 – Lez. 6
6
ANTICORPI POLICLONALI (SIERO)
Gli anticorpi usati nelle tecniche
Antigene
Siero
immunochimiche vengono prodotti tramite
immunizzazione di animali di laboratorio
(soprattutto conigli e topi) contro un determinato
antigene. L’operazione è seguita dal prelievo di
sangue dell’animale e dall’estrazione del siero,
che, se la immunizzazione ha avuto successo,
conterrà molti tipi diversi di immunoglobuline anti-antigene, diretti ciascuno verso un
differente epitopo.
La fase di immunizzazione è diversa da antigene ad antigene e da animale ad animale,
ma consiste generalmente in iniezioni successive di antigene disciolto in soluzione
fisiologica ed eventualmente addizionato di adiuvanti. Gli adiuvanti sono sostanze che
provocano un rilascio lento dell’antigene ed aumentano la risposta infiammatoria. Un tipo
classico è l’adiuvante di Freund (una miscela di oli e di frammenti di parete di
Micobacterium tuberculosis) completo o incompleto (privo di micobatteri inattivati).
Esempio: protocollo di immunizzazione di topi con un antigene umano.
Fase
Antigene iniettato
Soluzione
Adiuvante di Freund completo
N° di
iniezioni
4
1
40-100 g in 100 l
2
3
Ogni 7 gg
40-100 g in 100 l
Adiuvante di Freund completo
4
Ogni 15 gg
100 g in 100 l
Soluzione fisiologica
1
72 h prima
del prelievo
L’uso di un adiuvante e la esposizione ripetuta
dell’animale all’antigene (serie di iniezioni)
consente di innalzare moltissimo la risposta
anticorpale. Come si vede, il protocollo prevede
il prelievo del siero dopo un’esposizione
all’antigene di circa 100 giorni. Questo permette
di raggiungere nel sangue i massimi livelli
anticorpali (stato di iperimmunità).
Quando
Tempo
Gli anticorpi del siero presentano eterogeneità nelle regioni variabili (non ci sono solo
IgG…) e nelle regioni costanti. Questa eterogeneità deriva ovviamente dal fatto che la gli
anticorpi del siero derivano da molti differenti cloni di plasmacellula, per cui si parla anche
di anticorpi policlonali. La eterogeneità di questi anticorpi può essere ridotta, ad esempio
mediante una cromatografia di affinità in cui un antigene viene immobilizzato su una resina
- in questo caso si selezioneranno solo gli anticorpi ad elevata specificità verso quel
particolare antigene, e soprattutto verso gli epitopi lasciati più esposti dopo l’immobilizzazione dell’antigene stesso. Anche questi anticorpi saranno comunque ancora eterogenei.
Metodologia Biochimica 2002 – Lez. 6
7
ANTICORPI MONOCLONALI
Gli anticorpi monoclonali derivano da un unico clone plasmacellulare e sono quindi identici
nella struttura delle regioni costante e variabile. La tecnologia per la produzione di
anticorpi monoclonali, messa a punto negli anni ’70, prevede l’isolamento di una singola
plasmacellula che produca il tipo desiderato di IgG e la sua successiva fusione in vitro con
cellule di mieloma (tumore delle cellule B) per dare un ibridoma: una cellula immortale e
che produce elevate quantità della specifica IgG desiderata.
Ottenimento delle plasmacellule. Topo inoculato
con l’antigene
Si usano plasmacellule di topo.
opportuno
L’animale viene immunizzato
seguendo un protocollo simile a
Plasmacellule
isolate dalla milza
quello visto per i policlonali.
L’ultima immunizzazione, in cui si
omette l’uso dell’adiuvante di
Freund, viene eseguita 72 ore prima
del sacrificio dell'animale.
Quest'ultima immunizzazione serve a
sincronizzare il ciclo cellulare delle
Fusione cellulare in
plasmacellule con quello delle cellule
presenza di PEG
mielomatose, così che entrambi i tipi
cellulari siano nella fase S del ciclo.
La milza viene asportata e frantumata finemente (per esempio facendola
passare attraverso l’ago di una
siringa) e se ne ottengono i linfociti B
maturi (fino a circa 108 cellule).
Selezione e clonaggio
degli ibridomi milzamieloma
Cellule di
mieloma coltivate
in vitro
Cloni che producono
un unico tipo di
anticorpo
Anticorpi monoclonali
dal terreno di coltura
Fusione. I linfociti B maturi vengono
mescolati con cellule di mieloma murino ed esposte per tempi molto brevi
(tipicamente 1 min) ad una alta concentrazione (40-50%) di polietilenglicole (PEG) che
favorisce la fusione tra cellule diverse. Si formano cellule ibride a corredo cromosomico
aneuploide a cui contribuisce materiale genetico dei due stipiti cellulari.
La linea mielomatosa utilizzata per produrre gli ibridi deve avere due caratteristiche:
1) non deve produrre immunoglobuline, per ovvi motivi.
2) non deve essere in grado di esprimere il gene per l’enzima ipoxantina guanina
fosforibosil-transferasi (HGPRT), per consentire una successiva selezione degli ibridi
milza-mieloma.
Sintesi ‘ex novo’
Recupero
2
Aminopterina
Metodologia Biochimica 2002 – Lez. 6
8
Selezione degli ibridi milza-mieloma.
Milza-mieloma
MielomaMilza-milza
In un terreno di coltura le plasmacelmieloma
lule normali producenti gli anticorpi
moriranno per apoptosi nel giro di
alcuni giorni, le cellule ibride linfocitimieloma continueranno a proliferare,
Le plasmacellule di
Le cellule mielomatose
milza
(e gli ibridi milzama soprattutto cresceranno e prevar(e gli ibridi mielomamilza)
muoiono dopo
ranno le cellule di mieloma appartemieloma) non
alcuni
giorni
in vitro per
posseggono l’enzima
nenti alla linea cellulare originaria.
apoptosi
HGPRT e muoiono nel
Per eliminare le cellule di mieloma,
terreno selettivo HAT
deficitarie dell’enzima HPGRT, si
utilizza un terreno di coltura contenente un inibitore della diidrofolato
reduttasi: l’aminopterina, che inibisce
la via di sintesi de novo delle basi
puriniche e pirimidiniche. In questo
terreno (HAT) le cellule di mieloma e
Terreno selettivo HAT
gli ibridi mieloma-mieloma non solo
non possono sintetizzare i nucleotidi
purinici de novo (causa la presenza
di aminopterina) ma neppure tramite
la via di recupero, perché deficitari
dell’enzima HGPRT – quindi
muoiono. Potranno sopravvivere solo
le cellule che possiedono l’HGPRTcellule ibride che hanno ricevuto dai
linfociti B di milza il gene per questo
enzima.
Gli ibridi ottenuti sono tra loro molto
eterogenei; alcuni possono non essere
stabili e morire, altri possono essere
stabili ma non produrre Ig, altri ancora possono produrre anticorpi non utili, ma tra tutti questi ci saranno anche gli ibridi capaci
di produrre gli anticorpi specifici per l’antigene utilizzato nel processo di immunizzazione.
Screening e clonaggio. Per ‘pescare’ da questa moltitudine le cellule giuste si effettua
uno screening, cioè si seminano gli ibridi ottenuti su piastre apposite (dotate di molti pozzetti) e poi si valuta la specificità e la concentrazione degli anticorpi prodotti in ogni pozzetto utilizzando metodi sensibili quali l’ELISA indiretta (vedi oltre). Da questa valutazione si
può dedurre in quale pozzetto è presente l'ibrido con la specificità desiderata.
Una volta trovati i pozzetti positivi, le cellule corrispondenti vengono sottoposte alla "limiting dilution", sono cioè diluite in un elevato volume di terreno di coltura che viene poi ridistribuito in diversi pozzetti; questa operazione deve essere ripetuta almeno tre volte, con
l’obiettivo di ottenere in un pozzetto una singola cellula, da cui poi si origina una colonia di
cellule. Questo corrisponde al clonaggio della cellula producente un singolo anticorpo.
Sulle diverse colonie cellulari ottenute si ripete lo screening più volte in quanto le cellule
producenti anticorpi possono non essere stabili e portare ad un decadimento del titolo di
anticorpi. Quando le cellule produrranno un titolo costante di anticorpi si potrà essere certi
di aver selezionato un clone. Per verificare che in un pozzetto venga prodotto un unico
anticorpo omogeneo si può effettuare una elettroforesi in condizioni native di un aliquota
del terreno di coltura.
Metodologia Biochimica 2002 – Lez. 6
9
TECNICHE DI IMMUNOPRECIPITAZIONE
Abbiamo visto come la reazione antigene-anticorpo può dar luogo in vari casi (soprattutto
per anticorpi policlonali) alla formazione di aggregati di elevatissimo peso molecolare che
diventano insolubili nelle soluzioni acquose. Abbiamo anche visto che questi immunoprecipitati si formano quando antigene e anticorpo sono presenti in determinati rapporti
stechiometrici. Poiché la quantità di precipitato può essere dosata mediante varie tecniche
(centrifugazione, turbidometria…) si può utilizzare l’immunoprecipitazione per evidenziare
e titolare anticorpi ed antigeni. Quando l’immunoprecipitazione avviene all’interno di un gel
si parla più propriamente di immunodiffusione. Sono stati messi a punto diversi metodi di
immunodiffusione che possono essere utilizzati per il dosaggio di antigeni. Tra questi
l'immunodiffusione radiale semplice, l'immunodiffusione doppia e l'immunoelettroforesi.
L'immunodiffusione radiale semplice consiste nello scavare dei pozzetti in un terreno di
agar in cui sia stato disciolto un anticorpo specifico. Dentro i pozzetti vengono poste
soluzioni contenenti varie diluizioni di un dato antigene. Man mano che l'antigene diffonde
nell'agar si forma un precipitato ad anello che si muove verso la periferia, divenendo
stazionario nella zona di equivalenza. Il diametro dell'anello è funzione della concentrazione di antigene. Ponendo in un grafico il diametro dell'anello (l'area del cerchio) al
punto di equivalenza contro la concentrazione di antigene, si ottiene una retta di taratura
che consente di determinare la concentrazione dell'antigene in un campione ignoto.
Immunodiffusione doppia (metodo di Ouchterlony). Si utilizza un gel d’agar nel quale
sono scavati diversi pozzetti equidistanti da un pozzetto centrale. Nel pozzetto centrale si
deposita l’anticorpo e nei pozzetti attorno i diversi antigeni. Anticorpo ed antigene diffondono nell’agar, in corrispondenza del punto di equivalenza si forma l’immunoprecipitato,
che può essere meglio evidenziato mediante colorazione con Coomassie Brilliant Blue.
Questa tecnica permette di stabilire
se gli antigeni depositati nei diversi
pozzetti sono o non sono identici o
se hanno epitopi in comune. Si ha
AB
AB
AC
BD
una reazione di identità tra più antigeni contenenti identici epitopi
quando le bande di precipitazione si
fondono lungo una linea continua
(caso a). Si ha invece una reazione
di non identità quando il pozzetto
centrale contiene anticorpi contro
AB
AC
entrambi gli antigeni, ma questi non
hanno un epitopo in comune: si
ottengono in questo caso due bande
di precipitazione che si intersecano
(caso b). Si ha infine una reazione di
identità parziale quando i due
antigeni hanno almeno un epitopo in
comune, ma gli anticorpi utilizzati riconoscono sia l’epitopo in comune sia un altro epitopo
proprio di uno solo degli antigeni (caso c). La posizione relativa della banda di
precipitazione fornisce anche una stima semiquantitativa della concentrazione di antigene:
infatti la distanza della banda di precipitazione dal pozzetto contenente l’antigene è
proporzionale alla quantità di antigene presente: tanto maggiore è la quantità di antigene
tanto maggiore è la distanza della banda.
a
c
b
Metodologia Biochimica 2002 – Lez. 6
10
L'immunoelettroforesi è una tecnica che
unisce la specificità della reazione di
immunoprecipitazione con la separazione
di molecole mediante elettroforesi.
Solitamente si utilizza un gel d'agarosio su
cui si praticano due incisioni parallele e
alcuni pozzetti.
Nei pozzetti si depositano gli antigeni
(indicati come HS e HSA nel caso a lato;
notate che HS rappresenta una miscela di
antigeni che include HAS) e si fa avvenire
l'elettroforesi. Al termine dell'elettroforesi,
le due incisioni parallele sono riempite con
un antisiero opportuno e si lascia in
incubazione per una notte. Gli antigeni
diffondono radialmente e gli anticorpi
diffondono lateralmente dando quindi
luogo ad archi di precipitazione. Questa
tecnica può essere usata per valutare la
presenza di determinati antigeni in un
siero o estratto, nonché per valutare la
purezza di una preparazione di antigene
etc.
L'immunoelettrodiffusione, chiamata anche immunoelettroforesi quantitativa o "rocket
elettroforesi" è una tecnica concettualmente simile alla immunodiffusione radiale semplice,
ma che implica un processo elettroforetico. Come nell'immunodiffusione radiale semplice,
si impiega un gel di agarosio in cui sia presente un determinato anticorpo.
In questa matrice vengono scavati dei piccoli pozzetti nei quali viene posto l’antigene
d’interesse. L’antigene deve avere un pI sufficientemente basso da garantirgli una carica
decisamente negativa al pH del gel; l’anticorpo, invece, dovrebbe avere carica
preferibilmente nulla o positiva.
Applicando una corrente continua gli antigeni
migrano verso l'anodo e incontrano gli anticorpi
che si muovono invece verso il catodo; quando
antigene e anticorpo avranno raggiunto
l'equivalenza stechiometrica si formeranno gli
immunoprecipitati insolubili che daranno archi
di precipitazioni vagamente simili a missili – da
cui il nome della tecnica.
Più l'antigene è concentrato nel pozzetto, più
alto sarà il suo arco di precipitazione. Ponendo
in grafico l'altezza degli archi contro la
concentrazione si otterrà una retta di taratura
che servirà per determinare la concentrazione
di un antigene in un campione ignoto.
Un limite della tecnica è, come detto, che
funziona solo per antigeni che abbiano un pI
abbastanza basso – non funziona con antigeni
alcalini o con miscele di antigeni.
Metodologia Biochimica 2002 – Lez. 6
11
DOSAGGIO RADIO IMMUNOLOGICO (RIA)
Questo metodo serve per la quantificazione (‘titolazione’) di antigeni in una soluzione a
concentrazione ignota. Il metodo è basato sulla competizione tra un antigene non marcato
e una quantità fissa dello stesso antigene radioattivo, per il legame con un numero
limitante e costante di siti anticorpali. Solitamente l’antigene viene marcato con iodio
radioattivo (in genere 125I), cercando di alterare il meno possibile la sua immunoreattività.
Per il RIA si utilizzano spesso anticorpi specifici legati ad una fase solida (ad es. sulle
pareti di una provetta). E’ necessario costruire prima di tutto una curva di taratura, a
questo scopo, si fanno reagire gli anticorpi (Ab) con una quantità nota di antigene marcato
(*Ag) e quantità crescenti di antigene non marcato (Ag). Si formano quindi complessi
Ag/Ab e *Ag/Ab; nel caso Ag sia in largo eccesso su *Ag si avrà dell’ Ag marcato libero.
Campione contenente
l’antigene (freddo)
Antigene marcato
(con 125I)
Campione non
contenente
l’antigene
Anticorpo specifico
fissato al fondo del
pozzetto
Poco 125I rimane
legato
Tutto lo 125I
rimane legato
La quantità di *Ag libero (ed eventualmente anche di *Ag legato) può essere facilmente
misurata recuperando il sovranatante. Si può quindi costruire la curva di taratura,
riportando la radioattività legata/radioattività libera contro la concentrazione nota di Ag.
Dalla curva di taratura si può poi calcolare la concentrazione di una soluzione contenente
un titolo sconosciuto di Ag.
Quando l’anticorpo non sia fissato su una fase solida ma libero in soluzione, si può
sempre ricorrere al RIA, ma occorre trovare modi per separare l’antigene legato da quello
non legato. L’antigene libero può essere separato mediante cromatografia a scambio
ionico, oppure adsorbimento al carbone attivato o alla silice. Il complesso Ag/Ab può
invece essere separato utilizzando un anticorpo che reagisca con l’anticorpo complessato
formando un precipitato oppure si può separare mediante precipitazioni con solventi o sali
opportuni.
Il RIA è un tipo di saggio che presenta elevata sensibilità ed elevata specificità. Presenta
tuttavia anche diversi inconvenienti:
-
Il pericolo radiologico legato all’uso di 125I (o 131I).
La durata breve dei reagenti (l’emivita dell’isotopo 125I è solo 60 gg…) obbliga a
marcature frequenti.
Reagenti ed apparecchiature (sistemi per la scintillazione) sono piuttosto costosi.
Per questi motivi, sono stati messi a punto altri tipi di saggi di laboratorio dove gli antigeni
sono marcati in altro modo (con tags fluorescenti o coniugazione con enzimi).
Metodologia Biochimica 2002 – Lez. 6
12
DOSAGGIO IMMUNOENZIMATICO (ELISA)
L'ELISA è una tecnica molto utilizzata, basata sulla coniugazione chimica di enzimi (quali
ad es. la fosfatasi alcalina o la perossidasi) con anticorpi o antigeni. L’attività di questi
enzimi è facilmente monitorabile e consente di quantificare la concentrazione di
complesso coniugato (‘marcato’) con facilità e precisione. A seconda del particolare
metodo utilizzato, l’ELISA può servire per il dosaggio di antigeni o anticorpi.
Anticorpi su fase solida
Trattamento con antigene
marcato (a titolo noto) e
antigene non marcato
(titolo ignoto). Lavaggio.
Aggiunta del
substrato
Misura dell’attività enzimatica
Metodo del doppio anticorpo. In questo
metodo, illustrato a lato, è un anticorpo
che deve essere coniugato con un enzima
indicatore.
Si fa reagire una soluzione ignota di
antigene con un anticorpo specifico legato
ad una fase solida, si lava e si aggiunge
un secondo anticorpo, marcato; (questo
anticorpo dovrà essere policlonale oppure
dovrà essere un anticorpo monoclonale
diverso da quello immobilizzato… capace
di riconoscere un diverso epitopo
dell'antigene).
Dopo un secondo lavaggio si aggiunge il
substrato dell'enzima. In questa tecnica,
l'attività enzimatica misurata sarà
direttamente proporzionale alla
quantità di antigene presente.
Metodo competitivo: presenta molte
analogie con il RIA. Si fa reagire una quantità
nota di antigene marcato con un enzima ed
una quantità ignota dello stesso antigene
libero, con uno specifico anticorpo legato ad
una fase solida (ad es., il fondo del pozzetto
di una piastra). Sul sito di legame
dell'anticorpo si crea competizione tra
l'antigene marcato e quello non marcato.
Dopo aver lavato il complesso con tampone,
si aggiunge il substrato dell'enzima e si
determina, mediante saggi colorimetrici o
spettrofotometrici, l'attività catalitica. L'attività
misurata in queste condizioni è proporzionale
alla frazione di antigene marcato presente
nella miscela. La differenza tra l'attività
misurata in presenza del campione e quella
misurata in una reazione di controllo in cui si è
omesso l'antigene “freddo” consente di risalire
alla concentrazione di antigene nel campione
ignoto.
Trattamento con
antigene (titolo
ignoto). Lavaggio.
Trattamento con secondo
anticorpo (marcato con un
enzima). Lavaggio.
Aggiunta del
substrato
Misura dell’attività enzimatica
Metodologia Biochimica 2002 – Lez. 6
13
Metodo ELISA indiretto: serve per titolare un anticorpo, anziché un antigene.
Il materiale da dosare (ad es., un siero umano) viene fatto reagire con l’apposito antigene
legato ad una fase solida.
Dopo reazione del siero con l’antigene immobilizzato, il materiale che non si è legato viene
rimosso mediante lavaggio.
Si aggiunge poi un anticorpo anti-IgG (ad es., se il siero era umano, si può aggiungere un
anticorpo estratto da un animale di laboratorio immunizzato contro le porzioni costanti di
IgG umane) coniugato con un enzima. Si lava di nuovo e si aggiunge substrato
dell’enzima: l’attività misurata sarà proporzionale alla quantità di anticorpo specifico
presente nel siero originale.
E’ un tipo di saggio molto usato in diagnostica. Ad esempio, alcuni test per evidenziare la
presenza nel sangue di anticorpi contro HIV utilizzano l’ELISA indiretta (figura sotto).
Test ELISA indiretto per la ricerca di IgG anti-HIV1
Albumina
Proteine di HIV
Siero
Piastra per ELISA
Anticorpi anti-umani
coniugati con fosfatasi
Aggiunto substrato della
fosfatasi; sviluppo di
colore.
Metodologia Biochimica 2002 – Lez. 6
14
WESTERN BLOTTING
Miscela di proteine
Questo sistema combina la
risoluzione dell’elettroforesi
con la sensibilità della
rivelazione immunochimica.
Le bande proteiche da un gel
in cui sia avvenuta la
separazione elettroforetica
vengono trasferite ad una
membrana immobilizzante e
poi trattate con un anticorpo
marcato, specifico per la
proteina d’interesse, la cui
banda viene quindi
riconosciuta.
Incubazione con
anticorpo
marcato
anti-A
A
Elettroblottin
g
B
SDS-Page
Filtro
Incubazione
con anticorpo
marcato
anti-B
Autoradiogrammi
Le proteine devono essere trasferite dal gel alla membrana mantenendo la forma e il
livello di diffusione acquisiti alla fine della prima separazione elettroforetica. Il trasferimento
su membrana può avvenire per semplice diffusione, oppure per flusso di solvente in
sistemi sottovuoto, ma più di frequente si utilizza un sistema di elettroblotting.
Il gel viene normalmente posto al catodo e
la membrana all’anodo, il tampone può
essere simile al quello utilizzato nella
prima separazione (ad es., tris-glicina pH
Catodo
8.3) e può contenere SDS o metanolo. Le
caratteristiche del tampone dipendono
Gel
prevalentemente dal tipo di proteina da
Membrana
trasferire; se la proteina è fibrosa, molto
apolare, poco solubile e di alto PM, in
Carta da filtro
assenza di SDS non si assiste al trasfeTovaglioli
rimento. Proteine piccole, che si legano
poco alla membrana e che diffondono in
essa, necessitano invece di Tris Glicina
Anodo
addizionato di 20% di metanolo.
Le membrane che si impiegano possono essere di diverso materiale, ma tutte presentano
dei pori. Questi pori, che possono avere una grandezza diversa per meglio adattarle agli
scopi, hanno un diametro che diminuisce progressivamente nell’attraversamento della
membrana. Il diametro sarà maggiore nella parte esposta al gel, e minore nella parte
esposta all’anodo, le proteine si legano alla matrice con interazioni idrofobiche ed
elettrostatiche e la dimensione decrescente dei pori favorisce il blocco delle proteine
all’interno della membrana.
La prima membrana impiegata è stata quella di nitrocellulosa che ha una capacità legante
di 80-100 mg/cm² in cui prevalgono interazioni elettrostatiche ed è ancora oggi la migliore
per scopi generali. Una seconda membrana impiegata è quella di PolyVinylDiFluoride
(PVDF), con una capacità di 170-200 mg/cm² e che presenta interazioni idrofobiche con le
proteine. Ha una maggiore resistenza meccanica e chimica di quella di nitrocellulosa,
viene impiegata quando le proteine recuperate devono essere caratterizzate e
sequenziate e la sua capacità legante aumenta in presenza di SDS. Esistono anche
membrane di nylon, con una capacità legante molto elevata, che sono consigliate per
ottimizzare il rilevamento per chemiluminescenza.
Metodologia Biochimica 2002 – Lez. 6
15
SITI INTERESSANTI
Per quelli di voi che volessero approfondire l’argomento immunochimica e che hanno
accesso al World Wide Web:
Sito Web
Commento
www.whfreeman.com/immunology/CHAPS.HTML
Versione on-line (condensata ma
completa: copre tutti gli argomenti
fondamentali ed ha molte belle
figure) di un manuale di
immunologia edito dalla W.H.
Freeman & Co. (USA).
ntri.tamuk.edu/monoclonal/introduction.html
Introduzione alle tecniche di
immunochimica dalla Texas A&M
University (Kingsville, Texas,
USA).
www.kcom.edu/faculty/chamberlain/Website/MSTUAR
T/lect4.htm
Saggi per la misurazione
dell’interazione antigeneanticorpo da un corso di
immunologia on line. (Da un
college di Kisksville, Missouri)
www.uct.ac.za/microbiology/western.htm#copper
Descrizione del western blotting
dal capitolo di un manuale on-line
di biologia molecolare già visto
nella lezione passata.
Dall’Università di Cape Town
(Sud Africa).