1
LE TETRACICLINE
INTRODUZIONE
Le Tetracicline[1] sono un gruppo di antibiotici che derivano dalla famiglia delle
naftacenecarbossiamidi policicliche.
La storia[2] di questi antibiotici si apre nel 1947-48 con la scoperta della clortetraciclina
(Aureomicina®) in colture di Streptomyces aureofaciens. E’ del 1950 la scoperta della
ossitetraciclina (Terramicina®), isolata dallo Streptomyces rimosus. Il terzo esponente degli
antibiotici tetraciclinici naturali fu preparato originariamente per via chimica: si tratta della
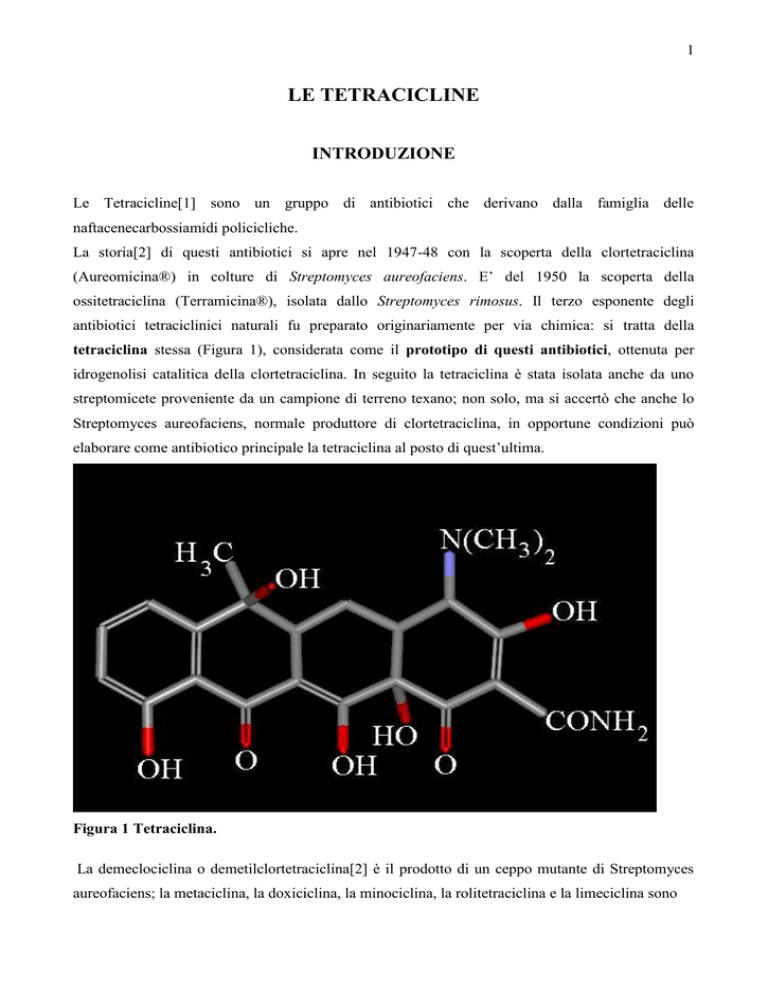
tetraciclina stessa (Figura 1), considerata come il prototipo di questi antibiotici, ottenuta per
idrogenolisi catalitica della clortetraciclina. In seguito la tetraciclina è stata isolata anche da uno
streptomicete proveniente da un campione di terreno texano; non solo, ma si accertò che anche lo
Streptomyces aureofaciens, normale produttore di clortetraciclina, in opportune condizioni può
elaborare come antibiotico principale la tetraciclina al posto di quest’ultima.
Figura 1 Tetraciclina.
La demeclociclina o demetilclortetraciclina[2] è il prodotto di un ceppo mutante di Streptomyces
aureofaciens; la metaciclina, la doxiciclina, la minociclina, la rolitetraciclina e la limeciclina sono
2
tutti derivati semisintetici. La clortetraciclina , la metaciclina, l’ossitetraciclina, la demeclociclina e
la tetraciclina, con i due sottocomposti rolitetraciclina e limeciclina, sono definite tetracicline di
prima generazione, mentre dossiciclina e minociclina sono dette di seconda generazione.
Le tetracicline possiedono un’attività antimicrobica[2] molto estesa che comprende batteri grampositivi e gram-negativi aerobi e anaerobi. Inoltre, esse sono attive nei confronti di alcuni
microorganismi resistenti agli antibiotici che agiscono sulla parete cellulare batterica, quali le
rickettsie, le clamidie, micoplasmi, alcuni micobatteri atipici, molte spirochete ma sono poco attive
contro i funghi. In generale, si tratta di farmaci batteriostatici[2] e la resistenza di un particolare
microorganismo nei confronti dei diversi analoghi è simile. I microorganismi gram-positivi sono
inibiti da concentrazioni di tetraciclina più basse rispetto ai gram-negativi; tuttavia questi antibiotici
non rappresentano il farmaco di scelta per le infezioni causate dai batteri gram-positivi, sia per i
problemi legati al fenomeno della resistenza, che si manifesta essenzialmente con la mancata
penetrazione dell’antibiotico nella cellula batterica, sia
per la disponibilità di altri farmaci
antimicrobici più efficaci e più sicuri.
Se si esamina, infatti, l’attività antibatterica si può constatare come risultino facilmente resistenti[3]
gli stafilococchi, gli streptococchi, gli enterococchi, gli pneumococchi, molti ceppi di H. influenzae
ad eccezione della doxiciclina a cui il 90% dei ceppi è ancora sensibile, molte neisserie ( eccetto
N.gonorrhoeae e N. meningitidis), Clostridium spp. e molti coliformi. Le tetracicline, invece, sono
particolarmente indicate[4] nella terapia delle infezioni causate da H. ducreyi( cancroide), Brucella
e Vibrio cholerae. Inoltre, sono in grado di inibire la crescita di Legionella pneumophila in vitro,
ma non in vivo[5], Helicobacter pylori, Yersinia pestis (peste) e Pasteurella multocida. La
sensibilità dei batteri anaerobi gram-positivi alle tetracicline varia molto, il Propionibacterium è il
più sensibile e il Peptococcus è il meno sensibile.
I microorganismi che sono diventati resistenti ad una tetraciclina, come già detto, frequentemente
manifestano resistenza anche alle altre[6]; i tre meccanismi principali della resistenza sono:
1) diminuzione dell’accumulo di tetracicline, sia a causa di un ridotto ingresso dell’antibiotico
sia per l’acquisizione di una via di eliminazione energia-dipendente;
2) riduzione dell’accesso della tetraciclina al ribosoma per la presenza di proteine che
proteggono i ribosomi;
3) in attivazione enzimatica delle tetracicline;
3
Indicazioni cliniche
Le tetracicline sono state largamente utilizzate[7] sia per la terapia di patologie infettive sia come
additivo dei mangimi per animali per promuoverne la crescita. Questo largo impiego ha determinato
l’insorgenza di ceppi batterici resistenti con una riduzione drastica del loro uso in terapia.
Le tetracicline rappresentano il farmaco di scelta nelle infezioni causate da rickettsie, micoplasmi e
clamidie. Le tetracicline, infatti, risultano molto efficaci nelle infezioni da rickettsie comprendenti
la febbre delle Montagne Rocciose, il tifo epidemico recidivante (malattia di Brill), la rickettiosi
vescicolare.
Il Mycoplasma pneumoniae è sensibile alle tetracicline; il trattamento della polmonite con
tetracicline consente di ridurre la durata della febbre, della tosse, dei rantoli polmonari.
Le tetracicline sono attualmente il farmaco di scelta per il trattamento del Linfogranuloma venereo;
la dose per os di tetraciclina è di 500 mg , quattro volte al giorno, per almeno due settimane. Le
tetracicline possono essere utilizzate nelle infezioni( polmoniti,bronchiti, sinusiti) da Chlamydia
pneumoniae e nell’uretrite aspecifica causata da Chlamydia trachomatis dove si raccomanda la
somministrazione per os di 500 mg di tetraciclina ogni sei ore, o di 100 mg di doxiciclina ogni 12
ore, per sette giorni. Le malattie sessualmente trasmesse(MST) costituiscono attualmente
l’indicazione clinica nella quale le tetracicline sono più frequentemente utilizzate[8]. Nelle infezioni
genitali alte della donna (salpingiti, annessiti), spesso polimicrobiche, il trattamento è di almeno tre
settimane, associando una tetraciclina (più spesso doxiciclina) al metronidazolo. Le tetracicline
sono inoltre efficaci nel trattamento delle infezioni gonococciche non complicate[7]; tutti i pazienti
affetti da gonorrea dovrebbero essere trattati con tetraciclina, ofloxacina o con un macrolide per
debellare le infezioni da C. trachomatis che possono potenzialmente coesistere. Le tetracicline
possono essere anche utilizzate nel trattamento della sifilide[8], in caso di allergia alle penicilline,
per esempio con la somministrazione orale di 200 mg di doxiciclina due volte al giorno, per due
settimane.
Le tetracicline si sono dimostrate efficaci nel trattamento di infezioni acute e croniche da Brucella
melitensis, B. suis e B. abortus. L’associazione di una tetraciclina, ad esempio doxiciclina associata
alla streptomicina[8] ha dato risultati convincenti nei casi di brucellosi acuta. Nei confronti del
Colera[7] è stato osservato che la tetraciclina è il farmaco più attivo nel ridurre il volume delle feci,
nel diminuire la quantità di liquido da reintegrare per via endovenosa e nel ridurre la durata della
diarrea.
4
Nelle infezioni da cocchi[7], la minociclina è in grado di prevenire le patologie da meningococchi,
anche se, non se ne raccomanda l’uso in quanto il farmaco può provocare disturbi vestibolari.
Le tetracicline sono utilizzate nel trattamento dell’actinomicosi anche se il farmaco di scelta è la
penicillina G; esse si sono dimostrate utili nel trattamento acuto e nella profilassi della leptospirosi
(Leptospira spp.). Esse sono impiegate anche nel trattamento dell’acne[8], grazie al loro effetto di
inibizione dei propionibatteri (Propionibacterium acnes), che si accumulano nel follicolo sebaceo
dove metabolizzano i lipidi con produzione di acidi grassi liberi irritanti; il trattamento però deve
essere prolungato e a basso dosaggio.
Farmacologia e Farmacocinetica
La
maggior
parte
delle
tetracicline
non
viene
assorbita
completamente
nel
tratto
gastrointestinale[9]; l’assorbimento avviene principalmente nello stomaco e nella parte superiore
dell’intestino tenue. Le tetracicline possono causare una profonda alterazione della flora batterica
intestinale a causa delle alte concentrazioni raggiunte nell’intestino. L’assorbimento, in seguito a
somministrazione orale di una dose a stomaco vuoto, varia in base al tipo di tetraciclina[10]; quasi
completo con la doxiciclina e la minociclina (95%), diminuisce progressivamente con la
limeciclina, antibiotico semisintetico, derivato esterificato della tetraciclina semplice (80%), la
tetraciclina (75%), l’ossitetraciclina e metaciclina (60%), la clortetraciclina (30%). Le tetracicline
cosiddette
classiche
(clortetraciclina,
ossitetraciclina,
tetraciclina)
hanno
una
migliore
biodisponibilità a digiuno o lontano dai pasti( la presenza di alimenti, soprattutto latte ostacola il
loro assorbimento gastroenterico), mentre la doxiciclina e la minociclina possono essere
somministrate anche durante i pasti senza che il loro assorbimento venga modificato. La presenza di
cationi metallici di origine alimentare (i latticini fonte di calcio), o apportati da alcuni farmaci
(medicazioni intestinali a base di alluminio, magnesio, calcio, ferro, etc.), infatti, riduce per
chelazione l’assorbimento gastroenterico. Le tetracicline non vanno, inoltre, somministrate insieme
ad antiacidi o adsorbenti, a ranitidina o cimetidina, a colestiramina, farmaci che ne ritardano o
riducono l’assorbimento[11]; è utile invece associare alle tetracicline per via orale acido citrico,
sodio metafosfato o glucosamina, che, impedendo la chelazione del calcio, aumentano il loro
5
assorbimento. I livelli ematici ottenuti dopo somministrazione orale di 0.5 g di questi farmaci, sono
di 4 μg/ml per la tetraciclina e l’ossitetraciclina, di 1 μg/ml per la clortetraciclina. Per quanto
concerne la somministrazione per via parenterale e.v. i picchi sierici sono più elevati e più rapidi,
soprattutto per la rolitetraciclina[12] derivato semisintetico altamente idrosolubile, particolarmente
indicata, anche se oramai è in disuso, nella terapia parenterale, mentre non viene assorbita per via
orale. La diffusione tissutale [10] e la penetrazione intracellulare sono molto elevate, nella maggior
parte dei tessuti, ad eccezione del liquido cefalo-rachidiano (leggermente meglio per le tetracicline
liposolubili, soprattutto la minociclina). Le tetracicline hanno una capacità di concentrazione nel
tessuto polmonare e una buona diffusione nelle secrezioni bronchiali e nel tessuto prostatico e sono
escrete nel latte materno; con la minociclina si ha, grazie alla sua liposolubilità, una buona
concentrazione a livello salivare e lacrimale. Questi farmaci presentano, inoltre, una buona affinità
per il tessuto osseo, i denti in formazione e le cellule tumorali. La biotrasformazione[13]
metabolica è notevole con la clortetraciclina, diminuisce con la doxiciclina, fino a diventare
relativamente debole con le altre tetracicline. Tutte le tetracicline, con l’eccezione della doxiciclina,
vengono escrete soprattutto nell’urina per filtrazione glomerulare, sicché i loro livelli ematici
crescono in presenza di un’insufficienza renale. La doxiciclina viene escreta soprattutto nelle feci.
Tutte le tetracicline vengono in parte escrete nella bile, col raggiungimento di concentrazioni biliari
elevate, e vengono poi parzialmente riassorbite. Tutte quelle somministrate per via orale provocano
effetti collaterali[14] GI di varia entità, come nausea, vomito e diarrea e possono causare una colite
pseudomembranosa (Clostridium difficile) e sovrainfezioni da Candida. È frequente la
tromboflebite dopo somministrazione EV. Le tetracicline possono provocare colorazione dei denti,
ipoplasia dello smalto dentario e crescita anomala delle ossa nei bambini e nei feti di donne gravide.
Pertanto le tetracicline devono essere evitate dopo il 1o trimestre di gravidanza e nei bambini
< 8 anni. Nei neonati si può verificare lo pseudotumor cerebri, con aumento della pressione
intracranica e protrusione delle fontanelle. Tutte le tetracicline possiedono un effetto antianabolico e
aumentano il catabolismo proteico che può provocare un peggioramento dell’uremia nei pazienti
con insufficienza renale. Con livelli ematici eccessivi, dovuti a dosi elevate, uso EV o insufficienza
renale, si può determinare una degenerazione grassa acuta del fegato, specie in corso di gravidanza.
Le tetracicline (e la demeclociclina in particolare) possono provocare fotosensibilizzazione. La
demeclociclina può provocare anche un diabete insipido nefrogeno. La minociclina provoca
abitualmente vertigini. La doxiciclina è la tetraciclina utilizzata più comunemente a causa del
prezzo contenuto, della possibilità di somministrazione due volte al giorno e della migliore
tollerabilità. Le tetracicline a validità scaduta possono degenerare e provocare una sindrome di
Fanconi. Le tetracicline sono disponibili in commercio in diverse formulazioni[15] per l’utilizzo
6
orale, parenterale e topico; la dose orale[15] prescritta dipende dalla gravità dell’infezione che deve
essere curata: per le tetracicline classiche la dose consigliata negli adulti varia da 1 a 2 g al giorno;
la demeclociclina si usa per via orale alle dosi di 0,6-1,2 g/die nell’adulto e di 10-15 mg/kg/die nel
bambino, in due somministrazioni giornaliere; la limeciclina, in disuso, si utilizza sia per via orale
che per via parenterale alle dosi di 0,6-0,8 g /die nell’adulto e di 10 mg/kg/die nel bambino, essa,
però non è in vendita in Italia.; la metaciclina si impiega per via orale alle dosi di 0,6 g/die
nell’adulto e di 10-15 mg/kg/die nel bambino in due somministrazioni giornaliere; la rolitetraciclina
si impiega per via endovenosa o per via intramuscolare alle dosi di 0,3-0,6 g/die nell’adulto e di 1015 mg/kg/die nel bambino in due somministrazioni giornaliere; la doxiciclina è negli Stati Uniti la
tetraciclina di scelta per la somministrazione parenterale, viene prescritta nei casi in cui il paziente
non riesce ad ingerire il farmaco o quando la somministrazione orale è associata alla comparsa di
forte nausea e vomito.
Per via endovenosa sono consigliabili 0,1-0,2 g/die nell’adulto e 3-4 mg/kg/die nel bambino; per via
orale, nell’adulto, si usa alle dosi di 0,2 g il primo giorno e di 0,1 g/die nei giorni successivi; la
minociclina si usa per via orale alle dosi di 0,2 g /die nell’adulto e di 4 mg/kg/die nel bambino in
due somministrazioni giornaliere.
L’utilizzo topico delle tetracicline[16] non è raccomandato ad eccezione del trattamento topico delle
infezioni dell’occhio. Le preparazioni oftalmiche, disponibili in forma di pomata o di sospensione,
comprendono clortetraciclina cloridrato (Aureomicina®), tetraciclina cloridrato e ossitetraciclina
cloridrato.
7
CAPITOLO I
PRINCIPI ATTIVI
Tutte le tetracicline hanno in comune la stessa struttura tetraciclica (nucleo naftacencarbossiamidico) ed il carattere anfotero[17]. Le tetracicline sono composti suscettibili di dare sali
cristallini sia con acidi che con basi forti[18]; il loro sistema cromoforo comune dà luogo a spettri di
assorbimento caratteristici che si estendono al visibile, impartendo il caratteristico colore giallo a
questi antibiotici. Tutte le tetracicline sono in grado di dare chelati con metalli; questi chelati sono
insolubili in acqua e sembrano esplicare un apprezzabile ruolo nel meccanismo d’azione di questi
antibiotici[18]. Come basi anfotere le tetracicline sono scarsamente solubili in acqua, i loro
cloridrati presentano,invece, una maggiore solubilità in acqua.
Un’altra caratteristica comune alle tetracicline è quella di imbrunire alla luce e di degradarsi in
presenza di umidità ed in ambiente acido per formare gli anidroderivati, praticamente privi di potere
antibiotico e più tossici degli antibiotici di partenza, probabilmente perché capaci di interagire in
modo aspecifico con le membrane cellulari eucariotiche cosi come con quelle procariotiche.
A pH alcalini delle tetracicline si formano per notevole rimaneggiamento strutturale, le cosiddette
isotetracicline[18]; all’isotetraciclina stessa compete la struttura seguente:
H3C
N
CH
3
OH
CH
3
O
O
OH
O
OH
CONH
2
O
8
Le isotetracicline presentano nei confronti della molecola integra dei vantaggi di solubilità che si
sfruttano nel processo estrattivo necessario al dosaggio chimico degli antibiotici tetraciclinici nei
tessuti e nei liquidi organici.
Le sostituzioni chimiche sul nucleo di base delle tetracicline, riguardano gli atomi di carbonio C5,
C6 e C7 del nucleo naftacenico:
Formula generale delle tetracicline
R1
R4
R2
7
D
OH
R3
6
C
O
5
B
N(CH3)
2
4
A
1
OH
2
CONHR
OH
OH O
Tetraciclina[2] (Sumycin®, Tetracyn®, Achromicin®, Acromicina®, Ambramicina®(utilizzata
sottoforma di capsule), Criseociclina®, Hostacycline®, Ibicyn®, Resomicina®, Spaciclina®):
R1=H
R2=CH3
R3=OH
R4=H
H
OH
H
H3C
7
6
5
N(CH3)
2
1
OH
O
OH
4
OH
OH O
2
CONH
2
9
Ossitetraciclina [2] (Terramicina®, Terramycin®), è la 5-idrossi tetraciclina:
R1=H
R2=CH3
R3=OH
R4=OH
H
H3C
7
OH
OH
6
5
N(CH3)
2
1
OH
O
OH
4
2
CONH
2
OH
OH O
Clortetraciclina[2] (Aureomicina®, Aureomycin®, Clortetra®), è la 7-clortetraciclina:
R1=Cl
R2=CH3
R3=OH
R4=H
Cl
H3C
7
H
OH
6
5
N(CH3)
2
1
OH
O
OH
4
OH
OH O
2
CONH
2
10
Demetilclortetraciclina
o
demeclociclina[2]
(Declomycin®,
Demecidin®,
Demetetra®,
Ledermicina®, Ledermycin®, Mexocine®, Superciclina®):
R1=Cl
R2=H
R3=OH
R4=H
Cl
H
OH
H
7
6
5
N(CH3)
2
1
OH
O
OH
4
OH
OH
O
2
CONH
2
La demeclociclina, presenta tra le tetracicline naturali delle caratteristiche peculiari[19]: essa è
infatti assorbita rapidamente, dopo somministrazione orale, come le altre tetracicline, ma viene
molto più lentamente escreta. Questa più lenta escrezione renale della demeclociclina la rende
particolarmente indicata come “tetraciclina ritardo” e consente la somministrazione di dosi minori
rispetto a quelle delle tetracicline naturali.
Un importante sviluppo nell’ambito delle tetracicline naturali (tetraciclina, ossitetraciclina e
tetraciclina, ottenuta per dealogenazione catalitica ma anche per via naturale), si è avuto con la
preparazione per via semisintetica di nuove tetracicline, note appunto come tetracicline
semisintetiche[20]. Queste possono essere suddivise essenzialmente in due gruppi:
1) Tetracicline semisintetiche ottenute con modificazioni chimiche non interessanti il gruppo
carbossiamidico delle tetracicline naturali.
2) Tetracicline semisintetiche ottenute con modificazioni chimiche interessanti il gruppo
carbossiamidico delle tetracicline naturali.
11
Interessano il primo gruppo le seguenti tetracicline:
Metaciclina:(Rotilen®) si tratta della 6-metilen-5-idrossitetraciclina; questo antibiotico viene
discretamente assorbito dopo somministrazione orale , pur con una certa variabilità individuale[21]:
R1=H
R2= =CH2
R4=OH
H
CH
2
OH
N(CH3)
2
7
6
5
4
OH
2
1
OH
O
OH
OH
CONH
2
O
Cloridrato di metaciclina[20] (Molciclina®, Rondomicina®, Rondomycin®):
H
CH
2
OH
N(CH3)
2
7
6
5
4
1
OH
O
OH
OH
O
OH
. HCl
2
CONH
2
12
Sanciclina o 6-demetil-6desossitetraciclina[20] (Bonomycin®):
)
N(CH
32
OH
OH
O
OH
OH
CONH
2
O
Dossiciclina o 6-desossi-5-idrossitetraciclina (Bassado®, Monodox®, Periostat®). La dossiciclina
è una tetraciclina semisintetica altamente liposolubile[21] per questo, diffonde meglio nei tessuti e
nei liquidi organici; i livelli ematici ottenuti per via orale sono quasi identici a quelli ottenuti con la
somministrazione parenterale. La dossiciclina inoltre, chela il calcio meno di tutti gli altri farmaci
della famiglia, e ciò la rende meno pericolosa, soprattutto in campo pediatrico, a livello osseo e
dentario. L’emivita plasmatica
dell’antibiotico è molto prolungata, circa 20h; nei pazienti con
fibrosi cistica[21] l’emivita è notevolmente ridotta (circa 7h), mentre in quelli con insufficienza
renale non è di molto aumentata, per cui non è necessario modificare la posologia. E’questa, infatti,
l’unica tetraciclina che si può impiegare tranquillamente nel paziente con insufficienza renale:
R1=H
R2=CH3
R3=H
R4=OH
H
CH
3
OH
N(CH3)
2
7
6
5
4
1
OH
O
OH
OH O
OH
2
CONH
2
13
Cloridrato di dossiciclina [20] (Vibramycin®):
H
CH
3
OH
N(CH3)
2
7
6
5
4
1
OH
OH
CONH
2
OH
OH O
O
.HCl
2
Minociclina (Dynacin®, Minocin®, Vectrin®). E’ un derivato semisintetico altamente
liposolubile: chimicamente si tratta di una 7-dimetilamino-6-demetildesossitetraciclina[21]. Questa
tetraciclina presenta un ottimo assorbimento per via orale e una lenta eliminazione renale e
soprattutto biliare. L’emivita di questo antibiotico non risulta modificata nel paziente con
insufficienza epatica, mentre è raddoppiata nei soggetti con grave insufficienza renale; per questo,
in questi pazienti, a differenza della doxiciclina, deve essere utilizzato con estrema cautela:
R1= N(CH3)2
R2=H
R3=H
R4=H
N(CH
3)2
N(CH)
32
7
6
5
1
OH
O
OH
4
OH
O
OH
2
CONH
2
14
I prodotti che appartengono al gruppo delle tetracicline semisintetiche ottenute con modificazioni
chimiche interessanti il gruppo carbossiamidico delle tetracicline naturali, sono ottenuti[22] per
azione della sola formaldeide (CH2O) o di formaldeide più amine secondarie sulle tetracicline
naturali.
Fra
i
derivati
del
primo
sottogruppo
quello
più
noto
è
la
clomociclina
o
N-
metilolclortetraciclina[22], ottenuta per reazione, in opportune condizioni sperimentali, da
clortetraciclina e formaldeide:
Cl
H3C
OH
N(CH)
32
OH
OH
O
OH
O
OH
CONHCH
OH
2
La clomociclina (Megaclor®), rappresenta un derivato idrosolubile della tetraciclina che offrirebbe
determinati vantaggi nei confronti dell’antibiotico madre; viene somministrata per os (4 capsule da
170 mg pro die; presentata anche in sciroppo contenente 85 mg/5 ml).
Tra le tetracicline semisintetiche del secondo sottogruppo, aventi la seguente formula generale:
OH
HC
3
OH
N(CH)
32
OH
O
OH
O
OH
CONHCHR'R
15
figurano le seguenti tetracicline:
Rolitetraciclina[22] (Bristacin®, Farmaciclina®, Lidociclina®, Quadriciclina®, Reverin®,
Syntetrin®, Transcycline®, Velacycline®); sostanza altamente idrosolubile, essa è particolarmente
indicata nella terapia parenterale[23], specie per infusione endovenosa lenta, mentre non viene
assorbita per via orale. Buono appare l’assorbimento per via intramuscolare; questo antibiotico
presenta un legame farmaco-proteico intermedio(50%) ed una emivita plasmatica di 8h, che
aumenta notevolmente nei soggetti con grave insufficienza renale. La rolitetraciclina si ottiene
facendo reagire la tetraciclina con formaldeide e pirrolidina:
R=
N
H
R’=
Mepiciclina
(come
tale:
Ambra-Vena®,
Boniciclina®,
Valtomicina®;
come
fenossimetilpenicillinato: Criseocil®, Penetracyn®, Tetrastaph®, Vupenciclina®); si ottiene[22]
facendo reagire la tetraciclina con formaldeide e la N-( β-idrossietil) piperazina:
R=
N
R’=
CH
NCH
2 2OH
H
16
Limeciclina[22] (Armyl®, Lisinciclina®, Tetradin®, Tetralysal®, Tralisin®); è discretamente
idrosolubile e quindi utilizzabile per via parenterale, ma è assorbito bene anche per via orale, anche
se può determinare fenomeni di intolleranza gastrointestinale[23]. La limeciclina non è in vendita in
Italia; si ottiene facendo reagire la tetraciclina con formaldeide e lisina:
R=
NHCH
(CH
2)4NH2
COOH
H
R’=
Apiciclina ( Traserit®); si ottiene[22] facendo reagire la tetraciclina con formaldeide e la N-( βidrossietil) piperazina:
R=
N
R’=
CH
NCH
2 2OH
COOH
Tetracicline semisintetiche più recenti [24] appartengono al gruppo delle glicilcicline ( tetracicline
di terza generazione) ( 1°, 2°, 3°, nell’immagine) [24]:
1) 9-(N,N-dimetilglicilamido)-6-demetil-6-desossitetraciclina
17
2) 9-(N,N-dimetilglicilamido)-minociclina
3) 9- t-(butilglicilamido)-minociclina
18
CAPITOLO II
MECCANISMO D’AZIONE DELLE TETRACICLINE
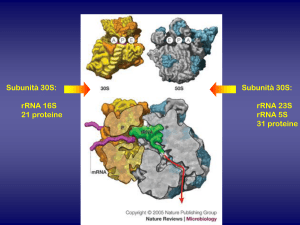
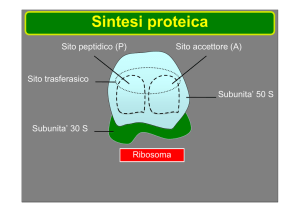
Le tetracicline inibiscono la sintesi proteica dei batteri[25] legandosi alla subunità 30S (Fig.2) del
ribosoma batterico in modo tale da impedire l’accesso dell’aminoacil tRNA al sito accettare (A),
presente nel complesso mRNA-ribosoma (Fig. 3): l’RNA messaggero (mRNA) si lega alla subunità
30S dell’RNA ribosomiale batterico. Il sito P(peptidilico) della subunità 50S dell’RNA ribosomiale
contiene la catena polipeptidica nascente; in condizioni normali l’aminoacil tRNA, che lega
l’aminoacido che deve essere aggiunto alla catena, raggiunge il sito A e qui si lega mediante
interazione tra le basi appaiate complementari presenti nella sequenza anticodon del tRNA e nella
sequenza codon dell’mRNA(Fig.4); le tetracicline bloccano fisicamente il legame del tRNA al sito
accettare (A).
Fig.2 Composizione in ribosomi della cellula procariotica e della cellula eucariotica.
19
Fig.3 Inibizione della sintesi proteica da parte delle tetracicline.
Fig.4 Competizione con il tRNA per il sito A.
Le tetracicline attraversano la membrana esterna[24] dei batteri gram-negativi per diffusione
passiva, attraverso i canali idrofilici OmpF e OmpC formati dalle porine (Fig. 5) della membrana
esterna, sottoforma di complessi di coordinazione con cationi metallici( probabilmente magnesio) e,
la membrana citoplasmatica interna mediante trasporto attivo[25].
20
Fig.5 Le tetracicline penetrano nella cellula attraverso le porine, oppure attraverso lo strato
lipidico.
Il complesso antibiotico-catione metallico [24] attratto, mediante il potenziale di membrana,
attraverso la membrana esterna, si accumula nel periplasma dove in seguito si dissocia liberando
tetraciclina non carica, una molecola debolmente lipofilica in grado di attraversare il doppio strato
lipidico della membrana citoplasmatica.
Allo stesso modo, si suppone [24] che la forma lipofilica, elettricamente neutra, sia anche quella in
grado di passare attraverso la membrana citoplasmatica dei batteri gram-positivi.
Il passaggio di questi farmaci attraverso la membrana citoplasmatica richiede un sistema di
trasporto energia-dipendente. Nel citoplasma, le tetracicline si presentano sottoforma di chelati
poiché il pH interno e le concentrazioni dello ione metallico bivalente sono più alte rispetto a quelle
presenti all’esterno della cellula.
21
Infatti, con molta probabilità, il principio attivo che lega il ribosoma è un complesso magnesiotetraciclina [24] (Fig.6).
Fig.6 Complesso tetraciclina-magnesio bivalente.
L’associazione delle tetracicline con il ribosoma è reversibile e ciò spiega gli effetti batteriostatici di
questi antibiotici.
Diversi studi [24] hanno messo in evidenza la presenza di un sito ad alta affinità per le tetracicline
localizzato a livello della subunità ribosomiale 30S e mediante studi di fotoaffinità e
footprinting[26] (termine inglese usato per indicare una tecnica volta a definire la zona di un
filamento di DNA a contatto, o nelle immediate vicinanze, di una proteina legante il DNA; la
tecnica consiste nel sottoporre a modificazioni chimiche il complesso proteina-DNA. La regione a
contatto con la proteina viene protetta da tali modifiche e può cosi essere riconosciuta) si è
constatato che la proteina S7 e le basi G693, A892, U1052, C1054, G1300 e G1338 di rRNA 16S
contribuiscono a formare la tasca di legame. Tuttavia, Schnappinger e Hillen [24], hanno
puntualizzato che tali siti possono non riflettere necessariamente l’attuale sito di legame.
In verità, l’interpretazione degli studi è complicata dall’osservazione che il sito di legame delle
tetracicline al ribosoma (che misura approssimativamente dagli 8 ai 12 Ǻ) sembra causare
modificazioni strutturali nell’rRNA 16S. Tuttavia, poiché la resistenza dei propionibatteri, batteri
gram-positivi che fermentano i carboidrati con produzione di acido propionico e acetico, alle
tetracicline coinvolge una mutazione citosina-guanina in posizione 1058 nell’rRNA 16S, si
potrebbe pensare che le basi vicine U1052 e C1054, identificate con la tecnica del footprinting,
abbiano un significato funzionale nel legame delle tetracicline alla subunità 30S.
L’assenza di un’attività antieucariotica [24], testimonia le proprietà antimicrobiche selettive delle
tetracicline. A livello molecolare, ciò deriva dalla relativamente debole inibizione della sintesi
proteica supportata dai ribosomi 80S e dallo scarso accumulo degli antibiotici nelle cellule di
mammifero. In ogni caso, le tetracicline inibiscono la sintesi proteica nei mitocondri per la presenza
22
in questi organelli dei ribosomi 70S. L’attività antiparassitaria delle tetracicline, infatti, è in alcuni
casi spiegata dalla presenza, in taluni organismi (per es. P. falciparum), dei mitocondri. Tuttavia,
esistono altri tipi di protozoi senza mitocondri, che rimangono sensibili alle tetracicline.
Relazione Struttura-Attività
Le tetracicline sono strutturalmente rappresentate [24] da un nucleo di base lineare tetraciclico fuso
(anelli A, B, C e D) con diversi gruppi funzionali ad esso attaccati:
R1
R4
R2
7
D
OH
N(CH3)
2
R3
6
C
O
5
B
4
A
1
OH
2
OH
OH O
CONHR
La tetraciclina più semplice che mostra attività antibatterica è la 6-desossi-6-demetiltetraciclina
(sanciclina):
)
N(CH
32
OH
OH
O
OH
OH
CONH
2
O
per cui tale struttura, può essere considerata come il minimo farmacoforo.
23
Caratteristiche importanti [24] per l’attività antibatterica delle tetracicline, sono sicuramente il
mantenimento del nucleo di base, il gruppo dimetilamino in posizione 4 e la conservazione del
sistema cheto enolico (posizioni 11,12 e 12 a ) (Fig.7) in prossimità dell’anello fenolico D.
Fig.7 Nucleo di base delle tetracicline.
Le tetracicline sono forti agenti chelanti e sia le loro proprietà antibatteriche che quelle
farmacocinetiche sono influenzate dalla capacità di chelare ioni metallici. I siti chelanti includono il
sistema β-dichetone (posizioni 11 e 12), il sistema enolico (posizioni 1 e 3) e carbossiamidico
dell’anello A.
24
Anche le recenti glicilcicline, (come altri derivati tetraciclinici), formano complessi con cationi
bivalenti.
La sostituzione del gruppo carbossiamidico in C-2, con altri gruppi porta generalmente alla
formazione di analoghi con inferiore attività antibatterica, probabilmente perché vi è uno scarso
accumulo di queste molecole da parte dei batteri.
Tuttavia, l’aggiunta di sostituenti all’azoto amidico può conferire una certa idrosolubilità, come nel
caso della rolitetraciclina e limeciclina. Coerentemente con queste osservazioni, sostituzioni nelle
posizioni 1, 3, 4a , 10, 11 o 12 sono sicuramente dannose per l’attività antibatterica. Tuttavia, altre
sostituzioni in diverse posizioni sugli anelli B, C e D sono tollerate.
Per rendere le tetracicline una classe di composti ad ampio spettro, durante gli anni novanta è stata
intrapresa una ricerca sistematica per scoprire nuovi analoghi che potessero essere attivi nei
confronti degli organismi resistenti alle vecchie tetracicline, mantenendo nel contempo attività
contro gli organismi tetraciclina-sensibili.
Il risultato della ricerca è rappresentato dalle 9-gliciniltetracicline (glicilcicline). Il tentativo di
introdurre sostituenti in posizione 9 della molecola come 9-nitro, 9-amino, 9-idrossi, ha condotto ad
analoghi caratterizzati da scarsa attività antibatterica. Inoltre, si notò che i 9-acilamido derivati della
minociclina esibivano un’attività antibatterica simile a quella delle prime tetracicline ma erano privi
di attività verso gli organismi resistenti.
Tuttavia, si osservò[24] che quando il gruppo acilico veniva modificato in modo tale da includere
una N,N-dialchilamina come per esempio nella 6-demetil-6-desossitetraciclina e come nei derivati
della minociclina, non solo era preservata l’attività antibatterica quanto i composti divenivano attivi
contro i batteri contenenti i geni tet responsabili dell’efflusso delle prime tetracicline (Tet(A)Tet(D)-Tet(K)) e della protezione ribosomiale (Tet(M)).
L’efflusso[27] infatti, è il meccanismo fondamentale alla base della resistenza alle tetracicline
(Fig.8), e consiste nel ridurre attivamente la concentrazione dell’antibiotico all’interno della cellula
batterica attraverso la membrana citoplasmatica, grazie alla sintesi inducibile di una proteina di
membrana (Tet) codificata da geni collocati su plasmidi o su trasposoni.
25
Fig.8 Sistema di trasporto attivo.
Questi dati suggeriscono quindi, che per ottenere una tale attività nelle tetracicline sarebbe
necessaria una sostituzione in posizione 9 della molecola con un gruppo N-alchil glicilamidico.
Interazioni strutturali delle tetracicline
La formazione di complessi tra le tetracicline e ioni metallici è oggetto di studio da parte dei
ricercatori.
È stato osservato come l’interazione delle tetracicline con ioni Cu(II) [28], possa danneggiare
significativamente il DNA. L’interazione delle tetracicline con il DNA risulta in una alchilazione
nelle posizioni N-7 e N-3 delle basi di adenina e guanina e causa destabilizzazione della struttura
secondaria del DNA. Si potè constatare, quindi, che il danno indotto al DNA dal complesso
tetraciclina-Cu(II) era sicuramente dovuto al legame delle tetracicline e del rame al DNA, al
26
trasferimento del gruppo metilico dalle tetracicline alle basi azotate e alla generazione di radicali
liberi in prossimità del DNA a causa della fotosensibilizzazione indotta dalle tetracicline.
Studi rilevanti sono stati condotti anche, sui siti di legame delle tetracicline presenti sulla subunità
ribosomiale 30S, interazione che è alla base, come si è detto, del loro meccanismo d’azione.
La piccola subunità ribosomiale (30S nei procarioti), è responsabile della codificazione
dell’informazione genetica.
Essa, infatti, gioca un ruolo centrale nella formazione del complesso d’inizio, che richiede la sua
interazione con l’mRNA, il tRNA e i fattori d’inizio, discrimina tra le molecole di aminoacil tRNA,
garantendo cosi una certa accuratezza traduzionale ed è un target naturale per i ligandi che
inibiscono la sintesi proteica come per l’appunto antibiotici e tossine.
Come si sa, le tetracicline inibiscono la sintesi proteica interferendo con il legame dell’aminoacil
tRNA al sito-A della subunità 30S.
Mediante cristallografia a raggi-X è stata analizzata [29] la struttura del complesso formato dalla
subunità ribosomiale 30S di Thermus thermophilus con la tetraciclina.
Sono stati identificati sei siti (Tet) di legame delle tetracicline sulla subunità ribosomiale 30S
(Fig.9), con un range occupazionale da 1 a 0.41.
Nella figura sottostante (immagine A), che mostra la struttura di una subunità ribosomiale 30S, sono
indicati i siti di legame delle tetracicline e della edeina un antibiotico peptidico prodotto da Bacillus
brevis, anch’essa oggetto dello studio. Le proteine ribosomiali interagenti con le tetracicline sono
state colorate.
Le immagini B e C mostrano la densità elettronica di due regioni della struttura, corrispondenti
rispettivamente all’elica 16 e alla proteina ribosomiale S16.
27
Si è visto che [29], Tet-1, il sito con la più elevata occupazione, è localizzato tra il solco minore
distorto di H34 e il loop di H31, vicino al sito-A dove l’aminoacil tRNA si attaccava alla subunità
30S.
28
Gli altri cinque siti sono stati identificati in diverse posizioni (Fig.10).
Fig.10
Il sito di legame Tet-1 è posto in una tasca formata dai residui 1054-1056 e 1196-1200 di H34 e
964-967 di H31(Fig.10A). Le basi 1196 e 1054, formano una giuntura che trattiene le tetracicline
attraverso interazioni idrofobiche.
Tet-1 interagisce con lo scheletro zucchero-fosfato di H34; questa interazione sembra essere
supportata dallo ione Mg2+.
29
Tet-2 è localizzato in una tasca idrofobica di S4 (Fig.10B) ed è il solo sito di legame della
tetraciclina non coinvolto nell’interazione con l’rRNA 16S (N.B. nei batteri, a seconda del coeff. di
sedimentazione, si ha: rRNA 23S, 16S e 5S) . Questa tasca di legame è formata da un motivo elicaloop-elica (residui 78-98 e 185-192); Arg 187 e Lys85, che non sono coinvolte nell’interazione con
l’RNA, chiudono la tasca di legame dal lato idrofilico delle tetracicline.
Tet-3 è sito dentro H40(Fig.10C).
La tetraciclina interagisce con U1159 di H40, che è rivolta verso il tetraloop di H40 e i residui di
RNA adiacenti al tetraloop (1146/47 e 1153/54).
Tet-4 è localizzato in una cavità formata da H29, H30 e H43 (Fig.10D). Esso interagisce con le basi
di RNA a livello dei residui 941-943 di H29 e 1342/43 di H43. Inoltre, Tet-4 interagisce con lo
scheletro dell’RNA a livello dei residui 1349/50 di H43 e G1233 di H30. Una Glutammina124
all’estremità C-terminale di S9 chiude la cavità tra H30 e H43.
Tet-5 è posizionata in una tasca piuttosto impermeabile, racchiusa tra H11, H20, H27, e S17
(Fig.10E). Il lato idrofilico della tetraciclina interagisce con lo scheletro di fosfato-zucchero dei
residui 894/895 nella switch region ( porzione di gene deputata al riarrangiamento e che quindi
induce la commutazione di classe delle Ig) di H27 e con le basi U244, C245 e A246 di H11.
La base G761 in H20 delimita l’altro lato della tasca. I residui 99-101 nel tratto C-terminale di S17,
che è unico nei batteri termofili, sono anch’essi coinvolti nel legame.
Tet-6 è localizzato vicino al sito-E, in una cavità delimitata da Arg4 e Arg5 all’estremità Nterminale di S7, Arg120 di S9 e le eliche H28, H34, H38 e H43 dell’rRNA 16S (Fig.10D). Le
interazioni tra rRNA e Tet-6 interessano esclusivamente lo scheletro dell’RNA e sono coordinate
dallo ione magnesio bivalente, in modo similare a quello osservato con Tet-1.
Queste interazioni coinvolgono i residui G933 e C934 di H28, G1186 che collega H34 e H38 e
U1345 e A1346 nel loop-E di H43.
Il legame della tetraciclina al sito Tet-6 è determinato dall’interazione della tetraciclina con le
regioni a singolo filamento di RNA 16S e con i prolungamenti di S7 e S9.
Questi studi [29] hanno permesso di verificare la presenza di sei siti di legame per le tetracicline
sulla subunità ribosomiale 30S, siti che però non sembrano possedere tratti strutturali comuni.
L’interrogativo che gli studiosi si sono posti è, quali siti potrebbero riguardare la traduzione e in che
misura essi sarebbero coinvolti nell’azione inibitoria delle tetracicline.
Tet-1, il sito con il più alto grado di occupazione, interferisce con il sito-A, prevenendo fisicamente
il legame del tRNA al sito-A. Questa interazione rispecchia il meccanismo d’azione classico delle
tetracicline, offrendo una chiara spiegazione dell’effetto batteriostatico di questi antibiotici.
Nei batteri, ci sono due meccanismi di resistenza alle tetracicline correlati al sito Tet-1[29].
30
In uno, la resistenza è mediata da proteine di protezione ribosomiale nell’altro è mediata dalla
mutazione 1058G→ C sull’rRNA 16S.
Le proteine di protezione ribosomiale conferiscono resistenza alle tetracicline attraverso una
riduzione dell’affinità dei ribosomi per le tetracicline o anche attraverso il distacco dal ribosoma
dell’antibiotico legato. Le proteine di protezione quali, TetM, TetO e TetS, conferiscono resistenza
solo a basse concentrazioni di tetracicline e mostrano omologia strutturale con i fattori di
allungamento EF-G e EF-Tu.
È stato proposto[29] che TetM si leghi al sito-A e determini per idrolisi del GTP il distacco della
tetraciclina legata.
La mutazione 1058G→ C potrebbe, invece, impedire l’appaiamento di G1058 con U1199,
determinando una modificazione conformazionale che risulterebbe nella chiusura della tasca di
legame di Tet-1. Questa modificazione potrebbe essere ricondotta al rilascio di ioni magnesio
bivalenti.
Questi due meccanismi, dunque, riflettono l’importanza del sito di legame Tet-1 nell’ambito
dell’azione antibiotica delle tetracicline.
Per quanto riguarda il ruolo funzionale degli altri cinque siti, il legame della tetraciclina a Tet-4, 5 e
6 è testimoniato da evidenze biochimiche mentre non ci sono dati sui siti Tet-2 e 3.
Solo quattro proteine, chiamate S4 per Tet-2, S7 per Tet-6, S9 per Tet-4 e 6 ed S17 per Tet-5,
vengono a contatto con le tetracicline. S4, S7, S9 ed S17 sono proteine di legame all’rRNA; S4 ed
S7 sono due proteine che iniziano l’assemblaggio della subunità 30S. Dunque, il legame delle
tetracicline ai siti Tet-2, 4, 5 e 6 non influenzerebbe il processo di codificazione, ma potrebbe
disturbare l’assemblaggio di nuove particelle 30S, contribuendo all’effetto inibente delle
tetracicline.
Questi studi [29] hanno evidenziato la presenza di un vero e proprio blocco fisico del sito-A
attraverso il legame della tetraciclina al sito Tet-1, ma soprattutto si è voluto ipotizzare che questi
siti potrebbero contribuire sinergicamente all’effetto batteriostatico delle tetracicline.
Si è visto come la resistenza alle tetracicline limiti molto l’uso di questi antibiotici.
Nei batteri gram-negativi, la resistenza alle tetracicline risulta dall’esportazione del complesso
[MgTc]+, mediante la proteina di efflusso TetA, costituita da 12α eliche transmembrana con
un’ansa centrale che connette le eliche transmembrana 6 e 7 e che è incastrata nella membrana
citoplasmatica; l’espressione di TetA è sotto il controllo trascrizionale del repressore delle
tetracicline (TetR) [30]. Il repressore, in assenza del complesso, lega sequenze palindromiche di un
operatore (tetO1,2) (segmento di cromosoma corrispondente alla regione dell’operone che è
un’unità funzionale del DNA costituita da un gruppo di geni contigui correlati, responsabili della
31
sintesi di enzimi implicati nella stessa funzione) bloccando l’espressione dei geni tetA e tetR che
codificano per la proteina di efflusso delle tetracicline TetA.
Il legame del complesso [MgTc]+ al repressore abolisce questa interazione, permettendo cosi la
trascrizione dei geni tetR e tetA e quindi l’insorgenza della resistenza alle tetracicline. Una elevata
espressione di TetA, però, è letale per la cellula batterica perché causa il trasporto cationico
aspecifico collassando il potenziale della membrana citoplasmatica. Per tenere sotto controllo
l’espressione di TetA, quindi, è necessario il legame di TetR a tetO, che rappresenta il più efficiente
sistema inducibile di regolazione trascrizionale. E’ stata individuata la struttura cristallizzata del
repressore in complesso con un frammento di 15 paia di basi di tetO, con una risoluzione di 2.5 Ǻ
(Fig.11):
Fig.11 Struttura del complesso TetR-tetO
Ciascuna catena polipeptidica del repressore omodimerico, costituito cioè da due identici dimeri, è
ripiegata in 10 alfa eliche; i domini leganti il DNA sono formati da 3 alfa eliche (α1- α3 in blu); le
eliche della rigida impalcatura sono α5, α8, α10 (in giallo) e le eliche sottoposte a modificazioni
conformazionali, in seguito ad induzione, sono α4, α6, α9 (in verde). Nella figura, si possono
osservare anche, lo scheletro fosfato-ribosio in rosso e le basi in grigio dell’operatore.
La regolazione del repressore avviene nel nucleo dell’omodimero, formato dalle eliche, da α5 a α10
e da α5’ad α10’; la porzione N-terminale dell’elica α4 (residui 48-63) partecipa alla parte idrofobica
32
del dominio di legame del DNA e lo collega al dominio di regolazione del TetR. La parte centrale
del dominio regolatore consiste di α eliche antiparallele α8 e α10 e la coppia correlata α8’ e α10’.
Il legame del complesso [MgTc]+ al repressore riduce l’affinità del repressore per tetO di nove
ordini di grandezza.
Dopo l’ingresso del complesso nel repressore (Fig.12), l’anello A della tetraciclina è ancorato
mediante legami a idrogeno che si stabiliscono tra i suoi gruppi funzionali e le catene laterali di His
64 (porzione C-terminale di α4) Asn82, Phe86 e Gln116(α7); la componente idrofobica della
tetraciclina è reclutata dalle catene laterali delle eliche α7, α8 e α9’.
Fig.12 Ingresso del complesso [MgTc]+ nel repressore
33
L’induttore [MgTc]+ cosi legato nel nucleo del repressore, determina dei cambiamenti
conformazionali, grazie alla coordinazione con lo ione Mg2+, che causano lo srotolamento della
porzione C-terminale e lo shift dell’elica α6, con una rotazione di cinque gradi dell’elica α4.
Questo moto pendolare dell’elica α4 aumenta la distanza tra i domini di legame del DNA di 3 Ǻ,
abolendo l’affinità del repressore per il suo DNA operatore (Fig. 13):
Fig.13 Moto pendolare che causa la perdita di affinità tra repressore e operatore
Uno studio abbastanza recente, ha messo in evidenza, proprio nell’ambito della resistenza alle
tetracicline, un’aumentata incidenza di resistenza a questo antibiotico nell’Helicobacter pylori [31].
L’ H. pylori è un batterio gram-negativo che causa infezioni a livello della mucosa gastrica che, se
non trattate con antibiotici, potranno persistere per tutta la vita. La cura dell’H. pylori risulta in una
cicatrizzazione delle ulcere e nella riduzione del rischio di cancro gastrico e linfoma gastrico.
34
Il trattamento principale si ottiene con due o più agenti antimicrobici, un componente bismutico e /o
con un inibitore della pompa protonica. Le tetracicline, sono usate più spesso come una linea
secondaria di trattamento.
Come si è detto la resistenza alle tetracicline è mediata da vari meccanismi:
Efflusso energia-dipendente del complesso tetraciclina-catione attraverso la membrana cellulare
mediante le proteine di efflusso.
Proteine di protezione ribosomiale.
Accanto a questi due meccanismi principali, ne sono stati descritti altri [31]:
Inattivazione enzimatica delle tetracicline.
Mutazioni geniche nell’rRNA 16S interessanti il sito di legame delle tetracicline.
In questo studio, è stato isolato un ceppo (181) tetraciclina-resistente di H. pylori da pazienti di 72
anni, dispeptici.
Dal genoma batterico, i ricercatori, hanno selezionato 12 geni, come potenziali candidati, per la loro
omologia con altri geni tetraciclina-resistenti trovati in altri batteri. Questi geni sono stati utilizzati
per la trasformazione genetica del ceppo tetraciclina-sensibile 26695 per identificare le mutazioni
responsabili della resistenza.
Si è potuto allora constatare, che la resistenza del ceppo 181 di H. pylori alle tetracicline è mediata
da una sostituzione AGA926-928→ TTC, presente in entrambe le copie di rRNA 16S.
La tetraciclina ha un sito primario e uno secondario di legame alla subunità ribosomiale 30S.
Il sito primario di legame è formato dai residui da 1054 a 1056 e da 1196 a 1200 dell’elica 34 e dai
residui da 964 a 967 dell’elica 31. I residui 1054 e 1196 interagiscono con le tetracicline attraverso
interazioni idrofobiche, anche se la maggior parte delle interazioni tra le tetracicline e i residui
dell’rRNA 16S, coinvolge legami a idrogeno e ponti salini. Nel ceppo 181 tetraciclina-resistente di
H. pylori, la sostituzione della tripletta di basi è localizzata a destra nel sito primario di legame delle
tetracicline. Mutazioni in questo sito, riducono l’affinità antibiotico-ribosoma e l’efficacia della
tetraciclina come inibitore traduzionale.
35
CAPITOLO III
PROSPETTIVE E CONCLUSIONI
Nonostante la resistenza limiti notevolmente l’utilizzo delle tetracicline, esse rimangono ancora
attive contro la malaria [24], fattore questo di notevole importanza considerato il rapido incremento
dei ceppi di Plasmodium falciparum meflochina-resistenti.
Sembra anche, che la minociclina in combinazione con la ofloxacina potrebbe essere utile nel
trattamento della lebbra.
Le tetracicline trovano anche applicazione nel trattamento delle infezioni di pollame, ovini e maiali:
gli antibiotici, infatti, vengono aggiunti direttamente al cibo o all’acqua o somministrati sottoforma
di aerosols. Esse, inoltre, possono essere anche utilizzate nel trattamento delle infezioni negli
animali domestici.
Un dato relativamente recente sulle tetracicline [32] che potrebbe suscitare interesse, riguarda una
loro funzione non-antibiotica, ovvero la loro capacità di inibire le metalloproteasi, che giocano un
ruolo centrale nella distruzione del tessuto connettivo; questa loro proprietà è sfruttata nel
trattamento dell’artrite reumatoide (soprattutto doxiciclina e minociclina) e nella periodontite:
infatti l’effetto terapeutico delle tetracicline, in quest’ambito, è attribuito oltre che all’inibizione
delle metalloproteasi, alla riduzione dei livelli delle citochine pro-infiammatorie e all’aumento di
collagene. Cosi una prospettiva futura per i ricercatori, potrebbe consistere nel cercare di separare le
funzioni antibiotiche delle tetracicline dalle proprietà non antibiotiche.
Per quel che riguarda lo spinoso problema della resistenza batterica, i nuovi derivati noti come
glicilcicline [24] potrebbero rappresentare degli interessanti agenti utilizzabili dal punto di vista
clinico.
Le glicilcicline mostrano, infatti, attività contro ceppi che esprimono diversi geni della resistenza
(tet), compresi quelli della protezione ribosomiale e quelli dei meccanismi di efflusso.
Le glicilcicline, competono con le tetracicline per il legame al ribosoma ma hanno una più alta
affinità per i ribosomi rispetto a quella mostrata dalle prime tetracicline; probabilmente questa è la
ragione per cui le proteine di protezione ribosomiale sono incapaci di conferire resistenza alle
glicilcicline. È stata anche indagata, dal punto di vista molecolare, la capacità delle glicilcicline di
36
essere attive contro ceppi contenenti i geni codificanti le proteine di efflusso: questa attività
potrebbe essere dovuta all’incapacità di queste proteine di riconoscere le glicilcicline o
all’incapacità di questi trasportatori di traslocare le glicilcicline attraverso la membrana
citoplasmatica.
In ogni caso, alla base rimarrebbe l’incapacità effettiva di rimuovere le glicilcicline dal citoplasma
batterico, cosicché potrebbero essere mantenute le concentrazioni necessarie a prevenire la sintesi
proteica.
Utilizzando vescicole preparate da E. coli esprimenti la proteina di efflusso Tet(B), Someya e altri
[24], hanno riscontrato che la 9-(N,N-dimetilglicilamido)-6-demetil-6-desossitetraciclina non è
riconosciuta e non è legata dalla proteina di efflusso.
Diversi studi [24] sono stati condotti per valutare l’efficacia dell’impiego delle glicilcicline nelle
infezioni del tratto respiratorio, della pelle, del tratto urinario, nelle infezioni enterococciche, nelle
infezioni anaerobiche, nella gonorrea e nelle infezioni cutanee causate da micobatteri.
In aggiunta, la 9-(t-butilglicilamido)-minociclina (tigilciclina; GAR-936) potrebbe essere
terapeuticamente utile nei pazienti affetti da fibrosi cistica da P. aeruginosa.
Recentemente, sono stati esaminati 1730 casi clinici in due studi con le glicilcicline e con le
tetracicline classiche: le tigilcicline si sono rivelate da due a quattro volte più attive della
minociclina e da due a sedici volte più attive della tetraciclina contro le Enterobacteriaceae.
Tuttavia, sono stati riportati casi di resistenza anche alle glicilcicline; per questo motivo è
necessario sviluppare nuove strategie per combattere la resistenza batterica, cosi come la ricerca di
nuovi principi attivi che agiscano attraverso un unico meccanismo d’azione antibatterico.
Importante è anche capire quale sia il destino [24] delle tetracicline nell’ambiente: infatti, i
nutrimenti di animali supplementati con tetracicline vanno a finire direttamente nel suolo e
nell’acqua e non è chiaro quanto a lungo le tetracicline possano rimanere attive in questi ambienti.
Sarebbe necessario sviluppare metodi di detossificazione ambientale dagli antibiotici, incluse quindi
le tetracicline. Sostanze antibatteriche , come il triclosan, sono aggiunte a diversi prodotti di uso
comune come saponi, giocattoli per bambini e vestiti. Come queste sostanze provochino lo sviluppo
di resistenza batterica, ancora non è del tutto chiaro.
L’unico modo, per conservare le tetracicline e gli altri antibiotici come risorse reali per le prossime
generazioni, è in realtà cercare di ridurre la quantità di antibiotici usati attualmente in tutto il mondo
per la produzione di medicine e di cibo per gli uomini e per gli animali.
37
BIBLIOGRAFIA
1.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona
edizione,pag.1092.
2.Carlo Runti, “Fondamenti di chimica farmaceutica”, pag.810.
Figura n.1. www. Chm.bris.ac.uk/motm/tetracicline/relat.htm
3.Dante Bassetti, “Chemioterapici antinfettivi e loro impiego razionale”, Intamed communications,
sesta edizione, pag.231.
4.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona edizione,
pag.1094.
5.Maur Neuman, “Vademecum degli antibiotici ed agenti chemioterapici anti-infettivi”, Sigma-tau,
quarta edizione, pag.359.
6.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona edizione,
pag.1095.
7.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona edizione,
pagg.1097-1098.
8.Maur Neuman, “Vademecum degli antibiotici ed agenti chemioterapici anti-infettivi”, Sigma-tau,
quarta edizione, pag.370.
9.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona edizione,
pag.1095.
10.Maur Neuman, “Vademecum degli antibiotici ed agenti chemioterapici anti-infettivi”, Sigmatau, quarta edizione, pagg.360-361.
11.Dante Bassetti, “Chemioterapici antinfettivi e loro impiego razionale”, Intamed
communications, sesta edizione, pag.233.
12.Dante Bassetti, “Chemioterapici antinfettivi e loro impiego razionale”, Intamed
communications, sesta edizione, pag.235.
13.Maur Neuman, “Vademecum degli antibiotici ed agenti chemioterapici anti-infettivi”, Sigmatau, quarta edizione, pag.363.
38
14.www.google.it, Manuale Merck, “Tetracicline”.
15.Dante Bassetti, “Chemioterapici antinfettivi e loro impiego razionale”, Intamed
communications, sesta edizione, pagg.234-238.
16.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona edizione,
pag.1097
17.Maur Neuman, “Vademecum degli antibiotici ed agenti chemioterapici anti-infettivi”, Sigmatau, quarta edizione, pag.357.
18.Carlo Runti, “Fondamenti di chimica farmaceutica”, pag.815.
19.Carlo Runti, “Fondamenti di chimica farmaceutica”, pag.817.
20.Carlo Runti, “Fondamenti di chimica farmaceutica”, pag.818.
21.Dante Bassetti, “Chemioterapici antinfettivi e loro impiego razionale”, Intamed
communications, sesta edizione, pagg.236-237.
22.Carlo Runti, “Fondamenti di chimica farmaceutica”, pagg.820-822.
23.Dante Bassetti, “Chemioterapici antinfettivi e loro impiego razionale”, Intamed
communications, sesta edizione, pag.235.
24.Ian Chopra and Marilyn Roberts, “ Tetracycline Antibiotics: Mode of action, applications,
molecular biology, and epidemiology of bacterial resistance”, Microbiology and Molecular Biology
Reviews, June 2001, pagg.232-260, vol.65, No.2.(PUB MED)
25.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona edizione,
pag.1095.
Figura n.2.www.med.unibs.it/dip-SBB/set-farm/pdf
Figura n.3.Goodman & Gilman, “Le basi farmacologiche della terapia”, McGraw-Hill, nona
edizione, pag.1095.
Figura n.4.www.med.unibs.it/dip-SBB/set-farm/pdf
Figura n.5.www.med.unibs.it/dip-SBB/set-farm/pdf
Figura n.6.Peter Orth, Dirk Schnappinger, Wolfgang Hillen, Wolfram Saenger and Winfried
Hinrichs, “Structural basis of gene regulation by the tetracycline inducibile Tet repressor-operator
system“, Nature Structural Biology, vol.7 number 3,march 2000.(PUB MED)
26.G.Delfino, E.Panciotti, G.Liguri e M.Stefani, “Biologia e Medicina”, Dizionario Enciclopedico
di Scienze Biologiche e Mediche, Italiano-Inglese, Inglese-Italiano, Zanichelli 1995, pag.529.
39
Figura n.7 Ian Chopra and Marilyn Roberts, “ Tetracycline Antibiotics: Mode of action,
applications, molecular biology, and epidemiology of bacterial resistance”, Microbiology and
Molecular Biology Reviews, June 2001, pagg.232-260, vol.65, No.2.(PUB MED)
27.Michele La Placa “Principi di Microbiologia Medica”, società editrice Esculapio, ottava
edizione 2000, pag.193.
Figura n.8 www.med.unibs.it/dip-SBB/set-farm/pdf
28.Mateen A. Khan, Jamal Mustafa and Javed Musarrat, “Mechanism of DNA strand breakage
induced by photosensitised tetracycline-Cu(II) complex”, Mutation Research/Fundamental and
Molecular Mechanisms of Mutagenesis, vol.525, Issues 1-2, 9 April 2003, pagg.109-119.(PUB
MED)
29.Marta Pioletti, Frank Schlunzen, Jorg Harms, Raz Zarivach, Marco Gluhmann, Horacio Avila,
Anat Bashan, Heike Bartels, Tamar Auerbach, Carsten Jacobi, Thomas Hartsch, Ada Yonath, and
Francois Franceschi, “Crystal structures of complexes of the small ribosomal subunit with
tetracycline, edeine and IF3”, The EMBO Journal, European Molecular Biology Organization,
vol.20, No.8, pagg.1829-1839, 2001.(PUB MED)
Figura n.9. Marta Pioletti, Frank Schlunzen, Jorg Harms, Raz Zarivach, Marco Gluhmann,
Horacio Avila, Anat Bashan, Heike Bartels, Tamar Auerbach, Carsten Jacobi, Thomas Hartsch, Ada
Yonath, and Francois Franceschi, “Crystal structures of complexes of the small ribosomal subunit
with tetracycline, edeine and IF3”, The EMBO Journal, European Molecular Biology Organization,
vol.20, No.8, pagg.1829-1839, 2001.(PUB MED)
Figura n.10. Marta Pioletti, Frank Schlunzen, Jorg Harms, Raz Zarivach, Marco Gluhmann,
Horacio Avila, Anat Bashan, Heike Bartels, Tamar Auerbach, Carsten Jacobi, Thomas Hartsch, Ada
Yonath, and Francois Franceschi, “Crystal structures of complexes of the small ribosomal subunit
with tetracycline, edeine and IF3”, The EMBO Journal, European Molecular Biology Organization,
vol.20, No.8, pagg.1829-1839, 2001.(PUB MED)
30.Peter Orth, Dirk Schnappinger, Wolfgang Hillen, Wolfram Saenger and Winfried Hinrichs,
“Structural basis of gene regulation by the tetracycline inducibile Tet repressor-operator system“,
Nature Structural Biology, vol.7 number 3,march 2000.(PUB MED)
Figura n.11.Peter Orth, Dirk Schnappinger, Wolfgang Hillen, Wolfram Saenger and Winfried
Hinrichs, “Structural basis of gene regulation by the tetracycline inducibile Tet repressor-operator
system“, Nature Structural Biology, vol.7 number 3,march 2000.(PUB MED)
40
Figura n.12. Peter Orth, Dirk Schnappinger, Wolfgang Hillen, Wolfram Saenger and Winfried
Hinrichs, “Structural basis of gene regulation by the tetracycline inducibile Tet repressor-operator
system“, Nature Structural Biology, vol.7 number 3,march 2000.(PUB MED)
Figura n.13. Peter Orth, Dirk Schnappinger, Wolfgang Hillen, Wolfram Saenger and Winfried
Hinrichs, “Structural basis of gene regulation by the tetracycline inducibile Tet repressor-operator
system“, Nature Structural Biology, vol.7 number 3,march 2000.(PUB MED)
31.Monique M. Gerrits, Marcel R. de Zoete, Niek L. A. Arents, Ernst J. Kuipers, and Johannes G.
Kusters, “16S rRNA Mutation-Mediated Tetracycline Resistance in Helicobacter pylori”,
Antimicrobial Agents and Chemotherapy, September 2002, pagg.2996-3000, vol.46, No.9.(PUB
MED)
32.Mark L. Nelson, Wolfgang Hillen and Robert A. Greenwald, “Tetracyclines in Biology,
Chemistry and Medicine”, ChemBioChem 2003,1, 235-236.(www.biologie.uni-erlangen.de/my
colab/ pdf)