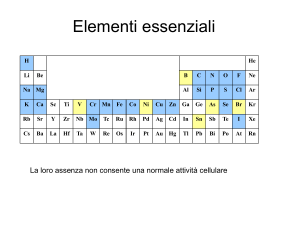
I COMPOSTI DI COORDINAZIONE:
sono molecole o ioni in cui un catione
metallico è legato con un determinato
numero di molecole o ioni negativi.
[Fe(CN)6]3-
Carica della molecola
Numero di
coordinazione
coordinatore
legante
Lo ione metallico, detto coordinatore, agisce
come un acido di Lewis mentre i leganti come
basi di Lewis.
Lo ione rameico è in grado di accettare dei
Dei doppietti elettronici,
L’ammoniaca è in grado di fornirli.
Si formano dei legami
Dativi in cui l’ammoniaca è il donatore ed il
rame l’accettore
È il numero di leganti che il coordinatore
riesce a legare.
Esempio:
[Fe(CN)6]3[Cu(NH3)4]2+
in questo caso il ferro coordina ben
6 gruppi CNin questo caso il rame coordina ben
4 molecole di ammoniaca.
Il pH
Lo ione nichel in presenza di ammoniaca può
reagire con la stessa formando due composti:
[Ni(NH3)6]3+
[Ni(NH3)4]2+
La natura del legante.
Lo ione cobalto può cambiare il suo numero di
coordinazione in base al legante:
[Co(NO2)6]3-
[Co(SCN)4]2-
1.
Devono possedere almeno un doppietto
elettronico da donare al metallo può essere
neutro o carico negativamente.
1. Leganti neutri: NH3, CO, NO (monodentati)
2. Leganti carichi negativamente (anioni)
OH- , CN- , S CN- , S2O32- , NO2QUANDO HANNO 2 O PIU’ l.p. SONO DETTI
BIDENTATI O POLIDENTATI.
L’ETILEN DI AMMINA REAGISCE CON IL PLATINO NEL RAPPORTO DI 2 A 1
ED OGNI ATOMO DI AZOTO FORNISCE UN DOPPIETTO ELETTRONICO.
Si tratta della molecola dell’acido etilen diammino tetra acetico, è un esad
Le caratteristiche di un coordinatore sono le
seguenti:
1. Alta carica
2. Piccole dimensioni
3. Lacune elettroniche.
1.
2.
3.
Si scrive il simbolo del coordinatore,
seguito da quello del legante ed il numero
di coordinazione e fuori dalle parentesi
quadre la carica (ottenuta dalla somma
algebrica delle singole cariche.
Solo nel caso di complessi anionici il
coordinatore prende la desinenza –ato.
Il numero di leganti si indica con i prefissi
di- tri- tetra- penta-………
Formula
Nome
[Fe(CN)6]3-
esacianoferrato(III)
[Co(SCN)6]3-
esatiocianocobaltato(III)
[CrCl4(H2O)2]-
diaquotetraclorocromato(III)
[Cu(NH3)4]2+
tetramminorame(II)
[CoCl2(NH3)4]+
tetraamminodiclorocobalto(III)
[Be(H2O)4]2+
tetraaquoberillio(II)
[Ni(CO)4]
tetracarbonilnichel(0)
Fine prima parte (27 febbraio 2012)
La stabilità di uno ione complesso si misura dalla costante di equilibrio
della sua reazione in soluzione.
Esempio:
[Cu(NH3)4]2+
Cu2+ + 4 NH3
Keq o Kinst= [Cu2+] x [NH3 ]4
[Cu(NH3)4]2+
= Kinst
= 1,0 10-12.
In realtà le reazioni di complessazione sono reazioni di sostituzione in cui
il legante sostituisce le molecole di acqua dello ione solvatato.
Facendo l’inverso della costante di instabilità si
ottiene quella di stabilità o di formazione.
Più alto è il valore della costante di stabilità più
stabile è il complesso, quindi meno facilmente
libererà in soluzione i suoi componente.
I complessi metallici in soluzione si formano per
reazioni successive e si possono scrivere le costanti
per ciascun stadio:
Ag+ + NH3 Ag(NH3)+
Ag(NH3)+ + NH3 [Ag(NH3)2]+
K1
K2
K1 e K2 sono costanti di equilibrio parziali. Se
scriviamo l’equilibrio globale di formazione del
complesso:
Ag+ + 2 NH3 [Ag(NH3)2]+
Kstab = K1K2
La costante globale di stabilità è il
prodotto delle costanti parziali ed è un
indice delle concentrazioni relative
delle specie all’equilibrio.
Naturalmente si può scrivere
l’equilibrio nel senso della
dissociazione del complesso: per tale
equilibrio si ha la costante di
instabilità che sarà uguale al reciproco
della costante di stabilità.
Esempio: Calcolare la concentrazione delle specie
presenti in una soluzione 1,80 10-2 M dello ione complesso
[Cu(NH ) ]2+ sapendo che K
-12
3 4
inst = 1,0 10 . (da Vaglio
pag.287)
In soluzione acquosa lo ione complesso [Cu(NH3)4]2+ è
parzialmente dissociato in ioni Cu2+ e in NH3, secondo
l’equilibrio:
[Cu(NH3)4]2+ Cu2+ + 4 NH3
La costante di tale equilibrio si identifica con la costante
di instabilità del complesso:
Kinst = [Cu2+] [NH3]
[Cu(NH3)4]2+
Data la conc. iniziale del complesso possiamo ricavare le conc. delle specie
all’equilibrio seguendo il solito procedimento:
[Cu(NH3)4]2+ Cu2+ + 4 NH3
i
1,80 10-2
/
/
V
-x
+x
+4x
e
1,80 10-2-x
x
4x
Kinst = [Cu2+] [NH3] = x (4x)4
= 256 x5
;
[Cu(NH3)4]2+ 1,80 10-2-x
1,80 10-2-x
trascuriamo la x al denominatore, per cui si ottiene:
256 x5
;
x = 5 7,0 10-17 = 5,9 10- 4
1,80 10-2
Si può notare che x non è del tutto trascurabile, per cui si dovrebbe procedere
a delle approssimazioni successive. Senza procedere, si ha:
[Cu(NH3)4]2+ = 1,80 10-2 – 5,9 10-4 = 1,74 10- 2 M
[NH ] = 4 x 5,9 10- 4 = 2,4 10-3 M
[Cu2+] = 5,9 10- 4 M
3
1,0 10-12 =
TITOLAZIONI COMPLESSOMETRICHE
Le titolazioni complessometriche sono basate sulla formazione di un complesso
tra il titolante e il titolato.
Una reazione di complessazione può essere usata a fini analitici se:
•complessi stabili: la ki deve essere abbastanza piccola in modo che vicino al punto
equivalente si registri una notevole variazione dello ione cercato
•reazione di stechiometria certa
•raggiungere l’equilibrio rapidamente
Titolazioni complessometriche
Solitamente reazioni che coinvolgono leganti monofunzionali non hanno
questi requisiti. Per tale motivo si usano i leganti polifunzionali (CHELANTI)
che contengono più gruppi complessanti in una stessa molecola (formazione
di CHELATI)
Acido etilendiamminotetraacetico (EDTA)
(LEGANTE ESADENTATO)
Ka1= 1.02x10-2
Ka2= 2.14x10-3
Ka3= 6.92x10-7
Ka4= 5.5x10-11
Struttura delle forme
protonate dell’EDTA
ACIDO
Ka1= 1.02x10-2
Ka2= 2.14x10-3
Ka3= 6.92x10-7
Ka4= 5.5x10-11
BASE
Ka1= 1.02x10-2
Ka2= 2.14x10-3
Ka3= 6.92x10-7
Ka4= 5.5x10-11
L’EDTA è un acido tetraprotico, leggendo i valori delle
4 costanti di equilibrio (o costanti acide) possiamo notare che
per i primi due valori possiamo considerarlo
Un acido abbastanza forte, mentre gli altri due idrogeni vengono
ceduti a pH rispettivamente pari a 6 e a 10.
Ciò giustifica che l’analisi della durezza delle acque
viene fatta utilizzando un tampone a pH= 10
L’EDTA è il chelante di scelta nelle titolazioni complessometriche per i seguenti motivi:
- forma chelati con tutti i cationi (eccetto metalli alcalini)
- la maggior parte dei chelati è stabile (struttura a gabbia del chelato)
Struttura complesso
chelato metallo/EDTA
Determinazione del punto finale in complessometria
La determinazione del punto finale viene di solito rivelata con indicatori metallo-cromici (per
esempio il NET formano chelati colorati già alla conc. pari a 10-7M) o mediante metodi
strumentali sensibili alla conc. del metallo libero.
L’indicatore deve soddisfare i seguenti requisiti:
- deve dare una reazione cromatica netta e sensibile
- deve dare un complesso abbastanza stabile con il metallo ma meno stabile di
quello EDTA-metallo
- deve dare una reazione rapida con il metallo
M + In M-In
Colore A
Colore B
M-In + EDTA EDTA-M + In
L’indicatore ottimale soddisfa i seguenti requisiti:
Kstabilità M-In=
[M-In]
[M][In]
105
e
Kstab EDTA-M
Kstab M-Ind
= 104
Fine 2° parte
www.smauro.it