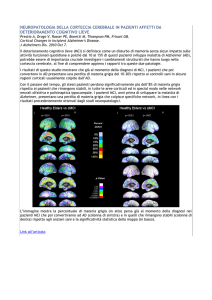
RIASSUNTO DELLA SEGUENTE LINEA GUIDA
“ACC/AHA/ESC 2006 Guidelines for Management of Patients
With Ventricular Arrhythmias and the Prevention of Sudden
Cardiac Death”
EPIDEMIOLOGIA DELLE ARITMIE VENTRICOLARI E DELLA MORTE
CARDIACA IMPROVVISA
L’epidemiologia delle aritmie ventricolari e della morte improvvisa cardiologica spazia dai battiti
ectopici ventricolari ( BEV ) alla tachicardia ventricolare non sostenuta (TVNS) alla morte cardiaca
improvvisa ( MCI) da tachiaritmie ventricolari in cuore patologico o normale.
BEV E TVNS: sono state studiate sia in soggetti normali che in cuori patologici. I BEV non
portano ad aumentata mortalità in pazienti con cuori esenti da patologie. Invece i BEV durante
sforzo sembrano incrementare la mortalità. Nei pazienti con patologie cardiache i BEV e le TVNS
portano ad un aumento di mortalità legato alla patologia di base. Dopo IMA una presenza continua
di BEV e TVNS porta ad aumentata mortalità se la frazione di eiezione è ridotta.
TV ed FV dopo cardiopatia ischemica acuta : se avvengono nelle prime 24-48 ore non
incrementano la mortalità. Ma nei pazienti con NSTEMI tale mortalità è invece incrementata
probabilmente per una propensione del miocardio ischemico alle tachiaritmie.
MORTE CARDIACA IMPROVVISA: in USA ci sono 250000-300000 morti improvvise, idem in
Europa. L’incidenza varia con le regioni e con i criteri vari di inclusione. Infatti il criterio temporale
varia nei diversi studi: morte a 1 ora dai sintomi o a 24 ore dai sintomi.
PREDITTORI DEL RISCHIO DI MCI:
Tempo: entro 18 mesi si ha il rischio massimo dopo evento ischemico
Età : la morte improvvisa cardiaca aumenta con l’età fino a 80 anni poi decresce
Sesso: più colpiti in età giovanile i maschi
Ereditarietà: stanno emergendo geni che favoriscono il formarsi della placca aterosclerotica.
Razza: è più alta tra gli Afro Americani
Non esistono , oltre a quelli usati nella stratificazione del rischio coronarico,
altri metodi per stratificare il rischio della morte improvvisa cardiaca.
MECCANISMI E SUBSTRATI
Tre quarti delle morti cardiache improvvise sono in coronaropatici. Ma il
restante quarto coinvolge la cardiomiopatia ipertrofica, la cardiomiopatia
dilatativa, la cardiomiopatia del ventricolo destro, anomalie congenite ( ad
esempio anomalie coronariche ), spasmi coronarici e altro. L’obesità, il fumo,
l’ipertensione e il diabete sono fattori di rischio. In età giovanile pre
coronaropatia, la cardiopatia ipertrofica e la cardiomiopatia destra sono le
cause più frequenti. Il prolasso della mitrale non ha mai dimostrato essere
legato a MCI mentre il WPW dà MCI nello 0.15% dei casi legato a Fa
parossistiche. In un 5% dei casi la MCI avviene in assenza di anomalie
cardiache . In questo gruppo sono presenti:
La sindrome del QT lungo
La sindrome del QT corto
La sindrome di Brugada
TV catecolaminergica
Si stanno studiando i canali del sodio e del potassio nel sarcolemma miocardico che
possono portare a alterazioni tali da generare aritmie e si pensa che in questo campo
la ricerca porterà ad individuare altri gruppi di pazienti a rischio.
MECCANISMI DI MCI
FV nell’80% dei casi, bradi-asistolia nel restante 20%.
QUADRO CLINICO DI PRESENTAZIONE
VALUTAZIONE GENERALE DEL PAZIENTE CON SOSPETTA O ACCERTATATA
ARITMIA VENTRICOLARE.
Cardiopalmo,sincope e presincope sono i tre sintomi sospetti per aritmia ventricolare. Il
cardiopalmo con inizio e termine improvvisi, la sincope senza prodromi sono ad alto rischio.
Spesso si associano a dispnea, toracalgia e astenia. Una attenta indagine farmacologica e famigliare
è utile visto che possono coesistere familiari deceduti per MCI. L’esame obiettivo, in assenza di
aritmia è spesso nei limiti.
VALUTAZIONE NON INVASIVA
ECG A RIPOSO : deve essere eseguito in tutti i pazienti ( classe I ) permettendo di escludere la
sindrome di Brugada, del QT lungo e corto, la cardiopatia aritmogena del ventricolo destro,
alterazioni aspecifiche da disionie, deficit di conduzione.. Un QT calcolato maggiore di 440 msec o
minore di 300 msec è associato a una maggior mortalità.
TEST DA SFORZO: è utile nei pazienti con rischio intermedio-alto di ischemia miocardica o nei
pazienti con aritmie indotte dallo sforzo come la TV catecolaminergica ( classe I ). E’ pure utile per
dimostrare l’avvenuta ablazione di una via anomala o l’effetto terapeutico( classe IIa )
REGISTRAZIONE CONTINUA DELL’ ECG: è utile per mettere in relazione sintomi ed ECG. Se
gli episodi sono frequenti basta una registrazione di 24-48n ore altrimenti occorre impiantare un
loop recorder.
MISURAZIONI E TECNICHE ELETTROCARDIOGRAFICHE: ci sono molte modalità per
individuare dall’ ECG i pazienti a rischio di MCI ma due sono state accettate dal U.S. Food and
Drug Administration (FDA):
SAECG ( signal-averaged electrocardiography)
TWA ( T-wave alternans )
Comunque la sensibilità baracettoriale e il HRV (heart rate variability)
hanno dato buone indicazioni.
La SAECG è una registrazione fine dell’ECG di superficie per evidenziare potenziali tardivi. Questi
favoriscono i circuiti di rientro ventricolari.
La TWA è invece un continuo cambio di morfologia della onda T che si associa a una più alta
percentuale di morti improvvise sia nelle cardiopatie ischemiche che nelle dilatative e ipertrofiche.
La HRV è una continua variabilità della durata del ciclo cardiaco legata ad una maggior incidenza
di morte improvvisa nei pazienti post IMA
ECOCARDIOGRAFIA: ha diversa utilità a seconda delle patologie.
RISONANZA MAGNETICA NUCLEARE: particolarmente utile nella diagnosi di cardiopatia
aritmogena del ventricolo destro.
TAC: scarsa importanza visto l’uso dell’ecocardiografia
CORONAROGRAFIA: viene eseguita in tutti i pazienti a rischio moderato-alto di cardiopatia
ischemica.
TEST ELETTROFISIOLOGICO: viene usato per indurre eventualmente aritmie ventricolari ed
eseguire eventuali ablazioni del circuito di rientro. Nelle forme ischemiche è utile per valutare
alcune dubbie aritmie ventricolari accompagnate da sincope o cardiopalmo. E’ pure consigliato in
caso di sincope in pazienti con FE < 40% o con patologie cardiache.
TERAPIA DELLE ARITMIE VENTRICOLARI
La terapia della BEV, TV non sostenuta, TV sostenuta monomorfa, polimorfa, FV presuppone la
conoscenza della loro genesi, delle condizioni cliniche che le favoriscono, il rischio della aritmie e
degli eventuali farmaci da utilizzare.
TERAPIA FARMACOLOGICA ANTIARITMICA
BETABLOCCANTI: utili nel ridurre i BEV, le aritmie ventricolari e le MCI. Agiscono riducendo
la frequenza cardiaca
SOTALOLO E AMIODARONE: non hanno dimostrato ridurre i casi di MCI . Inoltre il sotalolo ha
determinato episodi proaritmici e l’amiodarone ha causato ipertiroidismo e fibrosi polmonare.
L’amiodarone e il sotalolo sono da usare in pazienti con ICD in quanto riducono il numero di
scariche. In pazienti a rischio aritmico ma senza indicazione all’ ICD i betabloccanti sono da
preferire e se non sono sufficienti aggiungere l’amiodarone con attenzione agli effetti collaterali.
In pazienti con ICD con frequenti episodi di TV l’associazione amiodarone - betabloccanti è
migliore del sotalolo perchè quest’ultimo riduce la FE e tutti questi pazienti hanno di base una FE
ridotta.
TERAPIA FARMACOLOGICA NON ANTIARITMICA
ELETTROLITI: l’uso di potassio e magnesio iv in acuto e per os in cronico riduce la MCI .in
quanto altera il substrato fisiologico dei circuiti di rientro. Sono particolarmente utili in cosa di
carenza elettrolitica ma pure in caso di non carenza. Il rimodellamento miocardico dopo cardiopatia
ischemica o dilatativa favorisce i circoli di rientro e farmaci come acei, bloccanti i recettori
dell’aldosterone e dell’angiotensina II bloccano questo rimodellamento.
ASA E ANTICOAGULANTI: riducono la MCI di origine ischemica miocardica
ACIDI GRASSI omega3 : non ci sono studi risolutivi ma sembra che si comportino come
antiaritmici
STATINE: riducono la MCI stabilizzando le membrane
TERAPIA NON FARMACOLOGICA
CARDIOVERTITORI INTERNI ED ESTERNI
ICD (Implantable Cardioverter-Defibrillator): ha portato a una riduzione della mortalità del 35-55
% a seconda della patologia di base.
DEFIBRILLATORE AUTOMATICO ESTERNO: viene consigliata la presenza sui luoghi di
lavoro con personale addestrato all’uso.
DEFIBRILLATORE AUTOMATICO INDOSSABILE : si usa sotto i vestiti e serve come misura
tampone in attesa dell’ ICD, in caso di ablazione dell’ ICD per sepsi, in caso di momentaneo rischio
aritmico.
ABLAZIONE
E’ indicata in pazienti con TV monomorfa sostenuta non dominata da farmaci, in pazienti con ICD
e frequenti shock, in pazienti con WPW ed episodi di fa con un episodi di RCP.
TRATTAMENTO ACUTO DI PARTICOLARI ARITMIE
ARRESTO CARDIACO: è una improvvisa perdita di flusso cardiaco con conseguente perdita di
coscienza. La causo più frequente e con miglio prognosi è la TV-FV ma pure bradiasistolia e PEA
sono responsabili con prognosi peggiore.
TV ASSOCIATA A INFARTO MIOCARDICO ACUTO A BASSA TROPONINA: il trattamento
è simile a quello della TV con infarto miocardico con troponina non elevata
TV MONOMORFA SOSTENUTA: una tachicardia a QRS larghi è una TV presunta. Una
cardioversione elettrica è indicata in ogni momento in caso di compromissione emodinamica.
L’amiodarone è ragionevole ( IIa) in caso di TV monomorfa instabile refrattaria alla
cardioversione. La lidocaina è ragionevole ( IIb) in caso di cause ischemiche miocardiche. I
calcioantagonisti non diidropiridinici non vanno usati in caso di tachicardie a QRS largo (III)
TV MONOMORFA RECIDIVANTE: Amiodarone, betabloccanti sotalolo sono indicati in tali
situazioni ( IIa)
TV POLIMORFA: la cardioversione è indicata in qualunque momento. I betabloccanti sono
indicato se la causa è ischemica ( I ) Anche l’amiodarone se il paziente non ha un QT lungo
congenito a acquisito (I).La lidocaina è invece in classe IIb.
TORSIONE DI PUNTA: interruzione di tutti i farmaci e anomalie elettrolitiche che causano
torsione di punta. Il pacing è indicato in caso di torsione in seguito a bradicardia. Il magnesio è utile
in caso di QT lungo ( IIa). Il potassio è ragionevole ( IIb ) come la lidocaina ( IIb)
TV INCESSANTE: sono plurimi episodi di TV che necessitano defibrillazione. Una variante è
quella data da plurime scariche consecutive di un ICD. Rivascolarizzazione, betabloccanti,
amiodarone sono raccomandati ( I ), dopo la risoluzione l’amiodarone è da usare per ridurre le
recidive ( IIa ). Un overdrive pacing è utile ( IIb ) .
ARITMIE VENTRICOLARI E MCI COLLAGATE A SPECIFICHE PATOLOGIE
ARITMIE ASSOCIATE A PRECEDENTE SINDROME CORONARICA ACUTA: si manifestano
3 tipi di tachiaritmie ventricolare:
TV non sostenuta: 3 o più battiti ventricolari ma per meno di 30 secondi
TV sostenuta
Arresto cardiaco da TV-FV
La TVNS non necessita di terapia a meno che non abbia compromissione emodinamiche. In tal caso
si usa amiodarone o sotalolo.
La TV sostenuta che non degrada in arresto cardiaco, se rara, può essere trattata con l’ ICD. Se
frequente sono utili studi elettrofisologici e l’ablazione del circuito
Un episodio di TV-FV dopo 24-48 ore dall’ IMA è un segno prognostico negativo e il paziente deve
essere trattato con ICD.
ARITMIE ASSOCIATE A VALVULOPATIA : devono seguirsi le linee guida su ciascuna
patologia valvolare. Non è ben stabilita ( II b ) la terapia nel caso di prolasso mitralico, rigurgito
mitralico severo con aritmie severe.
ARITMIE ASSOCIATE A PATOLOGIE CARDIACHE CONGENITE: i pazienti con cardiopatie
congenite sopravvissute a un arresto cardiaco con prospettive di vita > 1 anno devono essere trattate
con ICD. Se invece hanno sperimentato un TV sostenuta devono essere sottoposti a studio
elettrofisiologico e terapia ablativa.
ARITMIE ASSOCIATE A MIOCARDITI, ENDOCARDITI E PATOLOGIE
REUMATOLOGICHE:
In caso di BAV avanzato in corso di miocardite è indicato un pacing temporaneo, in pazienti con
pregressa miocardite ed episodio di aritmia ventricolare a rischio di vita e con una prospettiva di
vita > 1 anno è indicato l’impianto di un ICD ( classe IIa ) , in caso invece di miocardite acuta in
corso può bastare una terapia antiaritmica in quanto durante l’episodio acuto il posizionamento di
un ICD è classe III.
La miocardite è un processo infiammatorio acuto miocardico, di solito di tipo infettivo ma può
essere dovuto ad altre cause ( radiazioni, sostanze chimiche). Gli agenti infettivi più comuni sono i
virus, poi vengono i batteri, miceti, protozoi, spirochete, rickettsie. L’evoluzione varia come i
sintomi di esordio. Ci possono essere forme asintomatiche riconoscibili solo all’ECG con
alterazioni dell’ST-T a forme che simulano l’attacco ischemico miocardico. Le aritmie associate
vanno da un difetto lieve di conduzione ad aritmie ventricolari a rischio di vita. Il decesso avviene
per scompenso cardiaco o per aritmie includenti il BAV di grado elevato. Il pacing è indicato in
caso di BAV avanzato sintomatico. L’evoluzione può essere la cardiomiopatia cronica, che se
associata ad aritmie ventricolari necessita di ICD con le stesse indicazione dello scompenso
cardiaco e delle miocardiopatie. La miocardite a grandi cellule idiopatia è tipica dei giovani ,è rara
ma mortale se non trattata. La diagnosi basa sulla biopsia miocardica. La miocardite di Lyme da
borelliosi risponde bene alla terapia antibiotica. Altre forme di miocardite sono quelle da HIV e da
tripanosoma cruzi ( patologia di Chagas).
La febbre reumatica acuta si associa ad interessamento miocardico, pericardico ed endocardico con
alterazione dell’ ST-T non specifici, BAV di vario grado, QT lungo
Le endocarditi infettive possono essere subacute o acute. Le forme subacute sono per lo più dovute
a streptococco di partenza urinaria o gastrointestinale e si instaurano su valvole alterate. Le forme
acute sono dovute a stafilococco aureo che si impianta su valvole sane. Se non trattata l’endocardite
è mortale, soprattutto se interessa la valvola mitrale ed aortica con embolizzazione e occlusione
coronarica. Rare sono le aritmie ma un ascesso del setto può portare a BAV di grado elevato.
L’antibioticoterapia è di 1° scelta ma in caso di ascesso non rispondente è utile la terapia chirurgia
come nel caso di grave insufficienza aortica. In caso di aritmie il trattamento non differisce
dall’usuale.
ARITMIE ASSOCIATE A CARDIOMIOPATIE INFILTRATIVE :
La sarcoidosi colpisce il cuore nel 25% dei casi con una sintomatologia che mal si correla con il
quadro anatomopatologico. La MCI può essere il primo sintomo cardiaco. Le aritmie sopra e sotto
ventricolari sono frequenti e nel 65% dei casi si presenta BAV. I corticosteroidi riducono le aritmie
e la MCI ma possono favorire la fibrosi e l’insorgenza di circuiti da rientro. Non esistono trials
prospettici ma in casi selezionati un ICD o un pacemaker possono essere indicati.
Nell’amiloidosi miocardica la prognosi è sempre infausta con una sopravvivenza a 3 anni del 6%.La
morte è per scompenso cardiaco.
La sindrome di Fabry è una patologia ereditaria legata al cromosoma X con carenza di galattosidasi
ed accumulo lisosomiale. Negli uomini con ipertrofia ventricolare sinistra inspiegata la sindrome di
Fabry ha una incidenza del 3-6%. Nelle femmine le manifestazioni sono molto più sfumate visto
che possiedono due cromosomi X. Si manifesta con alterazioni all’ ECG ma la MCI è rara. Con una
terapia di rimpiazzo si sono ridotti i casi di ipertrofia ventricolare e le anomalie di conduzione.
L’emocromatosi interessa il miocardio nel 30% dei casi ma una terapia appropriata rende le lesioni
iniziali reversibili, la MCI non è mai stata indagata. La malattia non trattata porta a scompenso
cardiaco.
PATOLOGIE ENDOCRINE E DIABETE: la patologie endocrine possono creare aritmie e MCI per
un eccesso di attività recettoriale miocardica ( feocromocitoma, ipotiroidismo), per alterazioni
miocardiche ( acromegalia ), per alterazioni elettrolitiche ( iperpotassiemia nell’ Addison,
ipopotassimia nel iperaldesteronismo ), per peggioramento di patologie preesistenti cardiovascolari.
La tireotossicosi causa aritmie atriali, rare le aritmie ventricolari a meno che non ci siano
alterazioni elettrolitiche concomitanti. TV e MCI sono più frequenti nell’ipotiroidismo in relazione
a un QT allungato. La terapia è di correzione dell’anomalia ormonale.
Il feocromocitoma può presentare TV/MCI ma l’incidenza è sconosciuta. La terapia con alfa
betabloccanti riduce la pressione ed evidenze aneddotiche parlano di riduzione di episodi di aritmia
ventricolare. Il trattamento in questi casi è chirurgico.
Nell’acromegalia la MCI è frequente in relazione alla massa miocardica nell’ Holter le aritmie
ventricolari sono frequenti . La terapia chirurgica e ormonale con somatostatina e similari riduce ne
giovani la massa miocardica le aritmie ventricolari.
L’iperaldosteronismo primario, l’iposurrenalismo, causando disionie, portano ad aritmie
ventricolari e MCI. La terapia di correzione elettrolitica ed ormonale riduce le aritmie.
Nel diabete la patologia vascolare predispone a cardiopatia ischemica, aritmie ventricolari e MCI; la
terapia è simile ai pazienti non diabetici. In aggiunta la neuropatia autonomica, gli episodi di
iperglicemia,l’insufficienza renale con episodi di iperpotassiemia aumentano il rischio di MCI.
Anche gli episodi di ipoglicemia aumentando il tono simpatico, favoriscono le aritmie ventricolari
anche con un incremento del QT. I beta bloccanti, pur mascherando i sintomi dell’ipoglicemia,
hanno mostrato aumentare la sopravvivenza come gli ace inibitori e i bloccanti i recettori
dell’aldosterone.
INSUFFICIENZA RENALE IN STADI AVANZATI: il 40% delle morti sono per cause
cardiovascolari e il 20% sono MCI. Durante le 4-5 ore dopo la dialisi le aritmie sono frequenti.
Le cause sono disioniche ma non ci sono dati utili per un efficace trattamento.
OBESITA’, DIETE, ANORESSIA: disordini alimentari estremi e diete estreme sono associate a un
incremento di MCI. Nei forti obesi il rischio di MCI è 40-60 volte superiore, causato da alterazioni
del sistema di conduzione (QT allungato e aumentata dispersione del QT). La cardiomiopatia
dell’obeso è la causa più frequente di MCI, anche in pazienti normotesi. Anche le apnee ostruttive
notturne sono causa di aritmie ventricolari nell’obeso. IL calo ponderale riduce il rischio di MCI
riducendo l’ipertrofia ventricolare nelle forme iniziali e quindi una dieta deve essere iniziata ma ben
bilanciata. Infatti diete ipocaloriche prolungate aumentano il rischio di aritmie ventricolari e MCI
con plurimi meccanismi. L’anoressia-bulimia causa una alta percentuale di morti ma non sempre di
origine cardiaca. L’anoressia prolungata causa atrofia miocardica, versamenti pericardici,
bradicardia sinusale, QT lungo I pazienti con BMI basso o rapidamente ridotto presentano alte
percentuali di QT lungo. Tutte queste alterazioni scompaiono dopo rialimentazione. Nella prima
settimana di rialimentazione in pazienti anoressici cronici possono comparire aritmie ventricolari
da ipofosfatemia.
PATOLOGIE PERICARDICHE : la MCI può avvenire per plurimi motivi legati a processi
restrittivi o costrittivi. Le cause sono traumatiche, neopastiche, flogistiche. Fenomeni aritmici
particolari non sono segnalati per cui si pensa soprattutto a forme di MCI da tamponamento.
IPERTENSIONE POLMONARE: la MCI è la responsabile del 30-40% d morti, maggiormente
nelle ipertensioni polmonari primitive che per tromboembolia. La causa principale è l’ipossia ma
pure l’ischemia miocardica da compressione dell’arteria polmonare principale dilatata sull’ostio
coronarico. Il cateterismo cardiaco è ad alto rischio aritmico e la profilassi antiaritmica non ha dato
benefici, anzi si è notato una alta percentuale di effetti farmacologici pro aritmici per cui la
profilassi è classe III.
ARITMIE TRANSITORIE DA CAUSE REVERSIBILI: le cause reversibili più frequenti sono le
distonie e l’ischemia miocardica. Cause meno frequenti sono l’effetto pro aritmico di farmaci
antiaritmici. Non ci sono studi randomizzati sulla TV/FV ma studi osservazionali riferiscono che
una TV monomorfa in pazienti con precedenti IMA non risente della rivascolarizzazione. La
rivascolarizzazione è efficace in pazienti ripresi dopo FV e ischemia miocardica acuta con
funzione ventricolare nei limiti. La mortalità intraospedaliera in pazienti con FV durante IMA è alta
ma quelli con IMA-Q hanno , se ripresi, la stessa sopravvivenza dei pazienti senza FV, mentre nei
IMA – non Q la mortalità è maggiore. Le alterazioni di potassiemia e magnesemia devono essere
prese in considerazione in caso di arresto inspiegabile. L’uso di antiaritmici che allungano il QT
causa aritmie ventricolari che scompaiono sospendendo il farmaco ma se il paziente ha patologie
miocardiche è indispensabile un attenta valutazione specialistica.
ARITMIE VENTRICOLARI ASSOCIATE A CARDIOMIOPATIE
CARDIOMIOPATIA DILATATIVA: la mortalità a 5 anni è del 20% di cui 1/3da MCI con
FV /TV , embolia polmonare, bradicardia, DEM. Frequenti le sincopi e le aritmie ventricolari. Non
esiste un modo validato per individuare i pazienti a maggior rischio di MCI. La frazione di eiezione
non si è dimostrata utile mentre la sincope è stata associata a più alto rischio. Studi
elettrofisiologiche che riescono ad indurre TV dimostrano un alto rischio di MCI ma la non
induzione non esclude la MCI. La forma idiopatica è pari al 40% di tutti i casi di cardiopatia
dilatativa ed è autosomica dominante, sfortunatamente anche gli studi genetici non sono utili nella
stratificazione della MCI.
Il trattamento farmacologico con betabloccanti e ace inibitori ha ridotto la mortalità e pure le MCI.
L’amiodarone è il più usato nel trattare le aritmie per i suoi scarsi effetti emodinamici. Si è
dimostrato utile però nel ridurre la MCI solo nelle cardiomiopatie dilatative non ischemiche.
L’uso dell’ ICD è controverso. Svariati trial randomizzati controllati hanno fallito nel dimostrare in
modo statistico una minor mortalità rispetto alla terapia con amiodarone.
L’analisi genetica ha fallito nell’indicare la probabilità di MCI ma individua eventuali parenti che
potranno essere successivamente seguiti nella progressione della cardiomiopatia.
CARDIOMIOPATIA IPERTROFICA: molti pazienti sono asintomatici e il primo sintomo è la
MCI dovuta ad aritmie ventricolari con trigger quali una ischemia, una ostruzione al flusso aortico,
una fa. La mortalità annuale è dell’ 1% anche se altri studi parlano del 6%. Si è cercato di
individuare i fattori che aumentano il rischio di MCI.
Lo studio elettrofisiologico può individuare pazienti a rischio di MCI ma è stato messo in classe IIb
in quanto anche un esito negativo non escute la possibilità di MCI. L’amiodarone è il farmaco di
scelta nella prevenzione delle aritmie ventricolari ma non sono stati eseguiti trials con grossi
numeri e non si è dimostrato una riduzione di MCI. Nei pazienti asintomatici la terapia non è utile
ma in pazienti giovani con alto gradiente e severa ipertrofia i betabloccanti e i calcioantagonisti
vengono somministrati. Nei pazienti con TV/FV l’ICD è stato usato con scariche annuali pari all’
11%. L’impianto di ICD profilattico in pazienti con plurimi fattori di rischio per MCI ha dato una
minor percentuale di scariche pari a 5% anno.
L’analisi genetica favorisce l’individuazione di pazienti asintomatici e in alcuni casi la
stratificazione del rischio di MCI.
CARDIOMIOPATIA ARITMOGENA DEL VENTRICOLO DESTRO: si inizia con episodi di
sincope - presincope. L’aritmia ventricolare è tipo BB partendo da BEV, TV non sostenuta,
sostenuta e FV. Occorre fare diagnosi differenziale con la TV idiopatica del ventricolo destro che
però colpisce per lo più il sesso femminile, non è associato ad anomali elettrocardiografiche ed è
iniziato dall’isoproterenolo e non da test elettrofisiologici.. L’ECG nella cardiomiopatia aritmogena
del ventricolo destro mostra T negative in V1-V3 e una durata del QRS > 110 msec. Spesso la MCI
è il primo sintomo della patologia. I pazienti deceduti mostrano di solito alterazioni evidenti al
ventricolo destro ma ci sono pure casi di microlesioni. L’attività fisica è spesso correlata ma si sono
avuti casi di MCI a riposo. L’allargamento del ventricolo destro è legato a questa patologia. I test
elettrofisiologici riescono a indurre TV solo nei pazienti che già hanno avuto episodi di TV. La
terapia con ICD ha dato ottimi risultati con plurime scariche appropriate. Il posizionarlo pure in
pazienti con pregresse sincopi e familiarità è ancora dibattuto. La terapia medica non ha dimostrato
di ridurre la mortalità, il trapianto cardiaco è utile in caso di problemi biventricolari. L’analisi
genetica non contribuisce alla stratificazione ma è utile nel monitoraggio.
DISORDINI NEUROMUSCOLARI: sono patologie che possono predisporre ad aritmie
ventricolari e MCI. Nella tabella vi è un elenco con le principali patologie a rischi di vita.
La più alta percentuale è nella distrofia di Duchenne per cui studi elettrofisiologici e un eventuale
ICD deve essere presi in considerazione. In generale in pazienti asintomatici un ICD non viene
posizionato.
SCOMPENSO CARDIACO: Raccomandazioni di classe I:
L’ ICD è raccomandato nei sopravvissuti da TV instabile e FV, nei pazienti con sincope da
TV con polso e FE < 40% e una sopravvivenza superiore a un anno
L’ICD è raccomandato nei pazienti con FE <40% con buona aspettativa di vita
L’ICD è raccomandato nei pazienti con FE <35% con buona aspettativa di vita
Il sotalolo e l’amiodarone sono farmaci di ausilio nei pazienti con ICD riducendo gli episodi
di TV asintomatici.
SINDROMI ARITMICHE GENETICHE
La sindrome del QT lungo ( QTLS ), la sindrome di Brugada, la TV polimorfa catecolaminergica
sono patologie congenite a rischio aritmie ventricolari e MCI con miocardio cardiaco
strutturalmente nei limiti. Tutti gli studi epidemiologici fin qui eseguiti non hanno dimostrato la
storia naturale della malattia mentre lo studio dell’ ECG ha dimostrato nella QTLS un QT> 500
msec, nella Brugada un ST elevato in V1 V2, nella TV catecolaminergica una TV indotto
dall’esercizio fisico. L’uso dell’ ICD in questi pazienti è imperativo nei sintomatici , da valutare per
gli asintomatici in quanto sono tutti pazienti giovani. Per la QTLS e la TV catecolaminergica i
betabloccanti hanno dimostrato ridurre la MCI, invece non c’è terapia per la Brugada per cui l’ICD
viene usato per la prevenzione primaria maggiormente. La familiarità per MCI è fondamentale nella
stratificazione del rischio . L’attività fisica è negata da alcuni specialisti, ignorata da altri
SINDROME DEL QT LUNGO: è una patologia dovuta a una lunga ripolarizzazione con aritmie
ventricolari che portano a sincope. Possono avvenire durante esercizio o a riposo. La componete
genetica è stata ben studiata inserita nello studio del rischio. I sintomi variano da sincope a MCI.
Sesso, difetto genetico e lunghezza del QT stratificano il rischio di MCI. I pazienti a maggior
rischio sono gli LQT1 e LQT2 con un QT > 500msec e le femmine LQT3 indipendentemente dal
QT. Gli LQT3 sono un sottogruppo a maggior rischio. I betabloccanti sono protettivi per gli LQT1 ,
meno per gli LQT2 e LQT3. La sincope da aritmia ventricolare è la più frequente nei pazienti con
LQTS. Lo stimolo scatenante varia con i vari sottotipi:
LQT1 : esercizio fisico, in particolare il nuoto
LQT2 : riposo, stimoli acustici
LQT3 : riposo, sonno
Risultano quindi ovvie delle modifiche dello stile di vita:
LQT1 deve evitare il nuoto e lo sforzo fisico in generale
LQT2 deve evitare rumori durante il sonno staccando allarmi e telefono.
Tutti devono evitare farmaci che allungano il QT.
L’analisi genetica in questa sindrome è quindi fondamentale.
SINDROME DEL QT CORTO: il QTc è minore di 300 mmsec. All’ECG si accompagna ad
alterazione dell’onda T che è appuntita asimmetrica con branca discendente molto ripida. Sono solo
23 i casi noti con alta mortalità. Non sono stati individuati fattori scatenanti. Lo studio
elettrofisiologico induce l’aritmia ventricolare ma non è noto se è un fattore prognostico. L’indagine
genetica non ha dimostrato stratificare il rischio.
SINDROME DI BRUGADA: ha alterazioni ECGrafiche specifiche associata ad alto rischio di
MCI. Vi è un punto J alto in V1 V2 V3 e un BB destra, ma tale alterazioni possono essere presenti
periodicamente. La MCI o una sincope appaiono per lo più nel sesso maschile verso la 3°- 4°
decade di vita. L’iperpiressia è un fattore predisponente la MCI. Visto che l’ICD è l’unica terapia la
stratificazione del rischio è fondamentale. La storia familiare non è utile nella stratificazione, l’ECG
con alterazioni sembra indicare un maggio rischio rispetto a quello normale con alterazioni indotte
da un bloccante i canali del sodio. I test elettrofisiologici sono dibattuti nella stratificazioni del
rischio e una risposta certa non è nota. Il difetto genetico del gene del canale del sodio non ha dato
ulteriori indicazione nella stratificazione. Ecco le raccomandazioni di questa linea guida:
Classe I: l’ICD è indicato nei pazienti con Brugada sopravvissuti all’arresto cardiaco con
probabilità di sopravvivenza oltre l’anno.
Classe IIa: nei pazienti con alterazioni all’ ECG tipo Brugada, sincope con o senza
alterazioni genetiche tipiche è indicato l’ICD. Se invece le alterazioni ECGrafiche sono
indotte farmacologicamente si consiglia il monitoraggio dell‘ ECG. E’ consigliato l’ ICD
per i Brugada con documentati run di TV senza arresto
Classe IIb: il test elettrofisiologico può essere considerato nello stratificare Brugada
asintomatici con o senza alterazioni genetiche ed ST elevato.
TACHICARDIA VENTRICOLARE POLIMORFA CATECOLAMINERGICA: è una TV che
compare durante stress fisico o emotivo con ECG a riposo nei limiti. Il primo episodio si manifesta
da bambini ma sono documentati casi tardivi. L’origine è genetica autosomica dominante o
recessiva.. I betabloccanti sono raccomandati per la prevenzione della TV ma se questa è
documentata è utile l’ ICD. Il test elettrofisiologico non induce di solito l’aritmia e non è utile. Un
test da sforzo mostra comparsa inizialmente di BEV e poi progressivamente TV non sostenute poi
sostenute fino all’ FV. Visto l’utilità della terapia con betabloccanti lo studio genetico è qui utile.
ARITMIE IN CUORE STRUTTURALMENTE NORMALE
TACHICARDIA VENTRICOLARE IDIOPATICA: quella che origina dal ventricolo destro è la più
frequente ed è benigna se non è associata a patologie cardiache. Ha una morfologia tipo BBsx. E
indotta dall’esercizio fisico. La tachicardia che origina dall’area di eflusso aortico ( LVOT ) o
polmonare ( RVOT) è rara e origina in cuori strutturalmente normali. La LVOT è più frequente
negli uomini. La terapia efficace è con betabloccanti e calcioantagonisti non diidropiridinici,
nell’RVOT gli antiaritmici Ic sono utili. Nei pazienti che rimangono sintomatici l’ablazione del
focus aritmogeno è fondamentale con un successo nell’ RVOT del 90%.
ALTERAZIONI ELETTROLITICHE: alterazioni nel potassio intracellulare, nel magnesio intra ed
extracellulare e nel calcio intracellulare sono associate ad alterazioni elettrofisiologiche aritmogene.
Attenzione però che in cuori strutturalmente alterati una aritmie ventricolare non deve essere
imputata a cause elettrolitiche, ma in un cuore strutturalmente normale l’iperkaliemia,
l’ipomagnesemia sono cause aritmogene e di MCI. L’ipomagnesemia a associa a torsioni di punta,
l’ipokaliemia con o senza ipomagnesemia è responsabile di aritmie ventricolari in
ipertesi,scompensati, in pazienti in terapia con antiaritmici di classe I , intossicazione acuta
d’alcool, in pazienti in terapia digitalica. L’ipocalcemia allunga il QT.
AGENTI TOSSICI: è noto che alcool e MCI sono in relazione ma la natura è controversa. Non
sembrano completamente correlati alla cardiomiopatia alcolica. L’alcool è inotropo negativo
parzialmente compensato dallo stimolo catecolaminergico. Visto che l’alcool induce
rimodellamento miocardico probabilmente è la fibrosi a causare aritmie ventricolari e MCI.
Il fumo aumenta di 4 volte il rischio di MCI. . I lipidi, in particolare le VLDL , le LDL, le HDL, i
trigliceridi e le apolipoproteine B sono associate a MCI. Le statine riducono tale rischio. Gli omega3 riducono invece il rischio di MCI.
ARITMIE VENTRICOLARI E MCI IN PARTICOLARI POPOLAZIONI
ATLETI: tra gli atleti la MCI eccede la media per cui attenzione deve essere posta in questa
categoria. Queste le raccomandazioni della linea guida :
Classe I: in tutti gli atleti si deve fare l’anamnesi familiare in cerca di MCI, cardiomiopatia e
anomalie ioniche. In caso di sospetta alterazione cardiaca devono essere trattati come gli altri
individui tenendo conto però della loro attività. Se un atleta riferisce sincope deve essere
attentamente valutato, in attesa devono sospendere l’attività agonistica.
SESSO E GRAVIDANZA: le donne hanno un QT più lungo degli uomini e tale differenza aumenta
a frequenze più basse. Dopo i 50 anni il QT di uomini e donne è uguale. Nelle donne con LQTS il
periodo peggiore è il post partum dove la frequenza cardiaca rallenta. I betabloccanti possono essere
usati a scopo profilattico durante e dopo la gravidanza, creando solo una lieve riduzione di
frequenza nel feto. Durante la gravidanza il cardiopalmo è frequente, per lo più dovuto a aritmie
sopraventricolari, ma TV di nuova insorgenza sono frequenti, pure in cuori strutturalmente normali,
correlate ad alti dosaggi di catecolamine. In fase acuta la lidocaina è il farmaco di scelta, visto che
l’amiodarone crea ipotiroidismo, disturbi nella crescita del feto e parti prematuri. I betabloccanti
hanno un ruolo profilattico. Nelle donne con cardiomiopatia note la gravidanza è sempre un periodo
a rischio. MCI, edema polmonare o stroke sono presenti nel 13% dei casi. Beta bloccanti,
amiodarone ( ma attenzione agli effetti teratogeni ) sono la terapia da considerare mentre la
cardioversione elettrica si usa nella fase acuta.
PAZIENTI ANZIANI: sono quelli che maggiormente vanno incontro a MCI per cardiopatia
ischemica, ipertrofica, dilatativa. La terapia farmacologica preventiva è basata sull’amiodarone (
pesando gli effetti collaterali ) e i betabloccanti ( scarsamente usati negli anziani ) . L’associazione
potenzia la prevenzione. Anche l’ ICD deve essere impiantato con le stesse indicazioni del giovane
ma con attenzione all’aspettativa di vita che deve essere almeno di un anno.
PAZIENTI PEDIATRICI: colpisce 4 bambini ogni 100.000 contro i 100 adulti ogni 100.000. Il
70% delle MCI nei pazienti pediatrici sono di origine cardiaca . Visto i numeri scarsi non ci sono
studi randomizzati e quindi tutte le raccomandazioni sono di classe C. Vi è un sottogruppo di
bambini con un rischio di MCI maggiore degli adulti: quelli con LQTS, con anomalie cardiache
congenite, cardiomiopatie, anomalie delle arterie coronariche. La terapia è uguale agli adulti. Il
WPW nei bambini è raro. I BEV sono frequenti e sono presenti nel 15% dei neonati. Tale
percentuale cala a meno del 5% nei bambini ma risale al 10% a 10 anni e al 25 % nella
adolescenza. In tali casi occorre escludere cause organiche che hanno un significato prognostico; in
assenza di anomalie strutturali cardiache i BEV non hanno significato prognostico. Una aritmia
ventricolare sostenuta può essere presente nei neonati, di solito come ritmo idioventricolare
accelerato, in assenza di anomalie cardiache strutturali; si risolve nel 1° mese di vita. Invece una TV
persistente può essere presente in neonati con tumori cardiaci o cardiomiopatie. Si dibatte riguardo
la relazione tra SIDS ( sudden infant death sindrome ) e LQTS. Fino ad ora si è dimostrato che il
40% delle morti si è ridotta evitando la posizione prona durante il sonno, quindi con una genesi
respiratoria. Circa a un anno di vita molti bambini hanno episodi di TV sostenuta ben tollerata e con
buona prognosi. Non esiste terapia efficace. La RVOT e LVOT sono spesso diagnosticate durante
l’adolescenza e sono a prognosi benigna grazie all’ablazione previo studio elettrofisiologico mentre
la TV polimorfica catecolaminergica è a prognosi peggiore con rischio di MCI. L’ ICD nei bambini
è poco indagato, negli adolescenti si usano le indicazioni degli adulti. La terapia nelle aritmie a
rischio di vita nei bambini è la seguente:
Betabloccanti nel LQTS
Nella TV focale l’ablazione chirurgica o con catetere
Nelle cardiomiopatie terminali il trapianto cardiaco
PAZIENTI CON ICD: la presenza dell’ ICD riduce le conseguenze ma non il numero degli episodi
aritmici. Nelle tachicardie sopraventricolari ad alta frequenza posso indurre la scarica di un ICD che
interpreta prioritariamente la frequenza. Una terapia con betabloccanti può evitare l’entrata in
azione dell’ ICD. Gli ICD con due camere ( atriale e ventricolare) riescono ad analizzare e
confrontare il ciclo atriale e ventricolare riducendo le scariche errate che attualmente sono al 1015%. Può avvenire il cosiddetto “arrhythmia storm”, cioè una serie di scariche ripetitive dovute a un
circolo vizioso tra scarica e alterazione cardiaca La terapia è la stessa della TV incessante.
FARMACI CHE INDUCONO ARITMIA
Sono casi sporadici non sottoposti a studi randomizzati Farmaci ad alti dosaggi o interazioni fra
farmaci sono le cause più frequenti. Di solito un farmaco viene eliminato attraverso una via e un
secondo farmaco interagisce con tale via.
TOSSICITA’ DIGITALICA: causa una incrementata automaticità atriale, ventricolare e
giunzionale con blocchi AV. Si accompagna a iperkaliemia e alterazioni del sensorio con nausea e
disturbi visivi. Ipotiroidismo, l’ipokaliemia e l’insufficienza renale sono concause. La terapia per
casi di media gravità è la sospensione con controllo della kaliemia. Per casi più gravi gli anticorpi
antidigitale.
FARMACI CHE ALLUNGANO IL QT: nel sito www.torsades.org vi è l’elenco aggiornato di
tutti i farmaci coinvolti . Nell’ 1-10% dei pazienti che ricevono farmaci che allungano il QT si ha
un tale allungamento da causare torsione di punta, meno frequentemente con farmaci non
antiaritmici. Spesso tali farmaci mettono in evidenza una LQTS. La terapia si basa sull’attento
monitoraggio dei pazienti a rischio, mantenere una potassiemia tra 4.5 -5 mEq /L e somministrare
magnesio 1-2 g ( anche la tossicità da magnesio con ariflessia e arresto respiratorio può presentarsi
ma è rara a questi dosaggi ). Se non sufficienti il pacing può essere iniziato.
TOSSICITA’ DA BLOCCANTI IL CANALE DEL SODIO: gli antiaritmici sono i più frequenti
ma anche gli antidepressivi triciclici sono tossici con lo stesso meccanismo. La flecainide, il
propafenone e la chinidina aumentano la durata del QRS pure a dosaggi terapeutici e sembrano
incrementare la mortalità in fase post IMA. Inoltre rendono meno facilmente risolvibile una FV con
la defibrillazione e favoriscono le TV recidivanti. Inoltre possono trasformare una fa in un flutter
1:1. Possono inoltre evidenziare una sindrome di Brugada. Da qui ne segue che ne è sconsigliato
l’uso nella fase post IMA ( includendo pure gli antidepressivi triciclici ). Dal punto di vista
terapeutico studi su animali hanno dato buoni risultati con il sodio bicarbonato e con i betabloccanti.
OVERDOSE DI ANTIDEPRESSIVI TRICICLICI: si manifestano con tachicardia sinusale,
allungamento del QRS,ed ECG tipo Brugada. Ipotensione iperpiressia e coma sono pure presenti.
L’alcalosi metabolica iatrogena è la sola terapia.
PATOLOGIE NEUROLOGICHE E PSICHIATRICHE E MCI: è noto che negli epilettici e nei
schizofrenici la percentuale di MCI è aumentata. Non è noto se è legato a un incremento del QT
farmacologico, da disfunzioni autonomiche o da una incrementata incidenza di patologie
cardiovascolari.
ALTRI FARMACI CHE INDUCONO ARITMIE
5-FLUOROURACILE: causa aritmie maligne non rispondenti alle normali terapie durante
l’infusione acuta, soprattutto la prima infusione, indipendentemente dalle patologie coronariche
sottostanti. Durante a 1° infusione il paziente dovrebbe essere monitorizzato e in caso di
sintomatologia, di solito simile all’attacco anginoso, il farmaco va sospeso e non più somministrato.
La terapia può essere conservativa o convenzionale con nitrati, eparina, calcioantagonisti e
betabloccanti.