BLOCCHI TEMATICI CHIMICA-FISICA III CH
a.s. 2006/2007 prof. Alfredo Tifi
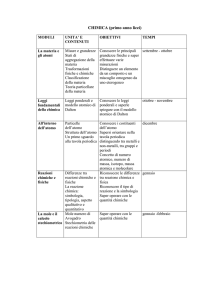
1. Composizione dei materiali
Concetti: Sostanze elementari e composte, elemento, atomo, nucleo, numero atomico, miscugli,
interazione, trasformazioni fisiche e chimiche, proprietà fisiche, chimiche, proprietà collettive,
composizione, formule molecolari, formule minime, sostanze con struttura non molecolare.
Obiettivi:
1. classificare la materia in base alla composizione, sia a livello macro, sia a livello
particellare, usando anche una terminologia in inglese.
2. riconoscere le differenze tra il considerare le sostanze (livello macro) e le loro unità
elementari (atomi, molecole ecc.) e distinguere in particolare tra elemento e sostanza
elementare;
3. saper stabilire il legame esistente tra formula molecolare, struttura e proprietà delle sostanze.
Tempi 20 settembre – 25 ottobre
2. Le Quantità in Chimica e la Stechiometria
Concetti: numero di unità elementari; grandezze e unità di misura di massa, volume, quantità di
sostanza; costante d’Avogadro; volume molare; massa molare; massa equivalente; densità;
concentrazione; molarità; coefficienti stechiometrici; reagente limitante; reazioni complete e
incomplete; resa.
Obiettivi:
4. convertire la misura della quantità di materia e della concentrazione tra le varie espressioni;
5. calcolare il volume molare delle sostanze, la massa il volume e la concentrazione delle
soluzioni, anche dopo operazioni di evaporazione, diluizione, aggiunta di soluto o
mescolamento con soluzione a diversa concentrazione;
6. determinare le quantità stechiometriche dei reagenti coinvolti nelle reazioni chimiche.
Tempi 27 ottobre 2006 - novembre
3. Atomo e Sistema Periodico “elettronico”
Concetti: composizione isotopica; comportamento ondulatorio dell’elettrone; stati quantizzati
dell’atomo;; indeterminazione; funzione d’onda stazionaria – orbitale; numeri quantici m, l, s; spin;
configurazione elettronica; carica nucleare efficace; energia di ionizzazione; spettro di
fotoionizzazione; affinità elettronica, volume atomico; cationi e anioni monatomici; ottetto;
elettroni di valenza; periodicità, famiglia chimica; blocchi s, p, d; serie di transizione.
Modelli e teorie: modello di Thomson; modello di Rutherford; modello di Bohr; dualismo ondaparticella; modello orbitalico; modello elettrostatico; aufbau (principi di esclusione e di Hund)
Obiettivi:
7. calcolare il peso atomico medio di un elemento dalla composizione isotopica;
8. indicare la sequenza storica dei più noti modelli di atomo e le principali evidenze
sperimentali a sostegno di ciascuno;
9. indicare la terna di numeri quantici, la forma e l’energia relativa a ciascun orbitale;
10. scrivere la sequenza di riempimento dei livelli elettronici all’aumentare del numero atomico
e del nuero di elettroni
11. Ricavare la struttura elettronica semplificata dell’atomo e dello strato di valenza (notazione
Lewis) dalla posizione del relativo elemento nella TPE
12. Comparare le proprietà periodiche degli atomi dei diversi elementi della TPE.
Tempi novembre-dicembre 2006, gennaio 2007
4. La Struttura Molecolare
Concetti: legame covalente; energia di legame; legame ionico; elettronegatività; polarità; nube
elettronica; simmetria/asimmetria; dipolo; coppie del guscio di valenza; espansione dell’ottetto;
carica formale; coppia elettronica solitaria (LP); coordinazione; tetraedro; coniugazione e risonanza;
orbitale molecolare; basicità; legame intermolecolare; attrazione dipolo-dipolo; dipolo istantaneo;
induzione; forze di London; legame a idrogeno.
Modelli e teorie: teoria VSEPR; teoria VB; teoria OM
Obiettivi:
13. costruire la struttura elettronica di Lewis di semplici molecole seguendo la regola
dell’ottetto;
14. valutare i contributi del bilancio energetico della formazione di un solido ionico dagli
elementi;
15. stabilire i diversi tipi di legame interatomico sulla base delle diverse proprietà atomiche;
16. riconoscere le strutture coniugate e scrivere le forme limite di risonanza;
17. stabilire la geometria delle molecole intorno ad atomi centrali in base alla teoria VSEPR;
18. stabilire connessioni tra le caratteristiche strutturali e alcune proprietà delle sostanze
(basicità, solubilità in solventi polari/apolari, stato di aggregazione);
19. individuare i diversi tipi di legame intermolecolare formati in base alla struttura molecolare.
Tempi gennaio – febbraio 2007
5. Ossidazioni e Riduzioni
Concetti: stato di ossidazione; numero di ossidazione; ossidante – riducente; ossidazione –
riduzione; semireazione; potenziale di riduzione; spontaneità della redox; reazioni di spostamento.
Obiettivi:
20. stabilire lo stato di ossidazione degli elementi nelle sostanze e riconoscere quando esso
varia;
21. scrivere semireazioni di riduzione o di ossidazione bilanciate;
22. stabilire se una reazione redox in soluzione acquosa può avvenire o meno in base ai
potenziali redox.
Tempi: febbraio-marzo 2007
6. Famiglie Chimiche; Nomenclatura e Classificazione dei Composti
Concetti: metallo; nonmetallo; metalloide; ossido; idrossido; idruro; idracido; sale binario; acido;
base; anfotero; anidride; ossoacido; ossoanione; acido di Lewis; sale ternario; reazione di sintesi;
reazione di decomposizione; reazione di spostamento; reazioni di doppio scambio, metallo di
transizione; alogeno; metallo alcalino e alcalino terroso.
Obiettivi:
23. classificare e denominare i composti inorganici e i loro nomi (anche in inglese per ossidi,
ossiacidi, idrossidi, idracidi, ossoanioni);
24. ricavare la formula dai nomi (anche dai nomi in inglese degli ossidi, ossiacidi, idrossidi,
idracidi, ossoanioni);
25. riconoscere le reazioni e le formule tipiche dell’elemento X e dei suoi composti
fondamentali in base alla famiglia di appartenenza, per il blocco s; gruppo IIIA, IVA, VA,
zolfo + VIIA, gas nobili e metalli di transizione 3d.
Tempi marzo – aprile 2006
7. Equilibri acido-base in soluzione acquosa
Concetti: ionizzazione; elettrolita debole/forte; percentuale di ionizzazione; costante di
ionizzazione; coppia acido/base di Brönsted; autoionizzazione dell’acqua; KW; protone; ione
idronio; ione idrossido; concentrazione idrogenionica; decadi della concentrazione; pH; soluzione
tampone.
Modelli e Teorie: modello acido-base di Brönsted; principio dell’equilibrio mobile.
Obiettivi:
26. determinare sperimentalmente la differenza tra elettrolita forte e debole;
27. scrivere reazioni di scambio protonico in soluzioni acquose e la relativa costante
d’equilibrio;
28. determinare il pH conoscendo la concentrazione idrogenionica, ossidrilionica e viceversa
29. prevedere il campo di acidità di soluzioni acquose di un unico elettrolita o di coppie
coniugate.
Tempi maggio 2006