Alberto Piccini matr. n°139080 – Lezione 17/02/2002 – ore 14:30-16:30
PROBLEMI DI TERMODINAMICA
RIGUARDO: VAPORE DI ACQUA SATURO E MISCELE DI ARIA E VAPORE
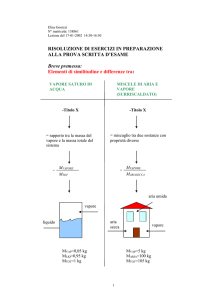
VAPORE DI ACQUA SATURO (sostanza pura)
TITOLO X
Rapporto fra:
massa vapore e massa totale.
Titolox
M vapore
M totale
ESEMPIO:
vapore
liquido
DATI: Vapore 0,05 Kg vapore
Liquido 0,95 Kg liquido
MassaTotale 1Kg
TITOLOX
1
0,05
0,05
1
Lezione 17/02/2002 – ore 14:30-16:30
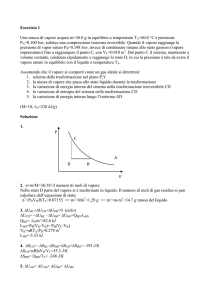
MISCELE DI ARIA E VAPORE (surriscaldato)
TITOLO X
Rapporto fra:
massa vapore e massa aria secca.
Titolox
M vapore
M ariasec ca
ESEMPIO:
Ambiente con
aria umida
Aria secca
e
Vapore
DATI: Ariasec ca 100 Kg aria
Vapore 5Kg vapore
TITOLOX
kg vapore
5
0,05
100
kg aria
2
Lezione 17/02/2002 – ore 14:30-16:30
Nota. Nello svolgimento delle due diverse tipologie d’esercizi oltre a dover applicare una differente
formula per ottenere la risultante del TITOLO X, un’attenzione particolare deve essere portata
sull’unità di misura che specifica la stessa.
La risoluzione del TITOLO X nei problemi con vapore di acqua saturo non necessita d’unità di
misura perché i chilogrammi della risultante sono sempre chilogrammi d’acqua; questo diviene,
invece, necessario nella risoluzione dell’altra tipologia in cui i chilogrammi si specificano in:
chilogrammi-vapore e chilogrammi-aria. Questa sostanziale differenza, ai fini di una esatta riuscita
dell’esercizio, è messa in evidenza negli esempi sopra descritti.
Risoluzione esercizi del 1° appello in data 1/02/2001
Esercizio n°1 – Termodinamica (tolleranza +/- 5%)
Testo. Aria secca è contenuta entro uno stantuffo (quindi non c’è vapore), su cui grava
la pressione atmosferica ed un peso avente massa M pari a 100+AB kg che mantiene costante la
pressione al suo interno. L’area dello stantuffo A è pari a 100+CD cm 2 .
La temperatura iniziale T 1 del fluido entro lo stantuffo è pari a 20+EF °C. L’altezza iniziale dello
stantuffo, z 1 , è pari a 100mm. Al fluido viene comunicata dall’esterno una quantità di calore Q pari
ad 1 kcal. Il fluido si espande, sollevando il peso.
Trovare:
1. Temperatura finale T2 .
2. Altezza finale dello stantuffo z 2 in mm.
Risoluzione dell’esercizio sostituendo alle lettere ABCDEF, presenti nei dati del problema, il
numero di matricola 123456.
Pressione
atmosferica
Dati: Massa = 100 + AB Kg 112Kg
Area stantuffo = 100 + CD cm 2 134cm 2
z2
Temperatura = T1 = 20 + EF °C = 76°C
z1
Z 1 = 100 mm
Aria
secca
Calore = Q = 1 Kcal (pari a 4187J)
0
3
Lezione 17/02/2002 – ore 14:30-16:30
Svolgimento.
L’intero sistema si trova in una condizione di pressione costante che andiamo a rappresentare in un
sistema cartesiano, individuando la porzione di lavoro da calcolare ovvero la variazione di calore.
P
P=cost
L
2
1
V
Dopo aver portato tutti i dati alle corrispondenti unità di misura riconosciute dal S.I., possiamo
svolgere le operazioni di calcolo iniziando nel trovare la pressione totale; data dalla seguente
espressione:
M g
112 kg 9,81m / s 2
Ptot Pa
101 .325 Pa
183.319 Pa
A
134 10 4 m 2
dove p A indica la pressione atmosferica, che ha valore numerico costante, e g l’accelerazione di
gravità, anch’essa con valore numerico costante.
1° Quesito.
Dall’equazione sui gas perfetti (1) abbiamo la possibilità di ricavarci facilmente la massa dell’aria
dato che gli altri elementi della formula sono noti e il volume risolvibile facendo un breve passaggio
intermedio che consiste nel calcolarsi il volume V1 come prodotto tra la base dello stantuffo e la sua
altezza z1 (2).
(1) p1V1 M A R T1
(2) V1 A z1 0,0134m 2 0,1m 0,00134m 3
Dalla (1) segue:
4
Lezione 17/02/2002 – ore 14:30-16:30
MA
p1 V
R T1
183319 Pa 0,00134m 3
0,002455kg
287 76 273
L’unità di misura di partenza della temperatura T1 iniziale in gradi centigradi è stata trasformata in
gradi Kelvin.
Infine per calcolare la temperatura finale del sistema, basta applicare l’equazione che determina la
quantità di calore Q (3).
(3) H 2 H 1 Q Vdp
L’integrale in questione indica la variazione di pressione, che in questo caso è costante, quindi può
essere trascurato.
(3a) M A C p T2 T1 Q
dove C p è il calore specifico dell’aria a pressione costante (pari a 1000).
Dalla (3) ricaviamo la temperatura finale; quindi segue che:
T2 T1
Q
4187 J
76C
1626,37C
M A Cp
0,00245 Kg 1000
1626,37 C è la temperatura finale T2 . Abbiamo così risposto al primo quesito del problema.
2° Quesito
In risposta al secondo quesito si deve nuovamente considerare l’equazione (1) dei gas perfetti
utilizzando in questo caso la temperatura finale T2 e tenendo presente che la pressione rimane
costante, possiamo calcolare il volume V 2 con altezza z 2 ; quindi:
(4) p 2 V2 M A R T2
Dalla (4) ricaviamo V 2
V2
M A R T2 0,002455kg 287 273 1626,37C
0,0073002m 3
p
183319 Pa
5
Lezione 17/02/2002 – ore 14:30-16:30
Giunti a questo punto il problema entra nella fase conclusiva che si sintetizza nel calcolo della
risultante del rapporto fra il volume V 2 e l’area dello stantuffo. Questa risultante non è altro che la
nostra z 2 , l’altezza finale dello stantuffo, che risponde al secondo quesito del problema.
z2
V2 0,0073002m3
0,544m 544mm
A
0,0314m2
Nota. Le richiesta del problema sarebbero qui esaurita, ma essendo l’esercizio di semplice
esecuzione e volendo fornire allo studente una più reale simulazione del compito d’esame, che da
quest’anno consta di soli due problemi di difficoltà maggiore rispetto agli anni passati, verranno
aggiunti due nuovi quesiti.
Trovare:
3. Il lavoro netto per sollevando il grave.
4. La variazione di entropia.
3° Quesito
Calcoliamo il lavoro netto utilizzando l’espressione (5) della variazione dell’energia.
(5) L M g z
Sostituendo i valori numerici della massa iniziale, dell’accelerazione gravitazionale e della
variazione di altezza dello stantuffo nella formula (5) il lavoro risulta essere:
L 112 9,81 0,444 488J
Per una maggiore conferma del risultato del lavoro netto applichiamo la seguente formula:
L V2 V1 ptotale p Atmosferica 0,0073002m 3 0,00134m 3 183319Pa 101325Pa 488J
4° Quesito
La variazione di entropia è data calcolando l’integrale dell’infinitesima parte della quantità di
calore.
Definiamo con l’espressione (6) la porzione infinitesima della quantità di calore come il rapporto tra
la massa iniziale, il calore specifico dell’aria e la temperatura.
(6) dQ M C p dT
6
Lezione 17/02/2002 – ore 14:30-16:30
Andiamo quindi a svolgere i calcoli per trovare la variazione d’entropia, rispondendo all’ultima
richiesta del problema.
2
2
2
T
dQ
dQ
dQ
S S 2 S1
M Cp
M Cp
M C p log 2
T
T
T
T1
1
1
1
0,002455kg 1000 log
273 1626,37C
J
4,159
273 76C
K
Esercizio n°2 – Termodinamica (tolleranza +/- 5%)
Testo. Risolvere nuovamente l’esercizio n. 1, ma sostituendo vapore di acqua saturo all’aria
secca. In questo caso non è assegnata la temperatura iniziale T1, ma è invece assegnato il titolo x1,
che vale 0,1+F/74.
Trovare:
1. Titolo X 2 finale.
2. Altezza finale dello stantuffo z 2 .
Risoluzione dell’esercizio sostituendo alle lettere ABCDEF, presenti nei dati del problema, il
numero di matricola 123456.
Pressione
atmosferica
Dati: Massa = 100 + AB Kg 112Kg
Area stantuffo = 100 + CD cm 2 134cm 2
z2
Titolo X1 = 0,1 +
z1
Acqua
F
6
0,1
0,25
40
40
Z 1 = 100 mm
0
Calore = Q = 1 Kcal (pari a 4187J)
7
Lezione 17/02/2002 – ore 14:30-16:30
Svolgimento.
Le trasformazioni che si attuano nel sistema avvengono a pressione costante, di conseguenza la
temperatura è bloccata ad un valore anch’esso costante poiché ci troviamo a svolgere un problema
con vapori saturi.
Mostriamo a seguito l’andamento dell’isoterma nel grafico sotto riportato.
P
P =cost =1,8Bar
T = cost
1
2
T
1° Quesito
p 183319Pa TSAT 117C
Con l’espressione (7) calcoliamo la variazione d’entalpia in funzione del vapore saturo.
(7) H 2 H1 Q 4187J
A seguito dell’espressione (8) ricaviamo l’entalpia specifica.
(8) h x hL x 2 hd
dove h L è l’entalpia del liquido e h d è il calore latente di vaporizzazione che possiede un valore
numerico costante, pari a 2211 KJ/Kg.
La variazione di entalpia, sviluppando la (7), risulta essere:
(9) M acqua hL2 x2 hd hL1 x1 hd 4187 J
8
Lezione 17/02/2002 – ore 14:30-16:30
semplificando l’entropia del liquido h
L
e raccogliendo il calore latente di vaporizzazione h d :
M acqua hd x 2 x1 4187 J
Ricordando che il volume dello stantuffo V1 è pari a 0,00134 m 3 e che il volume specifico v è dato
dall’equazione (10), segue che:
m3
(10) v v1 x1vd 0,001058 0,25 0,7093 0,1739
kg
Ricaviamo quindi l’ultimo elemento, la massa dell’acqua, che sostituito, insieme agli altri, nella
(10) ci permetterà di ricavare il Titolo X2.
M acqua
V1
0,00134m3
0,00712kg
v 0,17839 m3
kg
Svolgendo i calcoli rispondiamo al primo quesito ricavando dalla (10) il Titolo X2:
x 2 x1
Q
M acqua R
0,25
4187 J
0,502
0,007512 2211000
2° Quesito
Per ricavare l’altezza finale z2 che è la risolvente del rapporto tra V2 e l’aria del stantuffo, bisogna
prima calcolare il volume specifico v2 .
Utilizzando la (10) e cambiando gli elementi dell’equazione in funzione del volume specifico v2 :
m3
v2 v1 x2vd 0,001058 0,502 0,7093 0,3571
kg
A questo punto possiamo ricavare anche V2 come il prodotto tra la massa dell’acqua e il volume
specifico.
V2 M acqua v2 0,007512 0,3571 0,002683m3
9
Lezione 17/02/2002 – ore 14:30-16:30
L’altezza finale dello stantuffo è quindi:
z2
V 2 0,002683
0,200 m
A
0.0134
Nota. Le richiesta del problema sarebbero qui esaurita, ma essendo l’esercizio di semplice
esecuzione e volendo fornire allo studente una più reale simulazione del compito d’esame, che da
quest’anno consta di soli due problemi di difficoltà maggiore rispetto agli anni passati, verranno
aggiunti due nuovi quesiti.
Trovare:
3. Il lavoro netto per sollevare il peso.
4. La variazione d’entropia.
3° Quesito
Utilizziamo l’equazione (5).
L M g z
Segue che il lavoro per sollevare il peso dello stantuffo risulta essere:
L 112 kg 9,81
m
0,100 m 109,87 J
s2
4° Quesito
Riprendiamo le espressioni (8) e (9) e sostituendo i valori dell’entalpia con quelli dell’entropia.
(8a) S Sl xSd
dove S è l’entropia specifica, Sl è l’entropia del liquido e S d è l’entropia differenziale.
Calcoliamo quindi l’entropia differenziale:
Sd
2211000
J
5669
117 273
kg K
Dalla (9) segue:
(9a) S M acqua S d x 2 x1
10
Lezione 17/02/2002 – ore 14:30-16:30
Sviluppando i calcoli dalla (9a) ricaviamo il valore della variazione d’entropia.
S 0,007512 kg 5669
J
0,502 0,25 1073 J / K
kg K
Risoluzione esercizio dell’appello in data 28/02/2001
Esercizio n°1 – Termodinamica (tolleranza +/- 15%)
Testo. Entro un ambiente di volume V pari a 100+CD m3 si trova aria umida con temperatura T1
pari a 20+E C ed umidità relativa 1 pari a 30+F%. Nell’ambiente viene introdotta una massa di
acqua M 2 , alla temperatura T1 , cosicché l’umidità cresce ad un valore 2 pari a 60+F%.
Ovviamente la temperatura cala, mancando qualsiasi apporto di calore esterno. Determinare:
Trovare:
1. Massa di aria contenuta nell’ambiente;
2. Massa di acqua M2 .
Risoluzione dell’esercizio sostituendo alle lettere ABCDEF, presenti nei dati del problema, il
numero di matricola 123456.
Aria
secca
Dati: V = 100 + CD = 134 m3
Vapore
T1 = 20 + E °C = 25°C
Q2 = 60 + F = 66% = 0,66
Q1 = 30 + F = 36% = 0,36
Acqua
Svolgimento.
Nel recipiente viene introdotta una miscela di aria e vapore, quindi la massa totale sarà data dalla
loro somma. Bisogna però tener presente che la massa del vapore aumenta introducendo acqua;
infatti della (11) ricaviamo la massa del vapore M v 2 che si ricava aggiungendo l’acqua alla massa
del vapore M v1 .
11
Lezione 17/02/2002 – ore 14:30-16:30
(11) M v2 M v1 M acqua
Mostriamo un grafico che spiega la situazione.
x
0,66
0,36
2
1
22°C
25°C
T
1° Quesito.
La massa dell’aria che si trova nel contenitore si calcola utilizzando l’equazione (12) dei gas perfetti
nello loro stato fisico finale:
(12) PA V M A RA T1
Dalla legge di Dalton , che afferma che la somma delle pressioni parziali è uguale alla pressione
totale, segue che la pressione dell’aria p A è uguale alla differenza tra la pressione totale p TOT e la
pressione parziale del vapore pV1 ; espresse nella (13).
(13) p A p TOT pV1
12
Lezione 17/02/2002 – ore 14:30-16:30
Per calcolare la pressione dell’aria da sostituire nella (12) dobbiamo ricavarci la pressione del
vapore che è data dallo sviluppo dall’espressione del grado idrometrico Q1 , che è il rapporto tra la
pressione del vapore e la pressione di saturazione (= 0,031709 Bar).
Q1
pV
pSAT
pV1 Q1 pSAT1
pV1 0,36 0,031709 0,01141Bar
Dalla (13) ricaviamo la pressione dell’aria:
p A 101325 1141 100184Pa
Sostituendo i valori numerici dei vari elementi dell’equazione (12) e sviluppando i calcoli in
funzione della massa d’aria troviamo che:
MA
pA V
100184 134
157Kg Aria
RA T1 287 (273 25)
La massa dell’aria è pari 157 Kg Aria .
2° Quesito.
Il sistema si sviluppa in una condizione di pressione ed energia costante. Per ricavare la massa
dell’acqua prendiamo in considerazione una temperatura finale T2 ipotetica pari a 22°C.
A questo punto utilizziamo l’equazione (3) della variazione di calore.
2
H 2 H 1 Q vd p
1
Il calore e la variazione di pressione si possono elidere dato che sia l’energia che la pressione hanno
valori costanti.
Dall’ eguagliando dei due membri possiamo ricavare la massa dell’acqua.
H2 M A J 2
M acqua
e
H 1 M A J 1 M acqua hL
M A J 2 J1
hL
Dove J 1 è l’entalpia iniziale e J 2 è l’entropia finale mentre h L è l’entalpia del liquido.
L’entalpia specifica dell’aria umida J è data dalla formula (14):
13
Lezione 17/02/2002 – ore 14:30-16:30
(14) J t x2500 1,9 t
Calcoliamo ora il Titolo X1 :
Q1 pSAT1
x1 0,622
pTOT Q1 pSAT1
0,622
0,36 0,031709
0,007
1,013 0,36 0,031709
Dalla equazione (14) possiamo quindi ricavare l’entropia iniziale.
J 1 25 0,0072500 1,9 25 43,05
kJ
kg
Calcoliamo ore il Titolo X 2 :
x2 0,622
0,66 0,02642
0,010829
1,013 0,66 0,02642
L’entalpia del liquido hL è l’ultimo elemento che ancora non si è ancora calcolato per risolvere il
problema. Esso è dato dalla seguente formula:
hL CL t1 4,187 25 104,675
kJ
kg
Dove C L è il calore specifico dell’acqua.
Con la formula che segue andremo a calcolare il valore della massa dell’acqua, tenendo però
presente che il risultato che ne conseguirà non sarà corretto dato che abbiamo conferito un valore
ipotetico alla temperatura finale, pari a 22°C.
M acqua M A x2 x1 0,597 Kg
Per ricavare l’esatto valore della massa dell’acqua dobbiamo ricavare l’esatta temperatura finale.
La temperatura finale la calcoliamo dalla formula dell’entropia specifica. Prima però troviamo J 2 .
J 2 J1
M acqua
MA
hL 43,05
0,597
KJ
104,675 43,448
157
Kg
14
Lezione 17/02/2002 – ore 14:30-16:30
J 2 t 2 x 2 2500 1,9 t 2
Sviluppando quindi l’equazione dell’entropia specifica in funzione della temperatura finale segue
che:
t 2 1 x2 1,9 J 2 x2 2500
J 2 x2 2500
15,9C
1 1,9 x2
Ora, per ricavare l’esatta massa dell’acqua si dovrà passare attraverso più passaggi di
approssimazione, che portino a ricavarne un valore intermedio soddisfacente, tela da non permette
che il sistema oscilli.
DOPO VARI TENTATIVI (circa 14), la temperatura finale risulta essere 19,55°C; di
conseguenza la massa dell’acqua è 0,356 Kg.
15