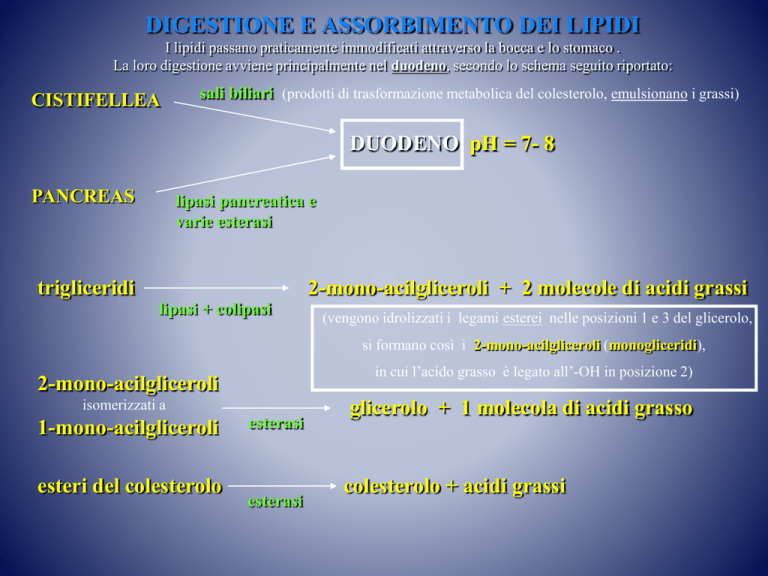
DIGESTIONE E ASSORBIMENTO DEI LIPIDI
I lipidi passano praticamente immodificati attraverso la bocca e lo stomaco .
La loro digestione avviene principalmente nel duodeno, secondo lo schema seguito riportato:
CISTIFELLEA
sali biliari (prodotti di trasformazione metabolica del colesterolo, emulsionano i grassi)
DUODENO pH = 7- 8
PANCREAS
lipasi pancreatica e
varie esterasi
trigliceridi
2-mono-acilgliceroli + 2 molecole di acidi grassi
lipasi + colipasi
(vengono idrolizzati i legami esterei nelle posizioni 1 e 3 del glicerolo,
si formano così i 2-mono-acilgliceroli (monogliceridi),
in cui l’acido grasso è legato all’-OH in posizione 2)
2-mono-acilgliceroli
isomerizzati a
1-mono-acilgliceroli
esteri del colesterolo
esterasi
esterasi
glicerolo + 1 molecola di acidi grasso
colesterolo + acidi grassi
Con la dieta introduciamo lipidi sottoforma di: trigliceridi (98%), colesterolo, fosfolipidi e vitamine
liposolubili (2%).
La digestione dei lipidi è profondamente condizionata dalla loro insolubilità in acqua, che rappresenta
l’elemento fondamentale all’interno del tubo digerente. Così, quando si trovano nell’ambiente
acquoso della saliva e delle secrezioni gastriche, intestinali, pancreatiche e biliari, i grassi si
aggregano tra loro, separandosi dal mezzo acquoso e formando delle goccioline lipidiche. Tale
caratteristica complica enormemente i processi digestivi, poiché le lipasi, essendo idrosolubili,
riescono ad aggredire solamente i lipidi di superficie, senza riuscire a penetrare all’interno della
goccia. La loro efficacia è quindi modesta.
CH2-OCOR
Trigliceride CH-OCOR
CH2-OCOR
.
I lipidi passano così praticamente immodificati
attraverso la bocca e lo stomaco.
Nello stomaco la lipasi gastrica attacca i trigliceridi, staccando uno dei tre acidi grassi, con
conseguente formazione di acidi grassi liberi e di-gliceridi (diacil-gliceroli). L'efficacia
digestiva di questo enzima è fortemente ridotta dalla natura idrofobica dei lipidi e dalla forte
acidità gastrica. Nelle 2-4 ore in cui il cibo rimane nello stomaco questo enzima, insieme
alle lipasi salivari, digerisce solo il 10-30% dei lipidi alimentari.
Secretina
HCO3-
La vera digestione
inizia nel duodeno
L’acidità dello stomaco induce la liberazione dell’ormone secretina che stimola a sua volta
il pancreas a rilasciare bicarbonato (HCO3-) nel tenue. Il bicarbonato ha lo scopo di
neutralizzare l’acidità dovuta all’acido cloridrico e il pH viene così portato a valori = 7-8.
Nel duodeno viene riversato la lipasi pancreatica.
Rispetto alle lipasi salivare e gastrica, la sua azione digestiva è facilitata dai sali biliari
presenti nella bile e dalla leggera basicità (pH = 7-8) che caratterizza il lume intestinale. I
sali biliari, contenuti nella bile proveniente dalla cistifellea, attraverso il dotto coledoco,
hanno la funzione di emulsionare in micelle sempre più piccole i lipidi della dieta.
Dal dotto pancreatico viene emessa la prolipasi, attivata a lipasi per proteolisi limitata
specifica, che, con l’aiuto della proteina colipasi, idrolizza i legami esterei tra il glicerolo e
2 acidi grassi nelle posizioni 1 e 3 del glicerolo, dando origine a 2-monogliceridi (2mono-acilgliceroli) e ai sali sodici di 2 acidi grassi (saponi).
L’intero processo che coinvolge i sali biliari prende il nome di emulsione ed è irreversibile. Grazie a
questa riduzione delle gocce lipidiche, la superficie di contatto delle lipasi aumenta notevolmente e
insieme a essa anche l'efficacia digestiva di questi enzimi. L'adesione delle lipasi alle goccioline di
grasso è ostacolata dallo strato di sali biliari che circonda la goccia lipidica. Per questo motivo è
richiesta la presenza di un'ulteriore enzima pancreatico, chiamato colipasi, che aumenta l'adesione
della lipasi alle goccioline lipidiche. Come detto, a differenza della lipasi gastrica, quella pancreatica
stacca dal trigliceride non 1, ma 2 acidi grassi, con formazione di monogliceridi e 2 acidi grassi liberi.
I prodotti finali della digestione lipidica sono quindi gli acidi grassi liberi e i mono-gliceridi (momoacilgliceroli), i quali vengono veicolati fino agli enterociti deputati al loro assorbimento [se la bile non
venisse riversata nell'intestino buona parte dei grassi assunti con gli alimenti passerebbero nelle feci in forma non
digerita (steatorrea), vedi diapositiva successiva].
Il colesterolo libero e le vitamine liposolubili vengono assorbiti come tali, senza subire particolari
processi digestivi. Il colesterolo esterificato viene idrolizzato a colesterolo libero + acido grasso
dall'esterasi.
Il processo di idrolisi dei trigliceridi viene chiamata lipolisi.
I 2-monogliceridi o 2-mono-acil-gliceroli possono essere assorbiti direttamente o
subire l’azione di una isomerasi, che sposta l’acido grasso dalla posizione 2 alla
posizione 1 del glicerolo formando così 1-monogliceridi o 1-mono-acil-gliceroli.
In seguito alla ulteriore azione della lipasi si libera l’ultimo acido grasso e il
glicerolo.
L’assorbimento degli acidi grassi avviene nel digiuno (tratto dell’intestino tenue)
per semplice diffusione.
All’interno delle cellule della mucosa intestinale gli acidi grassi vengono
risintetizzati in trigliceridi, con consumo di energia, e inglobati in strutture
lipoproteiche chiamate chilomicroni.
I chilomicroni sono lipoproteine a densità molto bassa
Sono aggregati molecolari costituiti da:
trigliceridi, fosfolipidi, colesterolo e proteine.
Queste lipoproteine sono il mezzo di trasporto usato dai trigliceridi alimentari per muoversi
in un mezzo acquoso come la linfa e il sangue. I trigliceridi, a differenza di ciò che succede
ai carboidrati e agli aminoacidi, non passano nei vasi sanguigni, ma vengono assorbiti dai
vasi linfatici. La linfa assume un aspetto lattiginoso e viene chiamata chilo.
Il chilo viene riversato nella vena succlavia avviando i chilomicroni verso il fegato, che è il
centro di raccolta e smistamento di qualsiasi molecola abbia un interesse metabolico.
I sali biliari utilizzati per emulsionare i trigliceridi vengono riassorbiti nell’intestino e
riportati al fegato che, rinviandoli successivamente alla cistifellea, li rimetterà in circolo.
I chilomicroni vengono attaccati da un enzima, lipoproteina lipasi, liberato da cuore,
polmone, muscolo e tessuto adiposo. Dalla lipolisi si liberano acidi grassi non esterificati,
Not Esterified Fatty Acids (NEFA), trasportati nel sangue complessati con la proteina
albumina.
Schema della digestione e dell’assorbimento dei trigliceridi
Le lipoproteine
Le lipoproteine sono aggregati macromolecolari derivanti dalla combinazione di
una proteina con colesterolo, esteri del colesterolo, fosfolipidi e trigliceridi.
I lipidi possono essere trasportati nel torrente ematico
soltanto se legati a specifiche lipoproteine.
Struttura di una lipoproteina
Le lipoproteine plasmatiche sono aggregati molecolari
composti da specifiche proteine, apo-proteine, e vari tipi
di lipidi (colesterolo, colesterolo esterificato, fosfolipidi
e trigliceridi) presenti in percentuali variabili.
Come già detto, la funzione delle lipoproteine è quella di
trasportare nell’ambiente acquoso plasmatico i lipidi
idrofobici.
Nella struttura, le molecole idrofile quali proteine,
fosfolipidi e colesterolo presenti sulla loro superficie
rendono queste particelle compatibili con l’ambiente
acquoso. Nel loro interno sono presenti molecole
idrofobiche (trigliceridi, colesterolo esterificato) che
devono essere trasportate.
Nello stato post-assorbitivo il plasma umano contiene circa 500 mg di lipidi totali/100 ml, di cui circa 120 mg di
trigliceridi, 220 mg di colesterolo (2/3 esterificato e 1/3 libero), 160 mg di fosfolipidi. I NEFA (Not Esterified Fatty
Acids) la cui concentrazione normale è di circa 8-30 mg/100ml, sono trasportati dall’albumina sierica, proteina che
costituisce circa la metà delle proteine del siero e lega con interazioni deboli gli acidi grassi non esterificati, liberi nella
proporzione di 1 monomero di albumina/10 molecole di acidi grassi.
Principali caratteristiche delle lipoproteine plasmatiche
Lipoproteine
Chilomicroni
VLDL
LDL
1.019-1.063
HDL
Densità (g/ml)
0.93
0.95-1.006
1.063-1.210
Diametro Å*
800-5000
300-800
216
Composizione:
proteine %
lipidi %
<2
98
8
92
22
78
50
50
Lipide maggiore
Trigliceridi
Trigliceridi
Colesterolo
Colesterolo
Funzione principale
Trasporto TG
esogeni
(assunti con gli
alimenti)
Trasporto TG
endogeni
(sintetizzati
dall'organismo)
Origine
Intestino
Fegato
74-100
Trasporto
Trasporto
colesterolo ai
colesterolo dai
tessuti periferici tessuti periferici al
fegato
Metabolismo delle
VLDL
Intestino
Fegato
(*) L'angstrom (Å) è un'unità di lunghezza equivalente a 10−10 metri, 0.1 nanometri.
Le classi principali di lipoproteine plasmatiche sono:
a) chilomicroni, sintetizzati nelle cellule epiteliali dell’intestino tenue, sono le lipoproteine
di maggiori dimensioni e densità minima, a causa del contenuto molto elevato di
trigliceridi. Trasportano i lipidi di origine alimentare, compreso le vitamine liposolubili, ai
tessuti e organi periferici, al tessuto adiposo, al cuore, al muscolo scheletrico, dove per
azione di lipoproteina lipasi specifiche rilasciano il contenuto di acidi grassi, degradabili
per produrre energia oppure per essere conservati;
b) Very Low Density Lipoproteins (VLDL), lipoproteine a densità molto bassa, sono
sintetizzate nel fegato e trasportano trigliceridi al tessuto adiposo (conservazione) e al cuore
(b-ossidazione degli acidi grassi per produzione energetica);
c) Low Density Lipoproteins (LDL), lipoproteine a bassa densità, sono particelle residue
delle VLDL, dopo la sottrazione dei trigliceridi da parte dei tessuti, in cui percentualmente
rimane un elevato contenuto di colesterolo libero ed esterificato. Vengono comunemente
indicate come LDL-colesterolo. L’aterosclerosi, patologia correlata ad alti livelli di
colesterolo nel sangue, particolarmente legato alle LDL (colesterolo “cattivo”), è
caratterizzata dall’accumulo di placche ateromatose che possono ostruire i vasi sanguigni. I
danni al cuore dovuti alla occlusione delle arterie coronarie sono una delle principali cause
di morte nei paesi industrializzati;
d) High Density Lipoproteins (HDL), lipoproteine ad alta densità per l’alto
contenuto percentuale di proteine e basso di lipidi. Sono sintetizzate nel fegato e
nell’intestino tenue, contengono quantità limitate esclusivamente di colesterolo
libero. Il ruolo delle HDL è di riportare al fegato il colesterolo che viene in parte
convertito in sali biliari. HDL-colesterolo è considerato il colesterolo “buono”.
e) Intermediate Density lipoproteins (IDL), esiste un quinto tipo di lipoproteine
plasmatiche, che tuttavia non raggiunge concentrazioni significative a causa del suo
rapido ricambio. Si tratta delle IDL, a densità intermedia, prodotte per effetto della
degradazione dei chilomicroni e delle VLDL (contengono trigliceridi e colesterolo
in parti quasi uguali).
Fra i lipidi trasportati dalle lipoproteine solamente i trigliceridi forniscono energia
in seguito alla loro demolizione: infatti, il colesterolo ricopre molti ruoli importanti
nelle cellule, ma non viene demolito per la produzione di energia e i fosfolipidi
hanno un ruolo strutturale (membrane).
Formazione dei chilomicroni
intestino tenue
Produzione di VLDL, LDL e HDL
chilomicroni
VLDL
LDL
HDL
Esiste un quinto tipo di lipoproteine plasmatiche, che tuttavia non
raggiunge concentrazioni significative a causa del suo rapido ricambio. Si
tratta delle IDL, a densità intermedia, prodotte per effetto della
degradazione dei chilomicroni e delle VLDL (contengono trigliceridi e
colesterolo in parti quasi uguali).
Struttura di una VLDL
Le lipoproteine plasmatiche: composizione %
Proteine %
Trigliceridi %
Fosfolipidi %
Colesterolo %
Chilomicroni
1.6
96
0.8
1.6
VLDL
10
60
16
14
LDL
25
10
20
45
HDL
50
3
30
17
Catabolismo dei trigliceridi
trigliceridi
lipasi
acidi grassi
sottoposta a regolazione
ormonale
glicerolo
b-ossidazione
gluconeogenesi/glicolisi
acetil-CoA
Le fonti principali di acidi grassi per la b-ossidazione sono la dieta e le riserve (essenzialmente
trigliceridi negli adipociti).
Gli acidi grassi della dieta vengono trasportati sotto forma di trigliceridi dalle lipoproteine attraverso il
circolo dall'intestino agli organi, dove i trigliceridi vengono idrolizzati da specifiche lipoprotein-lipasi.
I trigliceridi degli adipociti vengono idrolizzati dalla lipasi ormono-sensibile e gli acidi grassi
trasportati agli organi legati all'albumina.
Catabolismo dei trigliceridi
- ossidazione del glicerolo:
come abbiamo detto i trigliceridi sono costituiti dall'unione del glicerolo con tre
acidi grassi. Il glicerolo (alcol trivalente a 3C) viene rimosso e utilizzato nella
gluconeogenesi, il processo che (come vedremo) porta alla sintesi di glucosio a
partire da composti non glucidici (lattato, piruvato, alcuni aminoacidi e, appunto,
glicerolo).
Il glicerolo non può essere accumulato e nel citosol il glicerolo viene trasformato
in
glicerolo-3-fosfato
a
spesa
di
una
molecola
di
ATP
(fosforilazione/esterificazione dell’ossidrile alcolico -OH in posizione C3). Il
glicerolo-3-fosfato viene ossidato a diidrossiacetonfosfato a sua isomerizzato a
gliceraldeide-3-fosfato, metabolita della glicolisi.
Conversione
glicerolo
gliceraldeide-3-fosfato
- Attivazione degli acidi grassi con formazione di acil-CoA
La β-ossidazione inizia nel citoplasma con l'attivazione dell'acido grasso (R-COOH)
mediante un legame tioestere con il Coenzima A (CoA-SH) (la reazione R-COOH + HS-R
= R-CO-S-R + H2O è già stata da noi considerata quando abbiamo studiato la reazione dei
tioalcoli R-SH con gli acidi carbossilici R-COOH), formando l'acil-CoA e consumando
ATP.
legame tioestere
Esempio di acil-CoA: CH3(CH2)n- CO-S- CoA
acido grasso + ATP + HS-CoA = acil-CoA + PPi (pirofosfato) + AMP
La reazione è catalizzata dall’enzima acil-CoA sintetasi.
Formula generale dell’acil-CoA: R-CO-S-CoA
L’attivazione di un acido grasso a 10C con formazione di acil-CoA
CH3
CH3
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CoA-SH
CH2
CH2
carbonio b
CH2
ATP
CH2
CH2
CH2
carbonio a CH2
CH2
COOH
acido grasso
CO-CoA
acil-CoA
Schema dell’attivazione degli acidi grassi con formazione di acil-CoA
acil-CoA
acil-CoA
- Trasporto degli acidi grassi nel mitocondrio
Sebbene alcune piccole molecole di acil-CoA siano in grado di attraversare spontaneamente
la membrana interna dei mitocondri, la maggior parte degli acil-CoA prodotti non è in grado
di attraversare tale membrana.
In questi casi il gruppo acile (R-CO-) viene trasferito alla carnitina grazie all'intervento
catalitico dell’enzima carnitina aciltransferasi I, situata sulla membrana esterna del
mitocondrio. Esso è particolarmente attivo durante il digiuno quando i livelli plasmatici di
glucagone e di acidi grassi sono elevati. Il legame acile + carnitina prende il nome di acilcarnitina.
L'acil-carnitina entra nel mitocondrio e dona il gruppo acile (R-CO-) ad una molecola di
CoA interna, per intervento dell'enzima carnitina aciltransferasi II. Si viene così
nuovamente a formare una molecola di acil-CoA la quale entrerà nel processo chiamato βossidazione.
carnitina
La traslocazione dell’acilcarnitina
Rappresentazione dell’attivazione e del trasporto degli acidi grassi nei mitocondri
acil-CoA
La β-ossidazione (prima fase della respirazione cellulare)
La β-ossidazione consiste nel separare dall'acido grasso due atomi di carbonio alla volta
sotto forma di acetil-CoA (CH3CO-CoA) ossidando sempre il terzo carbonio (C-3 o
carbonio β) a partire dalla estremità carbossilica -CH2-CH2-COOH (carbonio β). Per questo
motivo l'intero processo prende il nome di β-ossidazione.
β
-CH2-CH2-CO-CoA
acil-CoA
CH3CO-CoA
acetil-CoA
La β-ossidazione è un processo ciclico che ha luogo nella matrice mitocondriale ed è
strettamente collegato al ciclo di Krebs (per l'ulteriore ossidazione dell'acetil-CoA) e alla
catena respiratoria (per la riossidazione dei coenzimi NADH e FADH2 prodotti nel ciclo di
Krebs e nella β-ossidazione).
Per il distacco di ogni acetile le reazioni della b-ossidazione sono 4:
La prima reazione della β-ossidazione è la deidrogenazione dell'acido grasso ad opera di un
enzima chiamato acil-CoA deidrogenasi. Questo enzima è un enzima FAD dipendente e
permette la formazione di un doppio legame tra il Ca e il Cb: i 2 atomi di idrogeno persi
grazie alla deidrogenasi si legano al FAD che diventa FADH2.
La seconda reazione consiste nell'addizionare una molecola di acqua al doppio legame
(idratazione).
La terza reazione è un'altra deidrogenazione (che trasforma il gruppo ossidrilico C-OH sul
Cb in gruppo carbonilico –C=O). L'accettore di idrogeno questa volta è il NAD che si riduce
a NADH + H+.
La quarta reazione comporta la scissione (del chetoacido da parte di una tiolasi) con
formazione di un acetil-CoA e un acil-CoA con catena più corta (2C in meno).
Ciò che è importante ricordare è che 2 delle 4 reazioni sono ossidazioni e che quindi:
per ogni acetil-CoA che si stacca dall’ acil-CoA
si formano 1NADH (+ H+) e 1FADH2.
Le 4 reazioni della b-ossidazione
Le 4 reazioni
che avvengono
per staccare
ogni acetile.
(da non imparare)
Questa serie di reazioni viene ripetuta tante volte quanti sono gli atomi di C della catena
diviso 2 meno uno, poiché in fondo si formano due acetil-CoA. Es: palmitoil-CoA 16:2-1
= 7 volte.
La b-ossidazione di un acido grasso a 10 atomi di C
Con la prima serie di 4 reazioni si forma 1 acil-CoA a 8C:
CH3
CH2
CH2
CH3
CH2
CH2
CH2
CH2
CH2
4 reazioni
CH2
CH2
CH2
CH2
CH2
carbonio a CH2
CH2
carbonio b
CO-CoA
acil-CoA a 10C
+ 1 CH3CoA (acetil-CoA)
+ 1 NADH+H+
+ 1 FADH2
CO-CoA
acil-CoA a 8C
La b-ossidazione di un acido grasso a 10 atomi di C
Con la seconda serie di 4 reazioni si forma 1 acil-CoA a 6C:
CH3
CH2
CH2
CH2
CH3
4 reazioni
CH2
CH2
CH2
CH2
CH2
carbonio a CH2
CH2
carbonio b
CO-CoA
acil-CoA a 8C
+ 1 CH3CoA (acetil-CoA)
+ 1NADH+H+
+ 1FADH2
CO-CoA
acil-CoA a 6C
La b-ossidazione di un acido grasso a 10 atomi di C
Con la terza serie di 4 reazioni si forma 1 acil-CoA a 4C:
CH3
CH2
carbonio b
CH3
4 reazioni
CH2
CH2
CH2
CH2
CO-CoA
carbonio a CH2
CO-CoA
acil-CoA a 6C
acil-CoA a 4C
+ 1 CH3CoA (acetil-CoA)
+ 1NADH+H+
+ 1FADH2
La b-ossidazione di un acido grasso a 10 atomi di C
Con la quarta serie di 4 reazioni si formano 2 acetil-CoA (a 2C):
CH3
carbonio b CH2
4 reazioni
carbonio a CH2
CO-CoA
acil-CoA a 4C
2
CH3
CO-CoA
acil-CoA a 4C
+ 1NADH+H+
+ 1FADH2
La demolizione di un acido grasso a 10C produce:
5 acetil-CoA (CH3Co-CoA)
4NADH (+H+)
4 FADH2
L’acil-CoA viene frammentato in tante molecole di acetil-CoA
quanti sono gli atomi di C che lo costituiscono diviso due.
Bilancio energetico della b-ossidazione di una acido a 10C
- 5 acetil-CoA che entrano nel ciclo di Krebs producono 12x5= 60 ATP
- 4 NADH+H+ alla catena respiratoria producono
3*x4= 12 ATP
- 4 FADH2 alla catena respiratoria producono
2*x4=
8 ATP
TOTALE 80 ATP
Se si considera che 1ATP è stato consumato all’inizio per l’attivazione dell’acido grasso:
il bilancio netto è di 79 ATP.
* [Come vedremo, in catena respiratoria mitocondriale, 1NADH+H+ produrrà 3ATP e 1FADH2 2ATP]
La b-ossidazione dell’acido palmitico
L’acido palmitico CH3-(CH2)14-COOH [attivato come CH3-(CH2)14-CO-CoA palmitoilCoA] è un acido grasso a 16 atomi di C e subisce 7 cicli di reazioni con liberazione in ogni
passaggio di 1acetil-coA, 1FADH2 e 1NADH + H+. Nell’ultimo passaggio si liberano
contemporaneamente 2 acetil-CoA dal residuo di acido grasso di soli 4 atomi di carbonio.
Al termine della b-ossidazione dell’acido palmitico il prodotto sarà di 8 acetil-CoA che
potranno afferire al pool, seguendo poi vari destini metabolici a seconda delle necessità
della cellula (nello schema che segue il ciclo di Krebs).
Saranno prodotti inoltre 7 FADH2 e 7 NADH + H+ il cui destino sarà la riossidazione nella
catena respiratoria mitocondriale con grande produzione di ATP.
La b-ossidazione, il ciclo di Krebs e la catena respiratoria
Ossidazione degli acidi grassi a numero dispari di atomi di carbonio
Se il numero di atomi di C dell'acido grasso è dispari, alla fine della b-ossidazione si
ottiene una molecola a 3 atomi di C il propionil-CoA (CH3CH2CO-CoA) che,
attraverso una serie di reazioni, verrà trasformato in succinil-CoA (intermedio del ciclo
di Krebs) [vedi diapositiva seguente]. Il succinil-CoA (HOOC-CH2CH2-CO-CoA) può
essere utilizzato direttamente o indirettamente in una grande varietà di processi
metabolici,
come ad esempio il ciclo di Krebs (di cui è un intermedio) o la
gluconeogenesi (vedi più avanti). Dal propionil-CoA quindi, a differenza dell'acetilCoA, è possibile sintetizzare glucosio.
Gli acidi grassi poliinsaturi vanno incontro a b-ossidazione, ma richiedono l'intervento
di specifici enzimi che rendono l'acido grasso aggredibile dagli enzimi della bossidazione.
Trasformazione del propionil-CoA
in succinil-CoA, intermedio del
ciclo di Krebs.
Regolazione della b-ossidazione e della sintesi degli acidi grassi
Bassi livelli di glucosio nel sangue stimolano la secrezione di due ormoni, l'adrenalina e il
glucagone che con la loro azione favoriscono l'ossidazione degli acidi grassi.
L'insulina ha invece azione opposta e con il suo intervento stimola la biosintesi degli acidi
grassi. Un aumento del glucosio ematico causa un aumento della secrezione di insulina
che con la sua azione facilita il passaggio del glucosio all'interno delle cellule. Il glucosio
in eccesso viene convertito in glicogeno e depositato come riserva nei muscoli e nel fegato.
Un aumento del glucosio epatico causa l'accumulo di malonil-CoA che inibisce la
carnitina aciltransferasi, rallentando la velocità di ossidazione degli acidi grassi.
Regolazione a breve termine:
1)inibizione della carnitina-aciltransferasi I da parte del malonil-CoA (CH3CH2COCoA), i cui livelli aumentano in seguito all'attivazione da parte dell' insulina della acetilCoA carbossilasi, che catalizza la reazione di addizione di CO2 all’acetil-CoA;
2)gli ormoni adrenalina e glucagone attivano la lipasi ormono-sensibile del tessuto
adiposo e quindi rendono disponibili gli acidi grassi per la b-ossidazione.
Regolazione a lungo termine:
1)i livelli della lipoprotein-lipasi del tessuto adiposo aumentano in seguito a stimolazione
insulinica (diminuiscono, invece durante il digiuno);
2)i livelli della lipoprotein-lipasi del cuore aumentano durante il digiuno e diminuiscono
in presenza di insulina.
Tessuto adiposo bianco e tessuto adiposo bruno
Nei mammiferi esistono due differenti tipi di tessuto adiposo: quello bianco e quello bruno. Il primo,
nonostante il nome, ha un colorito giallognolo, legato al suo contenuto in carotenoidi. Da solo
rappresenta la quasi totalità del grasso di riserva. L’altro tipo di tessuto adiposo, detto bruno, è
abbondante nei mammiferi che vanno in letargo. Nell’uomo il tessuto adiposo bruno è presente in
piccole quantità nel neonato (zona ascellare e interscapolare). Con la crescita buona parte di questo
tessuto si trasforma in tessuto adiposo bianco.
Principali funzioni del tessuto bianco:
- sintetizzare trigliceridi e immagazzinarli come riserva energetica ;
- idrolizzare i trigliceridi depositati e immettere acidi grassi liberi nel sangue;
- sintetizzare trigliceridi a partire dal glucosio;
- ammortizzatore meccanico, isolante termico e produttore di ormoni tra cui la leptina , deputata
alla regolazione dell’appetito.
Il tessuto adiposo bruno ha invece esclusivamente la funzione di produrre calore, perché i mitocondri
delle cellule adipose hanno meno ATP sintetasi, l'enzima che catalizza la sintesi dell'ATP nella catena
respiratoria mitocondriale.












