Dispense prodotte nel corso
POF
“Giochi della Chimica 2012”
VI Lezione
1
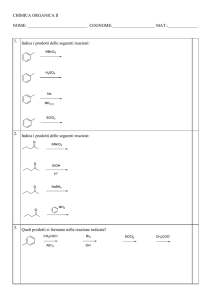
CHIMICA ORGANICA
2
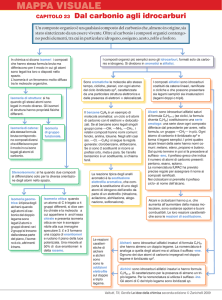
Chimica Organica
La chimica organica è la chimica dei composti contenenti carbonio
I carbonati, il biossido di carbonio e i cianuri metallici sono un’eccezione in
quanto vengono classificati come composti inorganici. Una definizione più
corretta è:
La chimica dei composti contenenti legami carbonio-carbonio
Il carbonio è l’unico elemento capace di legarsi fortemente con se stesso e
formare lunghe catene o anelli e allo stesso tempo capace di legarsi
fortemente con elementi non metallici come idrogeno, ossigeno, azoto e con
gli alogeni.
Per queste sue proprietà questo elemento dà origine a miriadi di
composti (sono noti diversi milioni di composti, corrispondenti a circa il
98% di tutte le sostanze chimiche note, e il loro numero continua a crescere)
Il termine chimica organica deriva dal fatto che una volta con questo termine si definivano i composti che
potessero essere sintetizzati solo da organismi viventi, come ad esempio legno, ossa, vestiti,
cibi, medicine, e le sostanze complesse che formano il nostro corpo (in antitesi con la chimica
inorganica che era quella basata sui composti sintetizzati artificialmente). In realtà si è visto che questi
3
materiali possono essere sintetizzati vacilmente anche in laboratorio
Campi di interesse della chimica organica
Visto l’elevatissimo numero di composti organici esistenti, la
chimica organica riveste un ruolo fondamentale in innumerevoli campi. In
particolare, la chimica organica svolge un ruolo fondamentale per la
comprensione dei sistemi viventi. Come detto in precedenza gli
organismi viventi sono composti principalmente da molecole
organiche e i meccanismi che permettono a questi organismi di
sopravvivere e riprodursi, possono essere scomposti in una serie di
semplici reazioni di chimica organica. La chimica organica e’ stata
quindi fondamentale per capire i processi biologici e per sintetizzare
farmaci.
Un altro importante campo di applicazione della chimica organica è
nella sintesi dei materiali polimerici. I polimeri (o materie plastiche)
sono infatti delle molecole organiche e i processi di sintesi
(polimerizzazione) sono delle reazioni di chimica organica.
I composti del carbonio (in particolare quelli ottenuti dal petrolio)
svolgono inoltre un ruolo fondamentale nel soddisfare il nostro
fabbisogno energetico (riscaldamento, trasporti, illuminazione…..)
4
Idrocarburi
Sono i composti organici binari, costituiti solo da Carbonio e Idrogeno
Saturi
Alifatici
alcani
alcheni
Insaturi
Idrocarburi
alchini
Aromatici
alifatici quando sono costituiti da catene lineari, ramificate o cicliche;
•saturi: presentano esclusivamente legami singoli carbonio-carbonio
•insaturi: contengono almeno un legame multiplo carbonio-carbonio
aromatici quando presentano una particolare struttura ciclica.
5
Idrocarburi saturi: alcani
•Ogni atomo di carbonio ha ibridazione sp3 ed è legato a 4 atomi mediante
legami s.
•La famiglia degli alcani costituisce una serie omologa cioè una serie di
composti dove ogni membro differisce dal successivo di un termine costante
CH2 detto gruppo metilene
Formula generale degli alcani:
CnH2n+2
(n > 1)
n=1
CH4
CH4
metano
n=2
C2H6
CH3-CH3
etano
n=3
C3H8
CH3-CH2-CH3
propano
n=4
C4H10 CH3-CH2-CH2-CH3
butano
6
Alcani: struttura tetraedrica del carbonio
Rappresentazione tridimensionale della molecola di CH4.
Dalla teoria VSEPR è prevedibile che la geometria
imposta dalle coppie elettroniche attorno all’atomo di
carbonio centrale del CH4 sia tetraedrica e può
essere descritta in termini di un atomo di carbonio
che lega quattro atomi di idrogeno con ibridazione
sp3.
109°28
C
Struttura tetraedrica che mostra
l’angolo di legame
Modello “space
Modello per la rappresentazione Modello “ball and stick” filling”
7
“planare”
Alcani: rotazione intorno al legame s
La rotazione lungo l’asse carbonio-carbonio non influenza la
sovrapposizione dei due orbitali sp3 che formano il legame
carbonio-carbonio e quindi non modifica l’energia di legame.
Per questo motivo la rotazione intorno all’asse C-C è libera.
8
Isomeria
Si dicono isomeri i composti che hanno medesima formula bruta, ma che
differiscono per
– La struttura delle molecole (isomeri di struttura), in quanto può variare
• il modo in cui gli atomi si legano tra loro (isomeri di catena)
• il tipo di gruppo funzionale (isomeri funzionali)
• la posizione del gruppo funzionale (isomeri di posizione)
– La disposizione spaziale degli atomi che costituiscono le molecole
(stereoisomeri o isomeri spaziali)
– isomeri configurazionali (o ottici)
– isomeri geometrici
– isomeri conformazionali
Per trasformare uno isomero nell’altro è necessario rompere e riformare
almeno un legame, ad eccezione degli isomeri conformazionali,
9
Isomeri di struttura (o di catena)
L’isomeria interessa la struttura dello "scheletro" di carbonio, ossia la
forma della catena degli atomi di carbonio (es. catena lineare e catena
ramificata); isomeri di questo tipo hanno proprietà fisiche diverse, ma
reattività chimiche spesso abbastanza simili;
All’aumentare del numero di atomi di carbonio,
aumenta il numero dei possibili isomeri.
10
Isomeri funzionali
Gli isomeri funzionali si hanno quando le molecole presentano
gruppi funzionalmente diversi, ed hanno quindi proprietà chimiche e
fisiche molto differenti
CH3CH2 CHO
Aldeide propionica
CH3CCH3
O
Acetone
11
Isomeri di posizione
L’isomeria di posizione si ha quando una molecola presenta doppi o
tripli legami oppure atomi diversi oltre a quelli di carbonio e idrogeno;
che possopno posizonarsi in punti diversi della catena carboniosa
12
Stereoisomeri configurazionali (ottci) e geometrici
Sono molecole che presentano gli stessi legami ma differiscono per il modo
in cui gli atomi sono orientati nello spazio. Per trasformare uno
stereoisomero nell’altro è necessario rompere e riformare almeno un
legame.
Si chiamano isomeri geometrici gli isomeri che debbono la loro esistenza
alla mancanza di libera rotazione intorno ai doppi legami (isomeria
cis/trans nel 2-butene).
Si chiamano isomeri ottici o enantiomeri gli isomeri ottici che non sono
sovrapponibili alla loro immagine speculare.
Si chiamano diastereoisomeri gli stereoisomeri ottici che non sono uno
l’immagine speculare dell’altro.
La formazione di enantiomeri e di
diasteroisomeri è dovuta alla presenza di
atomi di carbonio chirali ossia atomi legati a
quattro gruppi diversi.
Si dicono chirali tutti gli oggetti distinguibili
dalla loro immagine speculare, ovvero non
sovrapponibili a essa. Le mani sono un
esempio di oggetti chirali.
13
L’atomo di carbonio tetraedrico legato a quattro gruppi diversi è un
centro chirale o stereocentro e forma due isomeri ottici detti
enantiomeri.
Gli enantiomeri hanno identiche proprietà chimiche e fisiche, e differiscono
solo per l’attività ottica.
Gli enantiomeri infatti fanno ruotare dello stesso angolo, ma in direzione
opposta, il piano della luce polarizzata (sono cioè antipodi ottici).
Quando nella molecola c’è più di un atomo chirale si hanno sia enantiomeri
che diasteroisomeri
14
Il miscuglio al 50% di due enantiomeri è chiamato racemo e non è
otticamente attivo.
Quando nella molecola c’è più di un atomo chirale si hanno sia enantiomeri
che diasteroisomeri
15
Conformazioni degli alcani (isomeri conformazionali)
Nelle molecole in cui ci sono legami semplici le possibili orientazioni date dalla
rotazione di un legame C-C e dalle possibili conformazioni di una molecola (come ad
esempio nel caso in cui i sostituenti di un atomo o una catena di atomi si orienti ad elica
e anche nelle conformazioni dei cicloalcani) producono molecole con ugual formula
bruta, ugual struttura ma non sovrapponibili. Un isomero conformazionale si dice anche
conformero o rotamero. È il caso di sottolineare che i conformeri non sono dei veri e
propri isomeri, in quanto la barriera energetica tra le varie orientazioni è molto piccola e,
a temperatura ambiente, l'una si trasforma nell'altra, pur avendo ciascuna una maggiore
o minore probabilità a seconda della stabilità.
16
La nomenclatura degli idrocarburi saturi
La nomenclatura degli alcani
prevede la desinenza -ano.
I primi quattro termini presentano
nomi particolari poi, a partire,
dalla catena a 5 atomi di
carbonio, il prefisso è numerico.
Alle catene idrocarburiche lineari
si antepone n- al nome della
catena.
Atomi di
carbonio
prefisso
1
2
3
4
5
6
metetpropbutpentes-
17
I carboni di una catena si
identificano in primari,
secondari, terziari o
quaternari a seconda che
siano legati rispettivamente a
uno, due, tre o quattro atomi
di carbonio.
Nelle catene ramificate si numerano gli atomi di
carbonio in modo che quelli sostituiti abbiano il
numero più piccolo possibile.
Quando sono presenti diversi sostituenti
vanno elencati in ordine alfabetico usando i
prefissi di-, tri-, etc. per indicare la presenza di
sostituenti uguali
Quando gli alcani fungono da
sostituenti essi vengono denominati
sostituendo il suffisso -ano con il
suffisso -il. Sono chiamati gruppi
alchilici.
CH3
CH2 CH3
CH2 CH2 CH3
CH3 CH CH3
metil
etil
propil
isopropil
18
Proprietà fisiche e chimiche degli idrocarburi saturi
I composti appartenenti alla stessa serie omologa presentano
– proprietà chimiche simili;
– proprietà fisiche differenti dipendenti dal peso molecolare e dalla forma
della molecola.
Il punto di ebollizione aumenta all’aumentare della massa molecolare.
Le catene lineari hanno punti di ebollizione superiori a quelli delle
catene ramificate (le forze di London sono più deboli).
I punti di fusione sono superiori per le catene ramificate rispetto a
quelle lineari.
Alcani e cicloalcani sono composti apolari e fungono da solventi per
le sostanze apolari, come per esempio i grassi.
Alcani e cicloalcani sono insolubili in acqua perché non riescono a
formare legami a idrogeno né legami dipolo-dipolo.
19
Reazioni degli alcani
Alcani e cicloalcani non sono particolarmente reattivi; tuttavia, in
specifiche condizioni, vengono usati come combustibili perché
danno reazioni di combustione con l’ossigeno.
Alcani e cicloalcani in opportune condizioni (alte temperature, luce)
reagiscono con gli alogeni, dando luogo a reazioni di alogenazione
in cui uno o più idrogeni sono sostituiti da alogeni.
20
Reazioni degli alcani
Gli alcani sono poco reattivi ma possono reagire ad alta temperatura
•Reazione di combustione:
Reazione tra l’alcano ed ossigeno con formazione di CO2 e H2O. Reazione esotermica.
C4H10(g) + 13/2 O2
•Reazioni di sostituzione
hn
CH4 + Cl2
hn
CH3Cl + Cl2
CH2Cl2 + Cl2 hn
CHCl3 + Cl2 hn
4 CO2 + 5 H2O
CH3Cl + HCl
CH2Cl2 + HCl
CHCl3+ HCl
CCl4+ HCl
clorometano
diclorometano (clouro di metilene)
triclorometano (cloroformio)
tetraclorometano
La reazione avviene con un meccanismo radicalico:
Cl2
hn
2Cl•
Il Cl• è molto reattivo e capace di attaccare il legame C-H
•Reazioni di deidrogenazione
Si ottengono idrocarburi insaturi mediante rimozione di atomi di H
CH3-CH3
Cr2O3
500°C
CH2=CH2 + H2
21
Cicloalcani
Oltre a formare catene, gli atomi di C possono formare degli anelli. I cicloalcani sono
anelli formati esclusivamente da gruppi CH2
Formula generale dei cicloalcani:
CnH2n (n >= 3)
C
C
C
Il più semplice è il ciclopropano C3H6 in cui gli
atomi di C formano un triangolo equilatero con angoli
di 60°; gli orbitali ibridi sp3 non si sovrappongono
estesamente e ciò provoca un legame C-C debole ed
in tensione e la molecola è molto più reattiva del
propano. Analogamente si comporta il ciclobutano
(angoli di 90°). Al contrario il cicloepentano e il
cicloesano sono abbastanza stabili perché i loro
anelli hanno angoli di legame più vicini all’angolo del
tetraedro.
Il cicloalcano più interessante dal punto di vista biologico è il cicloesano, che
presenta due conformazioni possibili: a sedia (più stabile) e a barca (meno stabile).
22
Cicloesano: conformazioni a barca e sedia
Questi due protoni tendono a respingersi
Conformazione a
barca
Conformazione a
sedia
Non si hanno interazioni tra
protoni e di conseguenza
questa è la forma più stabile
Gli idrogeni in rosso sono detti equatoriali mentre quelli in blu sono detti assiali
23
Gli idrocarburi insaturi:alcheni
Gli alcheni sono idrocarburi che
presentano almeno un doppio
legame
nella
molecola,
ibridazione
sp2,
geometria
planare e angoli di legame di
120°. Il legame σ C-C è formato
per accoppiamento di due
elettroni presenti negli orbitali
sp2 e il legame π per
accoppiamento di elettroni p. I
due orbitali p sui due atomi
di carbonio dell’etilene devono
essere allineati (paralleli) per
poter formare legami p. Questo
impedisce la rotazione dei due
gruppi CH2
l’uno rispetto
all’altro a temperatura ordinaria,
contrariamente agli alcani per i
quali è possibile la libera
rotazione.
La formula generale degli alcheni è
CnH2n
24
La nomenclatura degli alcheni è simile a quella degli alcani, con il
suffisso –ene.
Per attribuire il nome agli alcheni, gli atomi di carbonio della catena vanno
numerati in modo da indicare la posizione dei doppi legami e degli
eventuali radicali presenti.
Il doppio legame è indicato dall’atomo di Carbonio a numerazione più
bassa
CH2 CH CH2
CH3
1-butene
CH3 CH
CH3
2-butene
CH
H
H
6
H3C
5
4
CH2 CH
C
3
CH
2
CH3
1
CH23
4-metil-cis-2-esene
25
Alcheni: isomeria cis/trans
Attorno agli atomi di C uniti mediante il doppio legame la rotazione è
impedita. Ciò comporta il manifestarsi dell’isomeria geometrica.
Se due gruppi diversi si trovano dalla stessa parte del piano rispetto al
doppio legame, l’isomero si dice cis; se i due gruppi si trovano da parti
opposte l’isomero si dice trans.
Ad esempio il 2-butene esiste in due isomeri geometrici.
H
H
Cis 2-butene
C=C
CH3
CH3
CH3
H
Trans 2-butene
C=C
CH3
H
26
Gli idrocarburi insaturi:alchini
Gli alchini sono idrocarburi
con almeno un triplo legame
nella molecola, ibridazione
sp, geometria lineare e
angoli di legame di 180°.
Negli alchini i carboni del
triplo legame presentano
ibridazione sp. Il legame σ
C-C è formato per
accoppiamento di due
elettroni presenti negli
orbitali sp e i 2 legami π per
accoppiamento di due
coppie di elettroni p.
Analogamente agli alcheni,
anche per gli alchini la
rotazione intorno all’asse CC è impedita a temperatura
ordinaria.
La formula generale degli alchini è CnH2n-2
La nomenclatura degli alchini segue
quella degli alcani, con il suffisso –ino.
Per attribuire il nome gli atomi di carbonio
della catena vanno numerati in modo da
indicare la posizione dei dei tripli legami e
27
degli eventuali radicali presenti.
Reazioni di alcheni e alchini
Le principali reazioni sono reazioni di addizione con rottura di legami p che
sono più deboli dei legami s. Le più importanti sono:
Reazioni di idrogenazione
CH2 CH CH3
+
H2
Pt
CH3 CH2 CH3
Reazioni di alogenazione
CH2 CH CH2
CH3
+
Br2
Pt
CH2 CH
Br
CH2 CH3
Br
Un’altra importante reazione degli idrocarburi insaturi è la reazione di polimerizzazione.
Tra gli esempi più importanti di polimeri ottenibili da idrocarburi insaturi ci sono il
polietilene, il polipropilene, il polibutadiene e il polistirene.
cat.
n CH2 CH2
CH2 CH2
n
28
Idrocarburi aromatici
Il capostipite degli idrocarburi aromatici è il benzene, C6H6.
Il benzene viene rappresentato come ibrido di risonanza* di due forme
limite che differiscono per la posizione dei doppi legami.
I sei elettroni di tipo p formano un orbitale molecolare delocalizzato sopra
e sotto il piano della molecola
Le reazioni caratteristiche degli idrocarburi aromatici sono di
sostituzione elettrofila aromatica.
*Formule di risonanza: si ha risonanza quando una molecola può essere rappresentata da due o
più strutture ad energia simile che si differenziano solo per la disposizione degli elettroni 29
La nomenclatura dei
composti aromatici
usa nomi tradizionali.
Nei composti aromatici
bisostituiti si formano isomeri
che prendono i prefissi
– orto- se sono legati a carboni
adiacenti;
– meta- se legati ai carboni 1 e 3;
– para- se sono legati a carboni
opposti.
Molecole aromatiche più complese
possono essere visti come degli anelli
benzenici “fusi”. Queste molecole sono
dette composti aromatici ad anelli
condensati
naftalene
fenantrene
antracene
30
I gruppi funzionali
Un gruppo funzionale è un atomo o un gruppo di atomi capace di
conferire una particolare reattività alla molecola di cui fa parte.
Quando il benzene funge da sostituente è detto gruppo fenile.
31
Alcoli
Gli alcoli derivano dagli idrocarburi per sostituzione di un idrogeno
con un gruppo ossidrile (—OH) che ne diventa il gruppo funzionale.
La formula generale degli alcoli è R—OH.
Gli alcoli si classificano in primari, secondari e terziari a seconda che
l’atomo di carbonio a cui è legato l’ossidrile sia unito rispettivamente a
uno, due o tre atomi di carbonio.
Secondo la nomenclatura IUPAC, il nome dell’alcol deriva da quello
dell’idrocarburo corrispondente a cui si aggiunge la desinenza -olo.
Se presentano due o tre gruppi ossidrili, gli alcoli prendono il nome di
32
dioli e trioli.
Il metanolo (CH3OH) è una sostanza altamente tossica: 30 mL
provocano la morte di un essere umano adulto.
È un importante intermedio dell’industria chimica, inoltre viene
impiegato come carburante per autotrazione e nelle celle a
combustibile.
L’etanolo (CH3CH2OH) è il costituente di tutte le bevande alcoliche.
Si ottiene per fermentazione degli zuccheri da parte di
microorganismi.
Viene adoperato come combustibile al posto della benzina e trova
impiego nell’industria dei solventi, dei profumi e dei cosmetici.
33
Il glicol etilenico è un diolo che viene impiegato come liquido
anticongelante grazie all’alto punto di ebollizione e alla totale solubilità
in acqua.
Il glicol etilenico è usato per la sintesi di numerosi composti tra cui il
PET, la resina con cui si producono le bottiglie «di plastica».
Il glicerolo, più noto come glicerina, è un triolo.
Trova impiego nell’industria dei cosmetici e delle vernici.
Il derivato nitrato del glicerolo, la nitroglicerina, è un potente esplosivo
che viene impiegato anche, in soluzione alcolica molto diluita, nella
terapia dell’angina pectoris.
34
Fenoli
Il fenolo è il capostipite degli alcoli aromatici a
cui dà il nome (fenoli).
I composti fenolici hanno proprietà antiossidanti
e azione disinfettante.
Eteri
Gli eteri sono caratterizzati da un atomo di ossigeno che lega due
gruppi alchilici.
Hanno formula generale degli eteri è R—O—R’.
La nomenclatura degli eteri si basa sul nome, in ordine alfabetico, delle
catene alchiliche presenti nella molecola, a cui segue il nome etere.
35
Proprietà fisiche e chimiche di alcoli, fenoli ed eteri
A parità di massa molecolare, gli alcoli e i fenoli hanno punti di
ebollizione più alti rispetto agli idrocarburi e agli eteri.
La solubilità degli alcoli decresce all’aumentare del numero di atomi di
carbonio: la buona solubilità di metanolo, etanolo e propanolo in acqua è
dovuta alla formazione di legami a idrogeno.
36
Gli alcoli sono acidi molto deboli; i fenoli al contrario sono circa un
milione di volte di più acidi perché lo ione fenossido (ArO–) è molto
più stabile dello ione alcossido (RO–).
La reazione di disidratazione degli alcoli appartiene alla categoria
delle reazioni di eliminazione: dalla molecola di alcol vengono
eliminati un H e un gruppo OH.
37
Il carbonio è tanto più ossidato quanti più legami forma con l’ossigeno
e quanti meno ne forma con l’idrogeno
(ossidazione del carbonio).
Gli alcoli primari sono ossidati prima ad aldeidi e poi ad acidi
carbossilici; gli alcoli secondari sono invece ossidati a chetoni.
38
Aldeidi e chetoni
Le aldeidi hanno gruppo funzionale —CHO.
I chetoni hanno gruppo funzionale —CO—.
Sono detti anche composti carbonilici.
La nomenclatura utilizza il nome dell’alcano corrispondente a cui
si aggiunge
– il suffisso -ale per le aldeidi;
– il suffisso -one per i chetoni.
39
Acidi carbossilici e loro derivati
Gli acidi carbossilici sono caratterizzati dal gruppo funzionale —
COOH, chiamato gruppo carbossile.
La nomenclatura degli acidi carbossilici prevede l’aggiunta del
suffisso -oico al nome dell’alcano corrispondente.
Alla nomenclatura IUPAC ne è affiancata una corrente tutt’ora in
uso.
40
Acidi carbossilici e loro derivati
Gli acidi carbossilici tendono a formare legami a idrogeno
intermolecolari; pertanto presentano punti di ebollizione abbastanza alti.
In acqua sono solubili solo gli acidi formico, acetico e propionico.
Gli acidi carbossilici sono acidi deboli, ma sono più forti dei fenoli e degli
alcoli.
Reagiscono con basi forti formando dei sali.
41
A partire dagli acidi carbossilici, con reagenti adeguati, si ottengono
diversi derivati, tutti caratterizzati dalla presenza del gruppo acilico —
RCO.
Gli esteri si ottengono per reazione fra un acido carbossilico e alcol
ad alta temperatura.
42
Acidi carbossilici e loro derivati
I grassi (solidi e saturi) e gli oli (liquidi e insaturi) sono esteri del
glicerolo (trigliceridi) con acidi carbossilici a lunga catena sia saturi
sia insaturi.
43
Acidi carbossilici e loro derivati
I grassi e gli oli riscaldati con una soluzione acquosa di NaOH (o di
KOH) danno luogo ad un’idrolisi alcalina.
I saponi sono i sali di sodio (o di potassio) degli acidi grassi a lunga
catena.
I saponi sono formati da una lunga catena idrocarburica detta coda,
idrofobica, alla cui estremità si trova il gruppo –COO– detto testa,
che è idrofilo.
A contatto con un tessuto sporco, le code apolari disperdono le
molecole di grasso in acqua.
44
L’azione detergente dei saponi dipende dalla durezza dell’acqua,
cioè dal contenuto di sali di calcio e magnesio.
45
Acidi carbossilici e loro derivati
Le ammidi sono derivati degli acidi carbossilici molto diffuse in natura
(per esempio nelle proteine).
La nomenclatura delle ammidi prevede la sostituzione del suffisso ammide al nome dell’acido corrispondente
46
Ammine
Le ammine derivano dall’ammoniaca (NH3) per sostituzione di uno,
due o tutti gli atomi di idrogeno con altrettanti gruppi alchilici.
Il gruppo funzionale delle ammine è il gruppo amminico.
La nomenclatura delle ammine prevede che si indichino i nome dei
gruppi alchilici legati all’azoto con la desinenza -ammina.
47
Le ammine primarie e secondarie formano legami a idrogeno
intermolecolari, per cui i loro punti di ebollizione sono più alti di quelli
degli alcani a uguale massa molecolare.
Le ammine con pochi atomi di carbonio sono solubili in acqua.
Le ammine sono composti basici (deboli) in virtù del doppietto
elettronico libero dell’azoto.
48
I polimeri di sintesi
I polimeri sono molecole ad alta massa molecolare costituite da un
insieme di gruppi chimici legati tra loro da legami covalenti.
Le unità costituenti i polimeri sono i monomeri (molecole a basso
peso molecolare).
I polimeri di addizione derivano molecole di alcheni che, in
presenza di opportuni catalizzatori, si uniscono tramite reazioni che
coinvolgono i doppi legami.
L’esempio più semplice è il polietilene.
I polimeri di condensazione derivano dalla reazione tra due diversi
gruppi funzionali che eliminano molecole di H2O, H2 o HCl.
Ne sono un esempio il PET e il nylon.
49