INTRODUZIONE
ALLO STUDIO
DELLA
CHIMICA ORGANICA
• le tecniche analitiche avevano mostrato
che le sostanze definite organiche
contenevano sempre carbonio (C) e
idrogeno (H) e spesso ossigeno (O),
azoto (N), fosforo (P), zolfo (S), alogeni
(F, Cl, Br, I) ecc&;
• si
riteneva,
tuttavia,
che
esse
sottostessero a leggi diverse da quelle
della chimica inorganica e, soprattutto, che
fossero prodotte esclusivamente sotto
l’influenza della cosiddetta forza vitale
(vis vitalis) e non potessero essere
preparate artificialmente.
• ai primi dell’800 Il chimico svedese Jacob
Berzelius
(1779-1848)
indicava
le
sostanze con il termine organico se
ottenute dagli organismi viventi (animali e
vegetali) ed inorganiche tutte le altre;
• le sostanze chimiche erano pertanto
distinte in due categorie fondamentali:
- i composti inorganici;
- i composti organici;
basandosi solo sulla loro origine.
• nel 1828 Friedrich Wöhler (1800-1882),
nel tentativo di preparare il cianato di
ammonio (NH4CNO) effettuò la prima
sintesi artificiale di un composto
considerato di esclusiva origine animale,
l’urea (NH2CONH2):
• fece cadere di fatto la distinzione fra le
due classi che fu però mantenuta, pur
perdendo il suo significato originale.
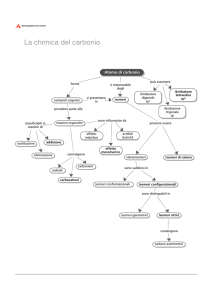
COMPOSTI DEL CARBONIO
INORGANICI
GRUPPO CARBOSSILE - CHETONICO
AMMIDE
GRUPPO AMMINICO
• CO
• CO2
• la chimica organica, in realtà, veniva ad
essere definita come la chimica dei
composti del carbonio e tale definizione
è tuttora in uso.
(sia organico che inorganico)
• H2CO3 da cui
CO32carbonati
(sia organico che
inorganico)
CHIMICA ORGANICA
GRUPPO
NUMERO ATOMICO
MINERALOGIA
MASSA ATOMICA
ELETTRONEGATIVITA’
NUMERI OSSIDAZIONE
CONFIGURAZIONE ELETTRONICA
ISOTOPO:
atomi di uno stesso elemento (stesso
numero atomico = stesso numero di
protoni) ma diverso numero di massa
(diverso numero di neutroni).
ISOTOPO RADIOATTIVO o
RADIOISOTOPO o
RADIONUCLIDE
• possono essere usati come traccianti e
per la radiodatazione.
ELETTRONEGATIVITÁ
• l’elettronegatività di un elemento misura
la sua tendenza ad attrarre gli elettroni di
legame da un altro elemento;
• l’elettronegatività aumenta lungo un
periodo, e diminuisce lungo un gruppo.
12C
13C
14C
98,89%
1,11%
tracce
radioattivo
tempo dimezzamento =
5570 anni
(la massa atomica del carbonio presente
nelle tavole periodiche è una media
ponderata dei vari isotopi).
• i legami chimici possono essere:
- legami intramolecolari;
- legami intermolecolari;
• “Perché si formano i legami chimici?”
• gli atomi tendono spontaneamente a
legarsi;
• il legame chimico si forma perché l’energia
complessiva del sistema molecola è
inferiore a quella del sistema formato da
atomi isolati (→ concetto di energia di
legame);
energia di legame:
è la quantità di energia per mole
necessaria a rompere un dato legame
(allo stato gassoso) o anche l’energia
sviluppata per mole quando si forma tale
legame.
lunghezza di legame:
distanza tra i nuclei di due atomi coinvolti
in un legame covalente (→ concetto di
energia di legame).
LEGAME SEMPLICE
• condivisione di una coppia di elettroni
• C-C
1 legame σ
LEGAME DOPPIO
• condivisione di due coppie di elettroni
• C=C
1 legame σ e 1 legame π
LEGAME TRIPLO
• condivisione di tre coppie di elettroni
• C≡C
1 legame σ e 2 legami π
ISOMERI:
si dicono isomeri due o più composti
diversi, aventi la stessa composizione
elementare, e quindi la stessa formula
grezza, ma differente formula di struttura.
• esempi in Scienze della Terra:
- C
grafite/diamante
- CaCO3 calcite/aragonite
- SiO2
quarzo/opale
• Vi sono varie forme di isomeria:
1) ISOMERI COSTITUZIONALI
a) isomeri di catena;
b) isomeri di posizione;
c) isomeri di funzione.
2) STEREOISOMERIA
a) isomeri conformazionali;
b) isomeri configurazionali;
b’) isomeri geometrici;
b”) isomeri ottici.
*
*
* CARBONIO CHIRALE
• a definire:
- dimensioni,
- forma e
- orientamento
di un dato orbitale concorrono 3 numeri
quantici:
1) numero quantico principale n,
2) numero quantico secondario l;
3) numero quantico magnetico m.
ORBITALE:
regione dello spazio intorno al nucleo in
cui è massima (almeno il 90%) la densità
di probabilità di presenza dell’elettrone, in
base all’energia che esso possiede.
• La somma degli esponenti che compaiono
nella configurazione elettronica deve
corrispondere al numero Z;
• esempi:
Cl (Z = 17)
1s2 2s2 2p6 3s2 3p5
K (Z = 19)
1s2 2s2 2p6 3s2 3p6 4s1
ORBITALI sp
ORBITALI sp3
ORBITALE IBRIDO
• fermo
restando
la
configurazione
elettronica di tutti gli atomi nel loro stato
fondamentale in taluni casi al momento di
reagire la distribuzione elettronica a causa
delle energie in gioco subisce delle
alterazioni;
• alcune coppie di elettroni si spaiano e gli
elettroni componenti vanno a occupare da
soli orbitali vacanti (vuoti) caratterizzati da
energia di poco superiore;
ORBITALI sp2
CH4
RISONANZA
• intorno alla fine degli anni ’30 si scoprì che
le proprietà di molte molecole e di alcuni
ioni non si poteva spiegare in base alla
configurazione di Lewis;
• la struttura reale di alcune molecole è una
forma intermedia (o mesomera) tra due o
più strutture equivalenti (forme limite) che
in essa coesistono
e ad essa
contribuiscono in ugual misura (ibrido di
risonanza).
BENZENE
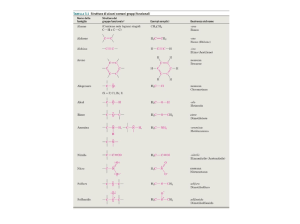
NOMENCLATURA IUPAC