BIOCHIMICA NUTRIZIONALE
Scuola di Specializzazione in
Alimentazione Animale
TERMINOLOGIA
• Scienza dell’alimentazione
studia gli aspetti relativi alla composizione degli alimenti e
alla loro validità nutrizionale ed è in grado di indicare le
scelte più idonee a soddisfare i fabbisogni nutrizionali
• Scienza della nutrizione
studia gli aspetti relativi all’impatto dei nutrienti sulle
componenti strutturali e funzionali dell’organismo ed è in
grado di determinare i fabbisogni nutrizionali
BIOCHIMICA DELLA NUTRIZIONE
NUTRIZIONE = Utilizzazione degli alimenti da parte degli esseri viventi
Processi biochimici
Uomo
Denutrizione Ipernutrizione
Animali di interesse zootecnico
Nutrizione ottimale
Fabbisogno alimentare qualitativo e
quantitativo per mantenere un
buono stato di salute (
migliore
produttività)
IMPORTANZA DELLA NUTRIZIONE
• Salute
• Performance
• Prevenzione di malattie
• Produttività
• Longevità
NURIZIONE E SALUTE
STATO DI NUTRIZIONE
Composizione corporea
Funzionalità corporea
STATO DI SALUTE
Bilancio energetico
APPROCCIO ALLA NUTRIZIONE
• Valutazione dello stato di nutrizione
• Determinazione dei fabbisogni nutrizionali
• Valutazione della biodisponibilità dei nutrienti
• Relazioni tra nutrienti e metabolismo
FABBISOGNI NUTRIZIONALI ESSENZIALI
Amminoacidi
Uomo
Alcune differenze in altre specie
Istidina, 1isoleucina, leucina, lisina,
2fenilalanina
metionina
(cisteina),
3
(tirosina), treonina, triptofano, valina
coperto dall’attività della flora batterica
L’arginina2 è necessaria per i ratti in crescita e nei gatti, sia in
crescita sia adulti. La glicina è necessaria nei polli e la taurina nei
gatti. La maggior parte degli amminoacidi non sono essenziali nei
ruminanti; in altri erbivori la maggior parte del fabbisogno è
coperto dall’attività della flora batterica intestinale
L’acido arachidonico è specificatamente richiesto nei gatti
Acidi grassi
3(acido
Acido
linoleico
4
arachidonico),acido a-linolenico
Vitamine
Idrosolubili
Acido
ascorbico
(C),
biotina,
5cobalammina
(B12), acido folico,
niacina, acido pantotenico, piridossina
(B6), riboflavina (B2), tiamina (B1)
La maggior parte dei mammiferi può sintetizzare l’acido
ascorbico, che è essenziale solo per primati, cavie e certi
pipistrelli dell’India. Le vitamine idrosolubili non sono essenziali
nei ruminanti; in altri erbivori il fabbisogno è coperto
dall’attività della flora batterica intestinale
Vitamina A, D6, E, K5
Molte specie possono utilizzare il b-carotene come fonte di
vitamina A (retinolo), che deve essere fornita come tale nei gatti
Liposolubili
Sostanze minerali
Macrominerali
Microminerali
(elementi traccia)
Calcio, cloro,
potassio, sodio
magnesio,
fosforo,
Cromo, ferro, iodio, manganese,
molibdeno, rame, selenio, zinco
Fibra
Necessario per una condizione di salute
ottimale
Acqua
Il costituente essenziale della dieta
1Necessaria
E’ stato dimostrato che silicio, vanadio, nichel, arsenico, fluoro e
stagno sono essenziali in molte specie e forse anche nell’uomo
Il cobalto è necessario nei microrganismi del rumine per la sintesi
della cobalamina
per i neonati e probabilmente nei bambini e negli adulti; 2Può essere in parte essenziale nei neonati; 3Cisteina, tirosina
e acido arachidonico permettono di ridurre il fabbisogno di metionina, fenilalanina e acido linoleico. 4Non è chiaro se l’acido alinolenico sia essenziale nella dieta umana; 5Sintetizzata dai microrganismi intestinali; fabbisogno alimentare incerto; 6
L’esposizione della pelle alla luce solare ne riduce il fabbisogno alimentare.
LE PIÙ IMPORTANTI VIE METABOLICHE
Molecole
alimentari
Digestione
Molecole Assorbimento Vie anfiboliche
semplici
Proteine, carboidrati,
lipidi, acidi nucleici
2H
~ P
Altri processi
endoergonici
O2
CO2 + H2O
Le vie cataboliche rilasciano energia libera sotto forma di equivalenti
riducenti (2H) o fosfato ad alta energia (P) per potenziare le vie anaboliche.
Le vie anfiboliche collegano le altre due vie.
FABBISOGNO ENERGETICO
Apporto di energia, di origine alimentare, necessario a compensare il
dispendio energetico (trasferimento di energia da un organismo
all’ambiente esterno)
Metabolismo basale
+
Termogenesi indotta dalla dieta
+
Attività fisica
=
DISPENDIO ENERGETICO TOTALE
Unità di misura dell’energia
Kilocaloria (kcal)
Quantità di calore necessaria per elevare da 14,5°C a 15,5°C 1 kg di acqua
Kilojoule (KJ)
Forza costante che imprime ad 1 Kg l’accelerazione di 1 m/s2 per lo
spostamento di 1 m nella direzione e nel senso della forza
1 kcal: 4,186 kJ;
1 kJ: 0,2388 kcal
CALORI DI COMBUSTIONE ED ENERGIA FORNITA
DALLE PRINCIPALI FONTI ALIMENTARI NELL’UOMO
Energia kcal/g (kJ/g)
Proteine
Lipidi
Carboidrati
Calore di
combustione
Ossidazione
nell’uomo
Fattori di
conversione
standard1
5,4 (22,6)
9,3 (38,9)
4,1 (17,2)
4,1 (17,2)2
9,3 (38,9)
4,1 (17,2)
4 (17)
9 (38)
4 (17)
1
I fattori di conversione sono ottenuti arrotondando i calori di combustione e correggendo i valori ottenuti con
la stima relativa all’efficienza di assorbimento.
L’ossidazione delle proteine è corretta tenendo conto delle perdite di gruppi amminici eliminati sotto forma
di urea con le urine.
2
FATTORI DA CUI DIPENDE LA SPESA ENERGETICA
Superficie corporea (altezza, peso), età (accrescimento, % fibra muscolare),
sesso
Metabolismo Basale (MB) = spesa energetica necessaria per alimentare le funzioni
biologiche di base in condizioni standard
Effetto termogenetico = spesa energetica legata alla digestione ed agli effetti biochimici
di stimolazione del metabolismo legati all’assunzione di nuovi substrati
Attività fisica
Temperatura dell’ambiente
METABOLISMO BASALE (MB)
Quantità di energia utilizzata da un individuo a riposo, a T.A. costante
(+20°C), a digiuno da 12-24 h, in condizioni di rilassamento fisico e
psicologico
Fattori che influenzano il METABOLISMO BASALE
(MB)
Età, sesso, composizione corporea, temperatura corporea, temperatura
ambientale, stato nutrizionale, situazione ormonale, assunzione di
farmaci
Termogenesi indotta dalla dieta (TID)
Incremento del dispendio energetico in risposta all’assunzione di
alimenti
Termogenesi obbligatoria: 75% (digestione, assorbimento, trasporto e
metabolismo). Varia in funzione della qualità dei nutrienti ingeriti
Termogenesi facoltativa: 25% (attivazione del sistema nervoso simpatico
mediata dall’insulina, dall’assunzione di sostanze tossiche)
Metodi di valutazione dello stato di nutrizione
Diretti:
• antropometrici (valutazione composizione corporea)
• biochimici
• clinici
Indiretti:
• rilevazione dei consumi alimentari
Metodi antropometrici
Peso, statura, circonferenza arti, grasso sottocutaneo
Metodi antropometrici: peso corporeo
BMI Body Mass Index o IMC Indice di Massa Corporea
Peso in Kg
(Statura in m)2
Indici biochimici
• Test chimico-clinici: glicemia, azotemia, colesterolemia,
trigliceridemia
• Bilanci metabolici: bilancio d’azoto
• Indicatori di nutrienti: transferrina, attività di enzimi
vitamino-dipendenti
FABBISOGNO DIETETICO GIORNALIERO RACCOMANDATO PER
UN APPORTO ENERGETICO OTTIMALE
Gruppi per età (anni)
e sesso
Neonati
0,0-0,5
0,5-1,0
Bambini
1-3
4-6
7-10
Maschi
11-14
15-18
19-22
23-50
51+
Femmine
11-14
15-18
19-22
23-50
51+
Gravidanza
1°trimestre
2°trimestre
3° trimestre
Allattamento
Peso (libbre;1 lb = ~
454 g)
Altezza (pollici;
1 in. ~ 2,5 cm)
Fabbisogno energetico
(kcal)
13
20
24
28
650
850
29
44
62
35
44
52
1300
1800
2000
99
145
160
174
170
62
69
70
70
68
2500
3000
2900
2900
2300
101
120
128
138
143
62
64
65
64
63
2200
2200
2200
2200
1900
+0
+300
+300
+500
BILANCIO ENERGETICO
• Se la quantità di energia introdotta con gli alimenti è in
eccesso rispetto ai bisogni, tale eccesso è accumulato
nell’organismo sottoforma di tessuto adiposo (acquisto di
peso)
• Se la quantità di energia introdotta è in difetto rispetto ai
bisogni, sarà il tessuto adiposo a fornire la quota mancante
(perdita di peso)
NUTRIENTI
Sostanze specifiche che devono essere assunte in quantità
sufficienti per soddisfare i fabbisogni dell’organismo
Nutrienti essenziali: non possono essere sintetizzati
dall’organismo
Nutrienti non essenziali: possono essere sintetizzati
dall’organismo
CATEGORIE DEI NUTRIENTI
• Acqua
• Carboidrati
• Proteine
• Lipidi
• Vitamine
• Minerali
ACQUA
Composto più diffuso in natura; costituisce circa il 70% del
peso corporeo.
Coinvolta in una serie di funzioni:
solvente per numerose sostanze chimiche
regola la temperatura corporea ed il volume cellulare
permette il trasporta di nutrienti e l’eliminazione di scorie metaboliche
favorisce i processi digestivi
è fonte di sali minerali
CARBOIDRATI
Risorsa energetica
• Età
• Crescita
• Specie
• Sesso
• Livello di attività
• Stato riproduttivo
• Condizioni di malattia
CARBOIDRATI
• Forniscono l’energia per la crescita, la riproduzione e altre
funzioni
• Costituiti da C, O e H
• Comprendono zuccheri semplici e complessi
• Contengono elevate quantità di fibre (importanti per la
digestione)
CARBOIDRATI
Monosaccaridi: singola unità poliossidrilica aldeidica o
chetonica
Oligosaccaridi: corte catene di unità monosaccaridiche
unite da legami glicosidici
Polisaccaridi: lunghe catene lineari o ramificate costituite
da centinaia o migliaia di unità monosaccaridiche unite da
legami glicosidici
MONOSACCARIDI
DIGESTIONE E ASSORBIMENTO DEI
CARBOIDRATI
Inizia nella bocca
- enzimi salivari e pancreatici
disaccaridi e trisaccaridi
- enzimi dell’orletto a spazzola
monosaccaridi
L’assorbimento dei monosaccaridi avviene attraverso
l’epitelio intestinale
DIGESTIONE ENZIMOLOGICA DEI
CARBOIDRATI
Solo alcuni tipi di carboidrati possono essere idrolizzati da enzimi
intestinali
• a-(1,4) glu-glu
• a-(1,2) glu-fru
• a-(1,6) glu-glu
• a-(1,4) gal-glu
amilosio, amilopectina, isomaltosio, maltosio
saccarosio
amilopectina (ramificazione)
lattosio
I prodotti finali assorbiti sono: glucosio, fruttosio e galattosio
AMILASI SALIVARE
L’a-amilasi salivare (endoamilasi). Taglia i legami a-(1,4
glicosidici) solo all’interno della catena. Viene inattivata nello
stomaco
Non è secreta nei gatti, cani, uccelli e cavalli
La b-amilasi (esoamilasi). Assente negli animali, presente nelle
piante e nei microrganismi
DIGESTIONE
Bocca – amilasi salivare : a-1,4 endoglicosidasi
G
G
G
G
G
G
G
G
G
G
Legame a 1-4
G
G
G
G
G
amilasi
Legame a 1-6
G
G
G
G
G
G adestrina
G G
G
G G
G G
G
limite
maltotrioso
G G
G
maltosio
G
G
isomaltosio
PICCOLO INTESTINO
Enzimi pancreatici
a-amilasi
maltotrioso
G G G
G G G G G
amilosio
G G
a-amilasi
G G G G G
G G G G G G
amilopectina
+
maltosio
G G G
G G G
a-destrine limite
DIGESTIONE DI OLIGOSACCARIDI
Maltasi
Lattasi
Saccarasi
G G G
a-destrina limite
G
glucosio
G G G
G G
G
maltasi
G
G G
glucoamilasi (maltasi)
o
a-destrinasi
a-destrinasi
G G G
G
G G G
G
G G G
G
ASSORBIMENTO DEI CARBOIDRATI
Il
glucosio
è
assorbito
dagli
enterociti
e
attraverso la vena
porta
viene
trasportato al fegato.
apicale
basolaterale
TRASPORTO DEI CARBOIDRATI
Trasporto degli esosi
negli enterociti
Esoso
Membrana apicale
Membrana
basolaterale
Glucosio
Trasportatore Na-dipendente
(trasporto attivo)
GLUT-2 (diffusione facilitata
secondo gradiente di
concentrazione)
Galattosio
Trasportatore Na-dipendente
(trasporto attivo)
GLUT-2 (diffusione facilitata
secondo gradiente di
concentrazione)
Fruttosio
GLUT-5 (diffusione facilitata
secondo gradiente di
concentrazione)
GLUT-2 (diffusione facilitata
secondo gradiente di
concentrazione)
Trasportatori di glucosio e fruttosio
Trasportatori
di glucosio
Localizzazione
Tipo di trasporto
GLUT-1
Muscolo, encefalo,
eritrociti
Trasporto facilitato (secondo
gradiente di concentrazione)
GLUT-2
Fegato
Trasporto facilitato (secondo
gradiente di concentrazione
GLUT-3
GLUT-4
Membrane dei neuroni
Muscolo, cuore, adipociti
Trasporto facilitato
Trasporto stimolato da insulina e
impulsi nervosi
Muscolo, adipociti,
spermatozoi
Trasporto facilitato (secondo
gradiente di concentrazione
Trasportatore
di fruttosio
GLUT-5
CARBOIDRATI
Fonte primaria di energia in tutte le cellule
Glucosio
Citosol - anaerobico
esochinasi
via del pentoso-fosfato
Glucosio-6-P
Glc-1- phosphate
glicolisi
Glicogeno
Piruvato
citosol
mitocondri
(aerobico)
Piruvato
Acetil CoA
Acidi grassi
Ciclo di Krebs
Equivalenti
riducenti
Amminoacidi
Fosforilazione ossidativa
(ATP)
No mitochondria
Glucose
Glycogen
Lactate
Glucose
Glucose
Glucose
The Full Monty
SINTESI DEL GLICOGENO
METABOLISMO DEI CARBOIDRATI
Utilizzo-Specificità tissutale
Muscolo-cardiaco e scheletrico
• Ossidazione del glucosio/Sintesi e conservazione del glicogeno
• Glicogenolisi
Tessuto adiposo e fegato
• Glucosio acetil CoA
• Glucosio a glicerolo per la sintesi dei trigliceridi
• Il fegato rilascia il glucosio per altri tessuti
Sistema nervoso
• Sempre glucosio
Ghiandola mammaria
• Lattosio
Globuli rossi
Assenza di mitocondri
• Ossidano il glucosio a lattato
• Il lattato ritorna al fegato per la gluconeogenesi
REGOLAZIONE DEI LIVELLI DI GLUCOSIO
NEL SANGUE
• Iperglicemia
• Ipoglicemia
Organi che controllano i livelli di glucosio nel sangue
Fegato
Pancreas (insulina e glucagone)
ORMONI COINVOLTI NELL’ OMEOSTASI
DEL GLUCOSIO
L’omeostasi del glucosio è un processo complesso che interessa
quattro ormoni essenziali:
1.
INSULINA
→
ipoglicemizzante
agisce
nella
normale
alimentazione.
2. GLUCAGONE → iperglicemizzante agisce in stato di digiuno.
3. CORTISOLO → agisce in situazioni di stress prolungato.
4. ADRENALINA → agisce in situazioni di stress improvviso.
Carboidrati
Glucosio
Glucosio
Glucosio
Glucosio
Fruttosio
Galattosio
Riserve di
glicogeno
Glicogenolisi
Gluconeogenesi
Lattato
Glucosio
Amminoacidi
Glucosio
Riserve di
glicogeno
Glicerolo
Riserve di
trigliceridi
Omeostasi del glucosio
Insulina e glucagone
iperglicemia
bassa glicemia
secrezione di ormoni gastroenterici
isole di Langerhans
cellule α (glucagone)
cellule β (insulina)
glucagone
insulina
Insulina
NH2
COOH
COO
NH2
S
S
S
S
catena A
catena B
ormone ipoglicemizzante
polipeptide di 51 aa (PM 5.808)
costituito da due catene lineari di aa, A e B, legate da due ponti disolfuro fra 4
molecole di cisteina, in posizione 7 e 20 nella catena A e 7 e 19 nella catena B.
un ponte disolfuro è disposto tra due molecole di cisteina in posizione 6 e 11
nella catena A
la catena A è composta da 21 aa, la catena B da 30 aa
Insulina
•
Ormone che influenza i livelli di glucosio ematico
•
Sintetizzata dalle cellule beta delle isole di Langerhans del
pancreas
•
Agisce attaverso recettori di membrana e i principali tessuti
bersaglio sono: fegato, muscolo e tessuto adiposo
•
Effetti dell’insulina opposti a quelli di glucagone, adrenalina,
glucocorticoidi e ormone della crescita.
Biosintesi dell’insulina: coinvolti due precursori inattivi la
pre-proinsulina e la proinsulina, che vengono scissi in tappe
successive, formando l’ormone attivo ed il peptide C
(indispensabile per il corretto ripiegamento della proinsulina).
L’emivita plasmatica dell’insulina è breve (~ 6 min.); ciò
permette la rapida variazione del livello
circolo.
dell’ormone in
Meccanismo di rilascio dell’insulina
Meccanismo d’azione dell’INSULINA
L’insulina si lega a specifici recettori presenti nella membrana
plasmatica delle cellule della maggior parte dei tessuti (fegato,
muscolo e t. adiposo).
Il legame dell’insulina è seguito dalla internalizzazione del
complesso ormone-recettore.
Una volta nella cellula, l’insulina è degradata dagli enzimi
lisosomiali. I recettori possono essere anch’essi degradati ma in
genere ritornano sulla superficie cellulare.
Trasporto di glucosio indotto dall’insulina
Il glucosio non ha la capacità di entrare nelle cellule liberamente, il suo passaggio
è legato alla presenza di una proteina trasportatrice per il trasporto facilitato. I due
più importanti trasportatori per il glucosio a livello delle cellule muscolari sono il
GLUT1 e il GLUT4. Il GLUT 4, nello stato basale, è presente in un deposito
intracellulare ed è richiamato sulla faccia esterna della membrana plasmatica in
presenza di insulina
Stimolo alla secrezione di insulina
Trasporto di glucosio mediato dall’insulina.
Trasduzione del segnale insulinico
Traslocazione del GLUT4 sulla membrana cellulare
Fattori che influenzano la secrezione di insulina
Glucosio ematico: con una normale glicemia la secrezione di insulina è bassa.
L’aumentare della glicemia è seguita da un aumento nella concentrazione di
insulina circolante (circa 10-30 volte).
Amminoacidi, acidi grassi: alcuni amminoacidi, tra cui l’Arg, stimolano la
secrezione di insulina. L’assunzione di un pasto ricco di proteine determina
l’aumento ematico dell’ormone. Stesso effetto da parte degli acidi grassi.
Ormoni gastrointestinali (GI): dopo un pasto la secretina e la gastrina inviano
segnali alle cellule del pancreas che il glucosio ematico aumenterà.
Sistema nervoso autonomo: l’attivazione dei neuroni parasimpatici che
proiettano alle isole, durante la digestione, determina un aumento di insulina
tramite la secrezione di acetilcolina. L’attivazione delle fibre simpatiche che
vanno alle isole o il rilascio di adrenalina dalla midollare del surrene, come
avviene in seguito ad una risposta allo stress, determina un’inibizione del
rilascio di insulina.
Ormoni insulari: il glucagone aumenta la secrezione di insulina stimolata dal
glucosio, mentre la somatostatina ne inibisce la secrezione.
L’insulina “accende” vie metaboliche e processi coinvolti nell’assunzione
cellulare e nell’immagazzinamento di combustibili metabolici e “spegne”
vie metaboliche che riguardano la demolizione di combustibili.
ORMONI IPERGLICEMIZZANTI
● GLUCAGONE: si attiva in situazioni di digiuno.
● ADRENALINA: si attiva in seguito a situazioni di stress.
● CORTISOLO: si attiva in situazioni di stress cronico legato a
trauma e malattia.
Glucagone
ormone iperglicemizzante
polipeptide di 29 amminoacidi (PM 3.485)
catena lineare che si avvolge su se stessa in modo casuale
biosintesi: formazione di pre-pro-glucagone (PM 18.000) da cui deriva, per
distacco di catene polipeptidiche, il pro-glucagone (PM 12.000) di 100 aa già
parzialmente attivo, da cui deriva l’ormone attivo
accumulato nelle cellule α in granuli secretori dai quali viene liberato per
esocitosi
emivita nel sangue circolante di ~ 6 min
GLUCAGONE
Agisce sul fegato, tessuto adiposo e muscolo.
AZIONE EPATICA: inibisce la sintesi di acidi grassi (inibisce la ACETIL CoA
CARBOSSILASI
acetil CoA in malonilCoA)
AZIONE SUL TESSUTO ADIPOSO: attiva le LIPASI
AZIONE A LIVELLO MUSCOLARE: liberazione di amminoacidi che vengono
deaminati e trasformati in chetoacidi. Nel muscolo la fonte primaria di
amminoacidi è rappresentata da actina e miosina: in caso di digiuni prolungati
viene persa massa muscolare.
Fattori che influenzano la secrezione di glucagone
glucosio ematico: una diminuzione della concentrazione ematica di glucosio stimola
la secrezione. Le concentrazioni di glucagone ematico sono più alte a digiuno e
tendono a diminuire dopo un pasto.
amminoacidi: stimolano la secrezione di glucagone.
acidi grassi: un aumento di acidi grassi circolanti inibisce la secrezione di
glucagone.
insulina: la glicemia elevata inibisce la secrezione di glucagone in presenza di
insulina. Se l’insulina è mancante, le cellule α non sono in grado di rilevare
l’aumento di glucosio ematico e i livelli di glucagone rimangono alti.
ormoni gastroenterici: gastrina e colecistochinina stimolano la produzione di
glucagone, mentre la secretina e la somatostatina la inibiscono.
sistema nervoso autonomo: l’innervazione ortosimpatica del pancreas e
un’aumentata concentrazione di catecolamine surrenali stimola la produzione di
glucagone.
Meccanismo d’azione del GLUCAGONE
Il glucagone si lega a specifici recettori presenti sulla
membrana plasmatica degli epatociti.
Il legame al recettore provoca l’attivazione dell’adenilato
ciclasi del cAMP (secondo messaggero) che, attivando la
proteina chinasi cAMP dipendente, fa la fosforilazione di
specifici enzimi del metabolismo dei carboidrati e dei lipidi.
Meccanismo d’azione del glucagone
glucagone
recettore
adenilato
ciclasi
β
γ
GDP
α
proteina G
citosol
GTP
α
GDP GTP
ATP
AMPc
subunità regolatrice
PKA
inattiva
cAMP
PKA attiva
ATP
ADP
fosforilasi chinasi
inattiva
fosforilasi chinasi –PO4
attiva
Ca2+
ATP
glucosio
sangue
glucosio -6-PO4
glicolisi e ciclo di Krebs
ADP
fosforilasi b
inattiva
fosforilasi a –PO4
attiva
glucosio -1-PO4
PO43-
glicogeno
CORTISOLO
Ormone steroideo, rilasciato dalla ghiandola surrenale.
Nel sangue è associato alla proteina CBP che lo veicola nel circolo
sanguigno.
Presenta dei recettori specifici nel nucleo; il sistema di trasmissione
del segnale avviene:
● CBP arriva sulla membrana;
● libera nel citosol l’ormone;
● il cortisolo incontra il suo recettore a livello nucleare.
ADRENALINA
Ormone stimolatorio per reazioni di stress rapido, agisce a livello:
➢ EPATICO: stimola la glicogenolisi e la liberazione nel sangue
di glucosio essenziale per la muscolatura.
➢ ADIPOSO
➢MUSCOLARE: provoca incremento del cAMP libero,
glicogenolisi
➢ PANCREATICO: stimola la secrezione di INSULINA
Iperglicemia
Aumento del tasso ematico di glucosio
Cause:
•
Eccesso di glucagone
•
Malattie autoimmuni che determinano la produzione di
anticorpi specifici contro l’insulina
•
Eccesso di insulinasi (enzima prodotto dal rene per
metabolizzare l’insulina)
•
Diabete mellito
Diabete mellito
Carenza di insulina dovuta ad un deficit pancreatico
Un calo dell’insulinemia deprime la capacità delle cellule di
assorbire glucosio dal sangue
Aumento del tasso glicemico
Parte del glucosio filtra attraverso il glomerulo renale nell’urina e
NON tutto è riassorbito dall’epitelio tubulare
Glicosuria
Test per la glicemia
Campione biologico richiesto: plasma o siero
Effettuare l’analisi in tempi brevi dopo il prelievo: le cellule
continuano i processi di glicolisi, pertanto i risultati saranno
invalidati
Test enzimatici
Test su singola goccia
Apparecchi automatizzati
Test enzimatici
•
Il principio su cui si basa la misura dei più comuni
glucometri validati per uso clinico consiste nella
quantificazione
di
una
reazione
enzimatica,
l’ossidazione del glucosio (proporzionale alla sua
concentrazione nel sangue).
•
La reazione avviene ponendo un campione di sangue su
una striscia reattiva alla glucosio-ossidasi.
•
La misura può essere ottenuta valutando l’intensità di
colore determinata dal cromogeno che si sviluppa
dall’ossidazione del glucosio.
Test su singola goccia
•
Una goccia di sangue intero viene deposta su carta bibula
•
Si determina una variazione di colore
Apparecchi automatizzati
Test di carico del glucosio
•
Animale a digiuno per 24 h.
•
Prelievo di un campione di sangue e determinazione della
glicemia.
•
Immediata somministrazione di glucosio per via orale (4 g/kg di
peso corporeo) oppure per via endovenosa (soluzione di glucosio
al 50% inoculata in ragione di 0,5 g/kg di peso corporeo).
•
Prelievi di sangue ad intervalli regolari (ogni 30-40 min) per 34h.
Incremento della glicemia
Somministrazione per os
Il tasso glicemico aumenta in modo notevole non appena il glucosio
viene assorbito in circolo dall’organismo.
Il picco della glicemia viene raggiunto nell’arco di 30-60 min.
Inoculazione per via endovenosa
L’incremento della glicemia compare più rapidamente dal momento
che il glucosio non deve essere assorbito dall’intestino.
Fisiologicamente
La glicemia inizia a diminuire per raggiungere, nel giro della II
ora, il livello che aveva prima di iniziare la prova.
Soggetto diabetico
Il tasso glicemico è superiore alla norma fino al termine della
prova.
PROTEINE
• Costituenti strutturali
• Enzimi
• Anticorpi
• Ormoni
PROTEINE
•
Essenziali per la crescita ed i processi riparativi
•
Indispensabili per i muscoli, organi interni, pelle,
capelli, lana, piumaggio, zoccoli, corna
•
Contengono C, H, O e N
•
Formate dalla combinazione di 20 amminoacidi, 9 dei
quali sono “essenziali”
Animali (carne, pesce, uova, latte)
Vegetali (tofu, pasta, pane, legumi, cereali, riso)
DIGESTIONE E ASSORBIMENTO
DELLE PROTEINE
Nell’uomo:
70-100 g di proteine assunte con gli alimenti
+
35-200 g di proteine endogene
digestione + assorbimento
feci
1-2 g di azoto 6-12 g di proteine
AMMINOACIDI ESSENZIALI E NON ESSENZIALI
Amminoacidi
essenziali
Amminoacidi non
essenziali
Arginina
Alanina
Istidina
Asparagina
Isoleucina
Aspartato
Leucina
Cisteina
Lisina
Glutammato
Metionina
Glutammina
Fenilalanina
Glicina
Treonina
Prolina
Triptofano
Serina
Valina
Tirosina
AMMINOACIDI ESSENZIALI IN ALCUNE SPECIE ANIMALI
Suino
Pulcino
Ratto
Arginina
si
si
si
Fenilalanina
si
si
si
Isoleucina
si
si
si
Istidina
si
si
si
Leucina
si
si
si
Lisina
si
si
si
Metionina
si
si
si
Tirosina
si
si
no
Treonina
si
si
si
Triptofano
si
si
si
Valina
si
si
si
Glicina
no
si
no
• Principale fonte di azoto per l’organismo
• Soggette ad un continuo processo di demolizione e sintesi
che va sotto il nome di turnover proteico
• Il turnover consente all’organismo di modulare la sintesi
delle proprie proteine in dipendenza dell’evolversi delle
sue esigenze
• In un uomo adulto le proteine corporee ammontano a
circa 10Kg; di questi giornalmente circa 250gr sono
soggetti a turnover
Flusso di amminoacidi in entrata:
• amminoacidi derivati dalla digestione delle proteine alimentari
• amminoacidi
organiche
derivati
dalla
degradazione
delle
proteine
Flusso di amminoacidi in uscita:
• amminoacidi avviati al catabolismo e alla produzione di urea
• amminoacidi indirizzati verso la biosintesi ex novo di proteine
corporee
CARATTERISTICHE DEL TURNOVER
PROTEICO
• tutte le proteine sono soggette a turnover
• avviene a velocità diversa per le diverse proteine
• regolato da fattori nutrizionali, ormonali
• varia nelle diverse specie animali in rapporto alla taglia
• varia per i diversi organi e tessuti
• nell’uomo la velocità del turnover diminuisce dalla
nascita all’età adulta
• richiede energia
TURNOVER PROTEICO
Proteine alimentari
Proteine corporee
Pool degli
amminoacidi
Pool di escrezione
PROTEINE
Complete o nobili
- forniscono amminoacidi essenziali e non
essenziali
- generalmente di origine animale
Incomplete o povere
- carenti in uno o più amminoacidi
- generalmente di origine vegetale
PROTEINE
• di origine animale
- contengono tutti gli amminoacidi in concentrazioni relativamente
elevate
• di origine vegetale
- di qualità inferiore per carenza di uno o più amminoacidi
Legumi: carenti in metionina
Cereali: carenti in lisina
DIGESTIONE E ASSORBIMENTO
DELLE PROTEINE
• Nello stomaco enzimi specifici scindono le proteine complesse in peptidi
• I peptidi vengono scissi in singoli amminoacidi grazie ad altri enzimi
nell’intestino tenue
• I singoli amminoacidi vengono assorbiti nell’intestino tenue e trasportati
al fegato
• Il fegato li risintetizza in proteine complesse utili per l’organismo o li
invia ai tessuti periferici per una sintesi proteica tissutale
• Solo in caso di prolungato digiuno essi vengono utilizzati come fonte di
energia
BIOSINTESI DI ENZIMI DIGESTIVI
Localizzazione: polisomi del reticolo endoplasmatico rugoso
Sequenza amminoacidica segnale all’N-terminale
•
•
Ancoraggio dei ribosomi alla membrana del reticolo
Rilascio della proteina sintetizzata all’interno delle cisterne del
reticolo
Processing delle proteine prima della secrezione
Accumulo delle proteine in piccole vescicole
Zimogeni: precursori inattivi
Granuli di zimogeno: esocitosi
Attivazione dei zimogeni
DIGESTIONE DELLE PROTEINE
Inizia nello stomaco ad
opera della pepsina, è
completata
dalle
proteasi intestinali dei
succhi pancreatici e da
quelle poste sull’orletto
a spazzola.
Le proteasi si dividono
in
endopeptidasi
esopeptidasi.
e
ENZIMI PROTEOLITICI = IDROLASI
ENDOPEPTIDASI
OLIGOPEPTIDI
endopeptidasi
PROTEINE
PEPTIDI
ESOPEPTIDASI
AMMINOACIDI –COOH terminali
o
AMMINOACIDI –NH2 terminali
esopeptidasi
AMMINOACIDI LIBERI
ASSORBIMENTO INTESTINALE
ENDOPEPTIDASI
Enzima
Origine
pH ottimale
Attivatore
Pepsina
Stomaco
1,5-2,5
HCl-Pepsina
Tripsina
Pancreas
esocrino
7,5-8,5
EndopeptidasiTripsina
Chimotripsina
Pancreas
esocrino
7,5-8,5
Tripsina
Elastasi
Pancreas
esocrino
7,5-8,5
Tripsina
ESOPEPTIDASI
Enzima
Presenza
pH ottimale
Attivatore
Carbossipeptidasi A
Pancreas
esocrino
pH del succo
intestinale
Tripsina
Carbossipeptidasi B
Pancreas
esocrino
pH del succo
intestinale
Tripsina
Aminopeptidasi
Mucosa
intestinale
pH del succo
intestinale
Dipeptidasi e
tripeptidasi
Mucosa
intestinale
pH del succo
intestinale
Peptidasi
intracellulari
Citoplasma
epitelio
intestinale
pH citosolico
FASE GASTRICA DELLA DIGESTIONE
DELLE PROTEINE
Nel succo gastrico:
1) pH < 2:
2) Pepsine:
1)
pH < 2
2)
proteasi: pepsine
morte dei microrganismi
denaturazione proteine
stabili e attive in ambiente acido
inattive a pH neutro
autocatalisi
Pepsinogeno
Pepsina A
rimozione 44 aa
all’NH2 terminale
Proteine
Pepsina A
Peptidi
stimolazione fase pancreatica colecistochinina (duodeno)
digestione proteine
FASE PANCREATICA DELLA
DIGESTIONE DELLE PROTEINE
Nel succo pancreatico:
- proenzimi precursori di endopeptidasi
- proenzimi precursori di carbossipeptidasi
endopeptidasi
Tripsinogeno
Tripsina
esapeptide N-terminale
Tripsina
Chimotripsina
Elastasi
Carbossi-peptidasi
AeB
Peptidasi gastriche e pancreatiche
Enzima
Proteasi carbossiliche
Pepsina A
Proenzima
Pepsinogeno A
Attivatore
Autoattivazione,
pepsina
Serina-proteasi
Tripsina
Tripsinogeno
Endopeptidasi,
tripsina
Chimotripsina
Chimotripsinogeno
Tripsina
Elastasi
Proelastasi
Tripsina
Zn-peptidasi
Carbossipeptidasi A
Procarbossipeptidasi A
Tripsina
Carbossipeptidasi B
Procarbossipeptidasi B
Tripsina
Reazione catalizzata
↓
R
↓ R
CO-NHCHCO-NHCHCO
R = tyr, phe, leu
R
↓ R
CO-NHCHCO-NHCHCO
R = arg, lys
R
↓ R
CO-NHCHCO-NHCHCO
R = tyr, trp, phe, met, leu
R
↓ R
CO-NHCHCO-NHCHCO
R = ala, gly, ser
↓
R
CO-NHCHCO2
R = val, leu, ile, ala
↓ R
CO-NHCHCO2
R = arg, lys
ENZIMI PROTEOLITICI DELL’APPARATO DIGERENTE
Sede e provenienza
dell’attività
enzimatica
Stomaco (ghiandole
del fondo)
Zimogeno
Pepsinogeno
Enzima attivo
Pepsina
Tipologia e
specificità di idrolisi
Endopeptidasi
Leu, aa aromatici
Tripsinogeno
Tripsina
Endopeptidasi
Lys, Arg
Chimotripsinogeno
Chimotripsina
aa aromatici, Leu, Met
Proelastasi
Elastasi
Gly, Ala, Val
Procarbossipeptidasi
Carbossipeptidasi A e B
Esopeptidasi
aa aromatici, Lys, Arg
Duodeno: enterociti
Enterochinasi
Endopeptidasi
specifica legame LysIle
Intestino tenue:
enterociti
Aminopeptidasi
Esopeptidasi
aa N-terminali
Duodeno: enzimi
pancreatici
Tripsina, chimotripsina ed elastasi
• attive solo a pH neutro
• dipendenti dalla produzione pancreatica di NaHCO3
• serin-proteasi
Carbossipeptidasi A e B
• prodotte nel pancreas, sono attive nell’intestino
• metallo-enzimi
• richiedono ioni Zn2+
Risultato della digestione pancreatica delle proteine
aa liberi
peptidi (2-8 aa)
ASSORBIMENTO DELLE PROTEINE
Assorbimento:
le
cellule
epiteliali intestinali assorbono
singoli amminoacidi, di- e tripeptidi.
I singoli aminoacidi: entrano
nella cellula intestinale mediante
co-trasporto facilitato con il Na+
e passano nel sangue per
diffusione facilitata.
I di- e tri-peptidi: entrano nella
cellula intestinale mediante
specifici trasportatori PEPT1 H+
dipendenti. I peptidi vengono
idrolizzati a singoli amminoacidi
dalle proteasi del citoplasma e
passano
nel
sangue
per
diffusione facilitata.
ASSORBIMENTO DELLE PROTEINE
L’assorbimento degli amminoacidi è rapido nel duodeno
e nel digiuno e lento nell’ileo e richiede l’intervento di un
trasportatore
Sembra esistere un unico trasportatore per gli
amminoacidi neutri (ala, ser), uno per quelli basici (arg,
lys), uno per gli acidi (glu, asp) ed uno per glicina,
prolina e idrossiprolina
CATABOLISMO DEGLI AMMINOACIDI
• Dopo l’assorbimento gli amminoacidi sono trasportati al
fegato attraverso il sistema portale
• Il fegato è il sito principale sia del metabolismo dello
scheletro carbonioso e sia dell’azoto, è l’organo più attivo
per la sintesi e per il catabolismo
• La maggior parte dell’azoto è rimosso dagli amminoacidi
tramite l’azione di enzimi epatici per ossidazione o
transaminazione
ESCREZIONE DELL’AZOTO
Metaboliti urinari
g/24 h
% totali
Urea
30
86
Ioni ammonio
0,7
2,8
Creatinina
1,0-1,8
4-5
Acido urico
0,6-1,0
2-3
REGOLAZIONE DEGLI AMMINOACIDI
Controllo ormonale del metabolismo degli amminoacidi
INSULINA
• favorisce la sintesi delle proteine
GLUCAGONE
• favorisce la degradazione delle proteine
• favorisce la gluconeogenesi
DESTINO DEGLI AMMINOACIDI
Chetogenici:
sono metabolizzati ad acetil-CoA
Glucogenici:
i metaboliti possono essere trasformati in glucosio attraverso la
gluconeogenesi
Glucogenici: Ala Arg Asn Asp Cys Gln Glu Gly
His Met Pro Ser Thr Val
Chetogenici: Leu Lys
Entrambi:
Ile
Phe Trp Tyr
VALUTAZIONE DELLA QUALITÀ
PROTEICA
Il valore proteico di un alimento dipende non solo dalla
quantità, ma anche dalla qualità delle proteine in esso
contenute
VALORE BIOLOGICO
E’ la stima della capacità della proteina di soddisfare le
necessità dell’organismo
VALORE BIOLOGICO DI ALCUNI ALIMENTI
Alimento
Valore biologico
Uova
Pesce
Manzo
Latte di vacca
100
70
69
60
Riso
Fagioli secchi
Grano
Arachidi
57
34
44
43
MALASSORBIMENTO DI PROTEINE
• Digestione incompleta = deficit di enzimi pancreatici
(pancreatiti)
• Malassorbimento/trasporto = deficit congenito di un
recettore per un gruppo di AA (celiachia)
MALNUTRIZIONE PROTEICO-ENERGETICA
• Alterazioni
derivanti
da
un’alimentazione
inadeguata
• Si tratta generalmente di sindromi policarenziali
Kwashiorkor: malnutrizione proteica
Marasma: malnutrizione energetica
KWASHIORKOR
• Ritardo nella crescita, depigmentazione dei capelli, desquamazione,
edema e fegato steatosico
• Mortalità del 30%
• Lesione biochimica: diminuzione della capacità di sintesi proteica
epatica
La carenza di aa porta ad una diminuita sintesi di albumina che nel
plasma funge da osmoregolatore, ciò porta ad un aumento del liquido
interstiziale e edema
Il
fegato
“grasso”
è
una
conseguenza
di
diminuita
sintesi
di
apolipoproteine il cui compito è di trasportare i grassi dal fegato ai
tessuti periferici
MARASMA
• Peso molto basso rispetto all’altezza, che è inferiore a quella
corrispondente all’età, aspetto grinzoso e carenza di grasso
sottocutaneo, addome teso e rigonfio
• Mortalità elevata
• Lesione biochimica: diminuita sintesi dell’albumina che
determina un aumento di produzione di cortisolo, che ha
un’azione catabolica sulle proteine muscolari che diventerebbero
disponibili per il fegato
LIPIDI
• Forniscono energia
• Servono come “carriers” per le vitamine liposolubili
• Formano colesterolo e steroidi
•
Costituiti da C, O e H, hanno maggiore quantità di C e
H rispetto ai carboidrati
•
Possono essere SATURI (solidi a T.A.) ed INSATURI
(generalmente liquidi)
ACIDI GRASSI
Gli insaturi possono essere:
• monoinsaturi
• polinsaturi
• acidi grassi omega-3
• idrogenati
(acidi
grassi
insaturi
che
sono
chimicamente modificati e trasformati in saturi)
TRIACILGLICEROLI O TRIGLICERIDI
Costituiti da 1 molecola di glicerolo a cui sono
legati 3 acidi grassi mediante legami esterei
Alimentazione:
98% trigliceridi - 2% fosfolipidi, colesterolo, glicolipidi
Secrezione nel lume del duodeno:
1-2 g di colesterolo
7-22 g di fosfatidilcolina (lecitina)
Difficoltà nella digestione dei lipidi
Insolubilità in ambiente acquoso dei lipidi
difficoltà di accesso agli enzimi digestivi
Tendenza all’aggregazione e formazione di complessi di grandi
dimensioni dei costituenti elementari prodotti
dall’idrolisi dei lipidi alimentari
difficoltà di assorbimento da parte delle cellule della mucosa intestinale
Superamento delle difficoltà
Aumento della superficie di contatto tra la fase acquosa e la fase lipidica
Solubilizzazione dei prodotti di idrolisi delle molecole lipidiche
per mezzo di detergenti
FASI DELLA DIGESTIONE E ASSORBIMENTO
DEI LIPIDI
• Idrolisi dei trigliceridi ad acidi grassi liberi e monoacilgliceroli
• Solubilizzazione degli acidi grassi liberi e dei monoacilgliceroli ad opera di
detergenti (acidi biliari) e loro trasporto dal lume intestinale
alla superficie delle cellule assorbenti
• Assunzione degli acidi grassi liberi e dei monoacilgliceroli da parte delle
cellule e resintesi dei trigliceridi
• Introduzione delle molecole neosintetizzate di trigliceridi in
micelle ricche di lipidi dette chilomicroni
• Esocitosi dei chilomicroni dalle cellule e loro immissione nella linfa
ACIDI BILIARI
• detergenti biologici sintetizzati nel fegato e secreti con
la bile nel duodeno
• si formano dal colesterolo
• a pH fisiologici si presentano come anioni
• veicolano le molecole lipidiche dal lume intestinale alla
superficie delle cellule assorbenti
FASE GASTRICA DELLA DIGESTIONE DEI LIPIDI
Nel succo gastrico: LIPASI GASTRICA acido-stabile (pH ottimale=4)
• secreta dalle ghiandole del fondo dello stomaco (nei roditori è
prodotta dalle ghiandole sublinguali)
• responsabile della digestione del 10-30% dei trigliceridi negli adulti
• molto importante per la digestione dei grassi nel lattante (alla nascita
la lipasi pancreatica è poco attiva). Indispensabile per la digestione dei
globuli di grasso del latte
FASE PANCREATICA DELLA DIGESTIONE
DEI LIPIDI
LIPASI PANCREATICA: pH ottimale = 7
inibita dagli acidi biliari, attivata dalla colipasi (proteina secreta
nel succo pancreatico)
LIPIDE o COLESTEROLO-ESTERASI:
attivata dagli acidi biliari meno specifica agisce sugli esteri del colesterolo,
monoacilgliceroli e sugli esteri lipidici
FOSFOLIPASI A2:
idrolizza specificatamente i fosfolipidi, attivata dagli acidi biliari
FASE INTESTINALE DELLA DIGESTIONE DEI LIPIDI
• Assorbimento mediante semplice diffusione attraverso la membrana
citoplasmatica delle cellule della mucosa dell’intestino tenue
Acidi grassi e monoacilgliceroli assorbimento completo
Colesterolo
30%-40% assorbimento
• Metabolizzazione dei lipidi non assorbiti da parte della flora batterica
• Escrezione con le feci (steatorrea)
DESTINO DEGLI ACIDI GRASSI NELLE
CELLULE INTESTINALI
1) Acidi grassi a catena media (6-10 C) flusso sanguigno fegato
2) Acidi grassi a catena lunga (> 12 C)
legame ad una specifica proteina citosolica
trasporto nel reticolo endoplasmatico
resintesi dei trigliceridi
associazione in chilomicroni
migrazione dall’apparato del Golgi alla membrana
citoplasmatica basolaterale
riversamento nello spazio extracellulare
sistema linfatico
tessuto adiposo muscolare
VIE DI ASSORBIMENTO DEGLI ACIDI GRASSI E
DEI MONOACILGLICEROLI
TRASPORTO DEI LIPIDI
Lipoproteine
Chilomicroni trasportano
dall’intestino tenue ai tessuti
trigliceridi
e
colesterolo
VLDL trasportano lipidi di natura endogena dal fegato ai
tessuti
LDL si formano dalla degradazione delle VLDL e si
arricchiscono di colesterolo e dei suoi esteri
HDL trasportano il colesterolo e gli esteri del colesterolo dai
tessuti al fegato
STRUTTURA MOLECOLARE DEI CHILOMICRONI
La superficie dei chilomicroni è rivestita da uno strato di fosfolipidi disposti con la
loro testa polare verso la fase acquosa. I trigliceridi sono raggruppati all’interno.
Sulla superficie sporgono le apolipoproteine che agiscono come segnali per il
metabolismo del contenuto dei chilomicroni.
CARATTERISTICHE DELLE LIPOPROTEINE
PLASMATICHE UMANE
CHILOMICRONI
VLDL
LDL
HDL
Peso molecolare
x 10-6
> 400
5-6
2,3
0,18-0,36
Densità (g cm-3)
< 1,006
0,951,006
1,0061,063
1,0631,210
Composizione chimica (%)
Triacilgliceroli
85
50
10
4
Colesterolo libero
1
7
8
2
Esteri del colesterolo
3
12
37
15
Fosfolipidi
9
18
20
24
Proteine
2
10
23
55
Assunzione dei lipidi della dieta nell’intestino degli animali e
trasporto degli acidi grassi al muscolo e al tessuto adiposo
SECREZIONE E RIASSORBIMENTO DEGLI
ACIDI BILIARI
Circolo entero-epatico degli acidi biliari
Mentre il riassorbimento
degli acidi grassi è completo a
circa metà del digiuno, i sali
biliari vengono riassorbiti a
livello dell’ileo.
I
sali
biliari
vengono
riassorbiti quando la loro
funzione è espletata. Gli acidi
biliari riassorbiti a livello
dell’ileo vengono poi rimossi
dal sangue portale dagli
epatociti.
METABOLISMO DEGLI ACIDI GRASSI
DESTINO DEL GLICEROLO
ATTIVAZIONE DEGLI ACIDI GRASSI
TRASPORTO DEGLI ACILI TRAMITE
CARNITINA
BETA-OSSIDAZIONE: TAPPA 1
BETA-OSSIDAZIONE: TAPPA 2
BETA-OSSIDAZIONE: TAPPA 3
BETA-OSSIDAZIONE: TAPPA FINALE
Resa energetica dell’ossidazione degli acidi grassi
Palmitoil-CoA (C16) + 7 CoA-SH + 7 FAD + 7 NAD+ + 7 H2O
7FADH2 + 7 NADH + 7H+
Reazione
Attivazione del palmitato a palmitoilCoA
8 Acetil-CoA +
Resa in ATP
2
-
Ossidazione di 8 molecole di acetilCoA
8 x 10 = 80
Ossidazione di 7 molecole di FADH2
7 x 1,5 = 10,5
Ossidazione di 7 molecole di NADH
7 x 2,5 = 17,5
Somma: 106 molecole di ATP
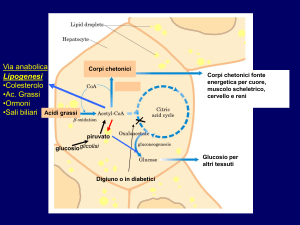
BIOSINTESI DEI CORPI
CHETONICI
SINTESI DEGLI ACIDI GRASSI
METABOLISMO DEGLI ACIDI GRASSI
SINTESI DEGLI ACIDI GRASSI: TAPPA INIZIALE
SINTESI DEGLI ACIDI GRASSI: I TAPPA
SINTESI DEGLI ACIDI GRASSI: II TAPPA
SINTESI DEGLI ACIDI GRASSI: III TAPPA
METABOLISMO DEGLI ACIDI GRASSI
BIODISPONIBILITA’
I nutrienti contenuti in un alimento non sono quasi mai
utilizzati completamente dall’organismo
La parte utilizzata viene definita quota biodisponibile
Fattori che influenzano la biodisponibilità
Digeribilità (caratteristiche chimico-fisiche del nutriente,
composizione della dieta, funzionalità gastro-intestinali,
disponibilità enzimatica)
Assorbimento (interazioni chimico-fisiche tra nutrienti,
funzionalità dell’enterocita, microflora intestinale)
Utilizzazione (stato fisiologico, stato nutrizionale, stato di
salute)