Cardiopatie Congenite
Definizione
• Le cardiopatie congenite sono malformazioni
anatomiche del cuore dovute ad un incompleto o
imperfetto sviluppo cardiaco durante la vita fetale
e per tale motivo presenti alla nascita.
• Hanno un ampio spettro di gravità, clinica e
terapeutica, che varia dal semplice difetto
interatriale alle forme congenite complesse.
Epidemiologia
• Le cardiopatie congenite hanno una incidenza
dell’8 per mille nati vivi
• In età pediatrica le cardiopatie congenite sono
molto più frequenti delle forme acquisite
Etiologia
•
•
•
•
fattori genetici
10%
aberrazioni cromosomiche
5%
fattori ambientali.
10%
Nel rimanente 75% non vi è una causa specifica e
quindi si parla di ereditarietà multifattoriale.
Anomalie cromosomiche +
frequentemente associate a CC
• Trisomia 21 (S. di Down) 56%: CAV, DIV, TdF,
VDDU
• Trisomia 18 (S. di Edwards) 90%: DIV, VDDU,
TdF, CoAo
• Trisomia 13 (S. di Patau) 90%: DIV, CAV, HLHS,
VDDU
• Monosomia X (S. di Turner) 15-20% CoAo,
Bicuspidia Aortica
Fattori Ambientali
• Diabete Mellito, Fenilchetonuria (TGA, CMPI )
• Malattie autoimmuni (LES, S. Sjogren-miocarditi,
aritmie)
• Infezioni virali
– Virus rosolia (sordità catatratta PDA stenosi polmonari)
– Virus varicella
– CMV, Parvovirus, Coxsackie virus ( miocarditi)
• esposizioni raggi X
• assunzione farmaci teratogeni
• sali di litio, anticonvulsivanti, alcool, Warfarin, anfetamine,
stupefacenti,etc etc
Circolazione fetale
Cuore normale
Saturazione O2 nelle
camere cardiache e nei
grossi vasi->shunt
Pressione
(sistolica/diastolica/media)
nelle camere cardiache e nei
grossi vasi->shunt
•
•
•
•
Cardiopatie non-cianogene con shunt sn-dx
Cardiopatie non-cianogene senza shunt
Cardiopatie Congenite Cianogene
Cardiopatie Congenite dotto-dipendenti
Cardiopatie non-cianogene con shunt sn-dx
• Shunt a livello Atriale
– Difetti del setto interatriale
– Ritorno venoso polmonare anomalo parziale
• Shunt a livello Ventricolare
– Difetti del setto interventricolare
• Shunt a livello Atrio-Ventricolare
– Difetti del setto atrio-ventricolare (Canale AV)
• Shunt Radice aortica-Ventricolo dx Fistola coronarica
ALCAPA
• Shunt aortopolmonare ( finestra Ao-Po, PDB)
Cardiopatie non-cianogene senza shunt
Malformazioni del cuore sinistro
– Ostruzioni Atrio sn
•
•
•
•
Stenosi delle Vene Polmonari
Cor triatriatum
Membrana sopravalvolare mitralica
Stenosi mitralica
– Rigurgito valvola mitrale
•
•
•
•
CAV
TGV congenitamente corretta
ALCAPA
Miscellanea (DOMV, Cleft isolato valvola mitrale)
Cardiopatie non-cianogene senza shunt
Malformazioni del cuore sinistro
– Stenosi aortica
• (sotto valvolare, valvolare, sopra valvolare)
– Insufficienza v. aortica
– Coartazione aortica-interruzione arco aortico
Cardiopatie non-cianogene senza shunt
Malformazioni del cuore destro
– anomalia di Ebstein a-cianotica
– Stenosi polmonare
• (infundibolare, valvolare, sopravalvolare)
– Insufficienza v. polmonare
– Dilatazione idiopatica del tronco polmonare
Cardiopatie Congenite Cianogene
Con Iperafflusso polmonare
–
–
–
–
–
–
–
–
Trasposizione delle Grandi Arterie
Ventricolo destro a doppia uscita
Truncus arteriosus
Ritorno Venoso Polmonare Anomalo Totale
Cuore univentricolare senza stenosi polmonare
Atrio comune
Tetralogia di Fallot con atresia polmonare e MAPCA’s
Atresia v tricuspide con DIV ampio, assenza di St
Polmonare
– Cuore sinistro ipoplasico
Cardiopatie Congenite Cianogene
Con flusso polmonare normale o ridotto
–
–
–
–
–
–
–
–
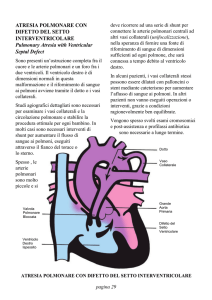
Atresia della tricuspide
Anomalia di Ebstein shunt destro-sinistro
Atresia polmonare a setto intatto
Stenosi o Atresia polmonare con DIV
Stenosi v polmonare con shunt sn-dx
TGA con stenosi polmonare
Fistola A-V polmonare
Comunicazione vena cava con Atrio sn ( unroofed CS,
VCSn in atrio sn)
Cardiopatie Congenite dotto-dipendenti
• Dotto dipendenza sistemica
– Ipoplasia del cuore sinistro
– Interruzione dell’arco aortico
– Coartazione istmica severa dell’aorta
– Severa stenosi valvolare aortica
• Dotto dipendenza polmonare
– Atresia polmonare o stenosi valvolare severa a setto
intatto o con difetto interventricolare
– Cardiopatie complesse con stenosi severa o
ostruzione all’efflusso polmonare
– (Trasposizione delle Grandi Arterie)
Cardiopatie Congenite dotto-dipendenti
La Dotto dipendenza è una condizione che si
realizza in quelle cardiopatie congenite che
presentano severa ostruzione all’efflusso (destro o
sinistro) e che pertanto necessitano della pervietà
del dotto di Botallo per mantenere un flusso di
sangue nel distretto interessato.
Lo Scompenso Cardiaco
in Età Pediatrica
Sindrome
clinica
caratterizzata
dall’incapacità
del
cuore
di
soddisfare le necessità metaboliche
• Scompenso Cardiaco Cronico
• Scompenso Cardiaco Acuto
–primo episodio
–peggioramento di SC Cronico
Scompenso Cardiaco Cronico
• Lenta progressione e/o stabilità emodinamica della
cardiopatia
• Quadro clinico di diversa gravità secondo lo stadio
evolutivo
• I meccanismi di autoregolazione + terapia medica
inizialmente stabilizzano lo SC
• Con il tempo diventano inefficaci e responsabili del
peggioramento del quadro clinico
Scompenso Cardiaco Acuto
• Esordio di grave cardiopatia (insufficienza
valvolare acuta da endocardite infettiva, crisi
ipertensiva, miocardite acuta virale)
• I meccanismi di compenso non diventano efficaci
per la rapidità del quadro clinico
Scompenso Cardiaco Acuto
• Peggioramento della cardiopatia di base al punto
che i meccanismi di compenso sono insufficienti e
inefficaci o addirittura sfavorevoli
• Comparsa di fattori precipitanti che alterano
l’equilibrio raggiunto nello scompenso cronico.
MECCANISMI FISIOPATOLOGICI
• FUNZIONE DIASTOLICA
(es: fibrosi miocardica, tachiaritmie,
cardiopatia ipertrofica)
• POSTCARICO-sovraccarico di
pressione (es: stenosi valvolare aortica,
coartazione aortica, crisi ipertensiva)
CONTRATTILITA’(es: miocarditi virali,
cardiomiopatie)
• PRECARICO-sovraccarico di volume (es: Shunt sndx,
insufficienza valvolare, fistole artero-venose, anemia)
• COMBINAZIONE di tutti questi
elementi
• DILATAZIONE VENTRICOLARE
utilizzo del meccanismo di FrankStarling: pressione telediastolica
•C
I
R
MECCANISMI DI COMPENSO
stress di parete e consumo
di O2 (VO2)
IPERTROFIA VENTRICOLARE
risposta ad aumentato postcarico evoluzione verso la
dilatazione
• ATTIVITA’ ADRENERGICA
– contrattilità, FC, portata cardiaca,
redistribuzione portata cardiaca, postcarico,
VO2 miocardico
CIRCOLO RENALE
attivazione sistema renina-angiotensina-aldosterone, ritenzione idrica.
La riserva cardiaca del cuore del neonato
e’ ridotta rispetta a quella del bambino
Friedman WF, Congenital Heart disease in Infancy and Childhood. In Heart
Disease. Braunwald E, ed. Philadelphia: WB Saunders, 1997, 889-895
• RISERVA DIASTOLICA: qualsiasi
aumento di riempimento ventricolare o di
precarico determina un aumento
sproporzionato dello stress di parete
• RISERVA SISTOLICA: il cuore neonatale in
condizione di riposo, lavora vicino alla capacità
massima di performance sistolica.
• RISERVA DI FC: la frequenza cardiaca di base è alta, qualsiasi
aumento porta ad del VO2 piuttosto che della portata cardiaca, e
accorciamento della diastole con alterata perfusione coronarica.
Scompenso Cardiaco
SHOCK CARDIOGENO
•Bassa portata sistemica
•Insufficienza respiratoria
•Insufficienza renale
•Alterazione equilibrio acido-base
Cause di Scompenso Cardiaco in
Età Pediatrica
Lattante - Bambino
•
•
•
•
•
•
•
Cardiomiopatia metabolica
Cardiomiopatia da accumulo
Miocardite (virale, batterica)
Malattia di Kawasaki
Malformazioni arterovenose congenite
Ipertensione polmonare secondaria
Tireotossicosi
•
•
•
•
•
Cardiopatie congenite shunt sndx
Coartazione aortica
Cardiopatie congenite operate
Tachicardia sopraventricolare
ALPACA
Bambino - Adolescente
•
•
•
•
•
•
•
•
•
•
Crisi ipertensiva sistemica
Endocardite infettiva
Emocromatosi-emosiderosi
Cardiopatia da antracicline
Ipertensione polmonare primitiva o secondaria
Cardiopatie congenite operate
Cardiopatie congenite in storia naturale
Malattia Reumatica
Cardiomiopatia dilatativa idiopatica
Miocardite
Cause precipitanti lo scompenso
cardiaco in età pediatrica
•
•
•
•
Inappropriata assunzione di farmaci
Crisi ipertensive
Anemizzazione
Tireotossicosi
•
•
•
•
•
Infezioni sistemiche (polmonari)
Tachiaritmie
Disidratazione
Sovraccarico di liquidi
compliance terapeutica
3-minute examination
(O’Laughlin MP. Congestive Hearth Failure in Children. Pediatric
Clinics of North-America, 1999; 46: 263273.)
•
•
•
•
Palpazione dell’addome (epatomegalia)
Palpazione del precordio
Polsi arteriosi periferici
Ascoltazione cardiaca e polmonare
•
•
•
•
•
1 minuto per frequenza respiratoria
Colore del paziente
Diaforesi
Refill capillare < 2 sec
Edema periferico
Bassa Portata Sistemica Insufficienza Vsn
•
•
•
•
•
•
Ridotto accrescimento
Sudorazione intensa
Marezzatura periferica con refill capillare>1 sec
Tachicardia
Ritmo di galoppo, T3.
Polso arterioso iposfigmico
Segni di Congestione Polmonare
•
•
•
•
•
•
Tachipnea.
Tosse
Utilizzo dei muscoli respiratori accessori
Fischi e sibili
Rantoli
Cianosi
Segni di Congestione Venosa Sistemica
•
•
•
•
Epatomegalia
Ascite
Edema periferico
Turgore delle vene giugulari
Lattante - Segni clinici
•
•
•
•
•
•
•
Difficoltà nell’alimentazione
Ridotto accrescimento
Bambino ipotonico
Cute pallida, cianotica o grigio-cenere
Marezzatura periferica
sudorazione profusa
Oliguria
•
•
•
•
•
•
•
Polipnea (>60 r/min)
Sibili e rantoli polmonari
Tachicardia sinusale (>160-180 bpm)
Ritmo di galoppo (T3 )
Soffio cardiaco
Polsi arteriosi periferici iposfigmici
Epatomegalia
Bambini e Adolescenti-Segni clinici
•
•
•
•
•
•
•
•
•
•
•
•
•
Ridotta tolleranza allo sforzo
Dispnea da sforzo
Edema periferico
sudorazione profusa
Oliguria
Polipnea (>40 r/min)
Sibili e rantoli polmonari
Tachicardia sinusale(>100 bpm)
Ritmo di galoppo (T3 )
Soffio cardiaco
Polsi arteriosi periferici iposfigmici
Epatomegalia
Ascite
OBBIETTIVI DELLA TERAPIA DELLO
SCOMPENSO CARDIACO
• CONGESTIONE VENOSA SISTEMICA
• CONGESTIONE VENOSA POLMONARE
• MIGLIORARE LA CONTRATTILITA’
• RISOLVERE LA CAUSA DI SCOMPENSO
Sommario
• Lo SC nei neonati e lattanti è nella maggioranza
dei casi secondario a cardiopatie correggibili
chirurgicamente.
• La diagnosi di cardiomiopatia idiopatica è una
diagnosi per esclusione.
Sommario
• I primi esami diagnostici sono:
– Emocromo e urine completo, glicemia,
calcemia, elettroliti sierici (NA, K, Mg),
creatininemia,
– ECG, RX torace,
– l’esame strumentale fondamentale è l’
ecocardiografia doppler transtoracica
Sommario
• Nei neonati-lattanti l’ O2 è sconsigliato sino a
quando non si è ottenuto una diagnosi anatomica
certa (O2 favorisce la chiusura del DB, bisogna
escludere dotto dipendenze sistemiche e
polmonari)
• Tachiaritmie incessanti presenti per > 10% della
giornata sono causa di dilatazione cardiaca e
scompenso.
Sommario
• Il diuretico è il primo farmaco da utilizzare nello
scompenso cardiaco secondario a cardiopatie
congenite con shunt sn->dx
• O2 può iperafflusso per l’effetto vasodilatatore
sul circolo polmonare
• Nello SC con ostruzione all’efflusso sinistro,
(dotto-dipendenza sistemica) si somministrano
PGE1 per mantenere il dotto aperto. No O2.
Sommario
• La digitale nel bambino e lattante è indicata solo
se vi sono iniziali segni di scompenso
• ACE-Inibitori
– utili in tutte le situazioni con resistenze
periferiche
– controindicati nel caso di resistenze polmonari
– Tutti i vasodilatatori sono controindicati nella S.
di Eisenmenger in storia naturale
Esami Strumentali
Saturimetro transcutaneo (FC e SatO2)
ECG standard
Teleradiogramma Cardiaco
Ecocardiogramma TT/TE
Cateterismo cardiaco
Angiografia
ECG
Ritmo
frequenza cardiaca
FC>160 bpm = tachicardia sinusale
FC> 230 bpm= tachicardia sopraventricolare
FC< 60 bpm = bradicardia
Ripolarizzazione ventricolare
Ecocardiogramma color Doppler
trans-toracico
•Rapida diagnosi della cardiopatia di base,
•Fornisce elementi utili per la strategia
terapeutica (medica e/o chirurgica) da adottare
nella fase acuta
•Follow Up
Ecocardiogramma color Doppler
trans-toracico
Teleradiogramma del torace
•Parenchima polmonare
•Circolazione polmonare
•Ombra Cardiaca
Cateterismo Cardiaco/Angiografia
• Diagnostico
– Cardiopatie congenite complesse
– Definizione morfologica e funzionale per
Cardiochirurgia
– Follow up cardiopatie congenite complesse s/p
intervento cardiochirurgico
• Intervenzionale
– Urgenza
– Elezione
Laboratorio di Emodinamica
Dispositivi per incannulare l’arteria
Cateteri diagnostici coronarici
Cateteri diagnostici per arteriografie
LEFT VENTRICULAR PRESSURE
Mezzo di contrasto
Indicazioni/Controindicazioni alla coronarografia
Quadri Clinici
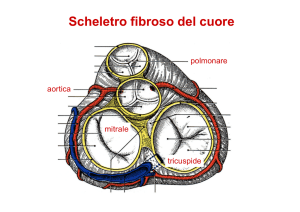
Difetto del Setto Interatriale
•
•
Soluzione di continuità SIA
15% delle CC > 1 anno di età
1. Ostium Secundum (PVM)
2. Ostium Primum (Cleft
valv.mitrale)
3. Seno venoso Superiore e
Inferiore (RVPAP)
4. Seno coronarico (Unroofed CS)
3
Difetto del Setto Interatriale
fisiopatologia
• Shunt sinistro->destro
– Sovraccarico di volume del
ventricolo destro
– Iperafflusso Polmonare
(QP/QS>1,5)
• Comportamento Letto
Vascolare Polmonare
– Ipertensione Polmonare
tardiva e poco frequente
Difetto del Setto Interatriale clinica
• T2 sdoppiato, fisso con respiro
• Soffio sistolico eiettivo in area
polmonare
• Soffio diastolico tricuspidale
• Soffio sistolico mitralico (cleft)
• Se Ipertensione Polmonare:
– T2 polmonare ↑
– Soffio diastolico rig. Polmonare
• Adulto
– Fibrillazione Atriale
– Insufficienza Tricuspidale
Difetto del Setto Interatriale -ECG
•
•
•
•
RS
AQRS +60 e +120°
Ritardo di conduzione IVdx
ST ↓livellamento isodifasico
• DIA ostium primum:
– AQRS -30 -90°
– Impegno Atrio sn
Difetto del Setto Interatriale TeleRx
• ↑ vascolarizzazione
polmonare
• Dilatazione tronco
polmonare e rami
principali
• O.C. aumentata (atrio e
Ventricolo dx)
Difetto del Setto Interatriale EcoTT
•
•
•
•
Anatomia e posizione DIA
Dilatazione Atrio e Vdx
Dilatazione Tronco e arterie polmonari
Movimento anomalo del SIV da sovraccarico di
volume
• PVdx derivata se Insufficienza tricuspidale
• Calcolo QP/QS con PW doppler
Difetto del Setto Interatriale Decorso e
Prognosi
• DIA II
– Spesso asintomatico e diagnosi tardiva (adulti) per FA,
scompenso cardiaco, ipertensione polmonare
– Embolie paradosse
• DIA I
– Se insufficienza mitralica diagnosi precoce
– Aritmie sopraventricolari
– Endocardite infettiva
• DIA seno venoso e seno coronarico diagnosi precoce
Difetto del Setto Interatriale
Terapia
• Se piccolo-medio , Qp/Qs< 1,5 nessuna terapia
• Se Qp/Qs>1,5 chiusura in età prescolare ( 4-5
anni):
– Percutanea con disco occludente nei DIA II con
anatomia idonea
– Chirurgica nei DIA II con anatomia non idonea, molto
ampi e negli altri tipi di DIA
Difetto del Setto Interventricolare (DIV)
• Comunicazione tra i due ventricoli per incompleta
formazione delle componenti del SIV
• 28% CC nel 1° anno di vita
• Frequente nei pz S. Down
Difetto del Setto Interventricolare (DIV)
anatomia patologica
• Difetti perimembranosi
– Estensione Setto posteriore
– Estensione sottoartica
– Associati a IAO da prolasso
cuspide aortica
• Difetti muscolari
–
–
–
–
Trabecolo-apicale
Efflusso
Sottopolmonare
multipli
Difetto del Setto Interventricolare
DIV piccolo calibro
• Shunt sn->dx non
significativo
• Asintomatico
• Soffio olosistolico 4/6L
• Soffio diastolico da
rigurgito aortico ( se IAO)
Difetto del Setto Interventricolare
DIV medio calibro
• Shunt sn-dx con gradiente
Vsn-Vdx > 70-80 mmHg
• ↑ della portata polmonare
• Sovraccarico di volume
biventricolare
• ↓tolleranza allo sforzo
• Soffio protomesosistolico
• T3
Difetto del Setto Interventricolare
DIV ampio
•
•
•
•
Assenza di gradiente Vsn-Vdx
Shunt bidirezionale
Iperafflusso polmonare
Evoluzione verso ipertensione
polmonare postcapillare e
precapillare
• Scompenso cardiaco
• T3, T2 sdoppiato
• Soffio sistolico eiettivo polmonare
Difetto del Setto Interventricolare (DIV)
ascoltazione
Difetto del Setto Interventricolare (DIV)
ECG
• EAS nei DIV inlet
• Ipertrofia biventricolare (RS
V3 e V4)
• Sovraccarico destro se IP
Difetto del Setto Interventricolare (DIV)
TeleRx
•
•
•
•
•
DIV medi ampi
Iperafflusso polmonare
Arterie Polmonari ↑
↑ OC
Eisenmenger ↓ flusso
polmonare
Difetto del Setto Interventricolare (DIV)
emodinamica e angiografia
Difetto del Setto Interventricolare (DIV)
decorso e prognosi
• DIV piccoli chiusura spontanea
• DIV medi
– evoluzione verso riduzione calibro, possibile comparsa di
insufficienza aortica da prolasso cuspide coronarica destra o
non coronaria
– Ventricolo destro bicamerato
• DIV ampio
– Scompenso cardiaco entro primi mesi di vita
– Storia naturale->evoluzione veso S. di Eisenmenger
Difetto del Setto Interventricolare (DIV)
Terapia
• Profilassi antibiotica EI nei DIV restrittivi
• ACE-I e diuretico nei medi e chiusura chirurgica
se dilatazione Vsn, IAo, Vdx bicamerato
• Terapia anti-scompenso nei DIV ampi e nei DIV
multipli e successiva cardiochirurgia ( peso >6
kg)
• Chiusura percutanea in casi selezionati (muscolari
e perimembranosi)
Canale Atrio-Ventricolare (CAV)
•
•
•
•
•
•
•
3/5% CC, frequente trisomia 21
DIA tipo ostium primum
Valvola Atrio-Ventricolare unica
Difetto interventricolare posteriore (inlet)
Radice aortica anteriore e destroposta
CAV parziale, intermedio,completo
CAV completo A, B e C (classificazione di Rastelli)
Canale Atrio-Ventricolare (CAV)
Canale Atrio-Ventricolare (CAV)
•
•
•
•
Ampio shunt sinistra-destra
Pressione Vdx circa = Vsn
Iperafflusso polmonare
Scompenso cardiaco peggiorato dal grado di
insufficienza valvola AV e PDA
• Evoluzione verso Ipertensione Polmonare
Canale Atrio-Ventricolare (CAV)
•
•
•
•
•
Scarso accrescimento ponderale e S.C. primi mesi
Cianosi se inversione shunt
Soffio da insufficienza valvola A-V
T3
Soffio sistolico polmonare
Canale Atrio-Ventricolare (CAV)
ECG
• PR allungato
• Estrema deviazione
sinistra AQRS (-90 -120°)
• Ipertrofia biventricolare
Canale Atrio-Ventricolare (CAV)
TeleRx
• Iperafflusso polmonare
• Ombra Cardiaca aumentata
• Se Ipertensione polmonare precapillare
ipoafflusso polmonare
Canale Atrio-Ventricolare (CAV)
EcoTT
•
•
•
•
DIA I
DIV inlet
Assenza di crux
Valvola AV comune, morfologia lembi, posizione
e numero muscoli papillari e insufficienza
• Inserzione del lembo anteriore ( Cresta SIV,
Parete dx SIV, Parete libera Vdx)
Canale Atrio-Ventricolare (CAV)
Decorso, Prognosi e terapia
• Scompenso cardiaco, e morte primo –secondo
anno di vita
• Terapia medica SC ( ACE-I, diuretico, digitale)
• Intervento palliativo di bendaggio polmonare nel
basso peso (spesso prematuri)
• Intervento correttivo entro i primi sei mesi di vita
(pc>6 kg)
Canale Atrio-Ventricolare (CAV)
Pervietà Dotto Arterioso di Botallo
• Persistenza di comunicazione aortopolmonare
attraverso dotto arterioso
• 10-15% CC
• Varia morfologia in genere ampulla duttale ampia
e versante polmonare diametro inferiore
• Nell’adulto dilatazione aneurismatica,
calcificazione
• Endocardite Infettiva 1-5%
Pervietà Dotto Arterioso di Botallo
• Asintomatico-SC
• Polso arterioso ampio e celere
• ↑Pressione Arteriosa
differenziale
• Soffio continuo sisto-diastolico
(A)
• Componente diastolica
accorciata se moderata IP (B)
• Soffio sistolico eiettivo e
diastolico da rigurgito se IP
elevata
Pervietà Dotto Arterioso di Botallo
• Ipertrofia e sovraccarico
sinistro
Pervietà Dotto Arterioso di Botallo
TeleRx
• Iperafflusso polmonare
• OC aumentata da
sovraccarico di volume
Atrio e Ventricolo sinistro
Pervietà Dotto Arterioso di Botallo
fisiopatologia
•
•
•
•
Chiusura entro prime 10-15 ore
↑pO2 e ↓PGE fetale fattori favorenti
Nascita prematura aumenta % di PDA
A secondo diametro shunt sn-dx aortopolmonare
– Iperafflusso polmonare
– Dilatazione Atrio e Ventriclo sn
• Se ipertensione polmonare ->Eisenmenger
Pervietà Dotto Arterioso di Botallo
Pervietà Dotto Arterioso di Botallo
terapia
• Terapia SC
• Se PDA prematuro->chiusura farmacologica, se
inefficace legatura chirurgica
• Se PDA in bambino > 6 kg e anatomia idonea
chiusra percutanea con spirale o disco occludente
Sindrome di Eisenmenger
Pulmonary Artery Hypertension
“Is defined as a group of disease
characterized by a progressive increase of
pulmonary vascular resistance leading to
right ventricular failure and premature
death”
Galiè N et al. Clinical Classification of Pulmonary Hypertension. JACC 2004;
PAH-Hemodynamics
Mean Pulmonary Artery Pressure
rest ≥ 25 mmHg
stress ≥ 30 mmHg
Capillary Wedge Pressure
< 15 mmHg
Pulmonary Artery Resistance
> 3 Woods Unit
Rich et al . NIH criteria for Pulmonary Hypertension. Ann Intern Med 1987
Classification of Congenital
systemic-to-pulmonary shunts – Venice 2003
1. Type
Simple
Atrial septal defect
Ventricular septal defect
Patent ductus arterious
Total or partial unobstructed anomalous pulmonary venous return Combined
Describe combination and define prevalent defect if any
Complex
Truncus arteriosus
Single ventricle with unobstructed pulmonary blood flow
Atrioventricular septal defects
2. Dimensions
Small (ASD ≤2.0 cm and VSD ≤ 1.0 cm)
Large (ASD >2.0 cm and VSD >1.0 cm)
3. Associated extracardiac abnormalities
4. Correction status
Noncorrected
Partially corrected (age)
Corrected: spontaneously or surgically (age)
APAH Congenital systemic-to-pulmonary shunts
Clinical Features large left to right shunt
If PVR does not fall pts remain oligo-asymptomatyc for
many years:
•Mild fatigue
•Shortness of breath with exercise
Evolution toward Eisenmenger Syndrome
Eisenmenger Syndrome
definition
“… pulmonary hypertension at the systemic
level , due to a high pulmonary vascular
resistance (over 800 dynes sec/cm-5), with
reversed or bidirectional shunt through a
large venticular septal defect (1,5 to 3 cm
across)…”
Paul Wood. The Eisenmenger Syndrome or pulmonary hypertension
with reversed central shunt. Br Med J 1958
PAH and pulmonary vascular disease/
Eisenmenger Syndrome
Paul Wood. Br Med J 1958
PDA large >7 mm
VSD large (15-30 mm)
ASD large (30-80 mm)
50%
50%
9%
Steele P. Circulation 1987
Truncus Arteriosus
VSD large
ASD large
100%
50%
10%
Vogel M. Heart 1999
ASD II
ASD SV type
4%
16%
APAH Congenital systemic-to-pulmonary shunts
Pathophysiology post-natal and neonatal period VSD/PDA/AVC
Large Interventricular communication
Systolic RV and PAP = SAP
Large aortopulmonary communication
Systolic/diastolic PAP=SAP
Delayed maturation Pulmonary arteries
•SMC thins slowly
•Slow fall Pulmonary Vascular Resistance (3-4 months)
•PVR 2.4 fold normal but Pulmonary Blood flow mantained
•Systolic PAP elevated because large size communication
Mechanism
•High pressure mechanically stimulates SMC growth
•Endothelium alterations (shear stress)
In premature these mechanism are accelerated and less tolerated
Rudolph AM. Congenital Disease of the Heart:
clinical-physiological considerations 2000, 2nd ed.
APAH Congenital systemic-to-pulmonary shunts
Factors associated delayed pulmonary arterioles maturations
1. Large sytemic-pulmonary communications
2. Altitude
3. Pulmonary blood flow
These factors have additive effect
if contemporary present
Rudolph AM. Congenital Disease of the Heart:
clinical-physiological considerations 2000, 2nd ed.
Sindrome di Eisenmenger
•
•
•
•
•
Cianosi severa
Classe NYHA 3-4
Poliglobulia
Ipertensione polmonare severa
Segni e sintomi dello scompenso destro cronico
Coartazione Istmica Aortica
• 8% CC, maschi>femmine
• Restringimento a livello Istmo Aortico ( cercine
posteriore, diffuso)
• Anomalia dell’arteria succlavia sinistra o destra
• Associata a Bicuspidia aortica ( 80%)
• SSAo
• VDDU, TGA, Atresia Tr, Displasia mitralica
• Dottodipendenza sistemica in età neonatale
Coartazione Istmica Aortica
Coartazione Istmica Aortica
• Estensione di tessuto duttale >50% istmo aortico
• Ipoplasia istmo accentuata per ridotto flusso in Ao
ascendente
• Ipertensione arteriosa
– ↑resistenza Ao asc
– ↓perfusione renale
– Aumento massa Vsn
Coartazione Istmica Aortica
• Neonato
– Segni di bassa portata 7/10 gta di vita
•
•
•
•
Bambino ipotonico
Ridotta diuresi
Ipo-asfigmia polsi arteriosi femorali
Acidosi metabolica
Diagnosi Precoce
Coartazione Istmica Aortica
• Adulto
–
–
–
–
Aspetto fisico normale o con torace sviluppato
Iposfigmia polsi arteriosi femorali
Pulsazioni arterie intercostali (circolo collaterale)
Click eiezione aortico
Coartazione Istmica Aortica
• ECG: Ipertrofia Vsn
• Telecuore:
– Ectasia aorta ascendente, e del bottone aortico
– Esofago baritato (LL) Impronta caratteristica esofago
• EcoTT: IVsn, Valvola aortica bicuspide, ectasia
aorta ascendente, coartazione istmica, gradiente
transistmico medio>20 mmHg con componente
diastolica
Coartazione Istmica Aortica
decorso e prognosi
• A seconda gravità scompenso nelle prime
settimane o anno di vita
• Negli adolescenti-adulti
–
–
–
–
–
Ipertensione arteriosa sistemica
Rischio di dissezione aortica
Endocardite infettiva
Emorragia cerebrale (ipertensione)
Scompenso cardiaco
Coartazione Istmica Aortica
Terapia
• Neonato->PGE1, stabilizzato il piccolo pz
intervento cardiochirurgico di coartectomia
• Lattante-> follow up stretto, terapia x
ipertensione, dopo 1 anno di vita PTA
• Adulto PTA con stent, terapia anti-ipertensiva
• La cardiochirurgico nell’adulto gravata da
complicanze secondaria a ischemia midollare
(paraplegia)
Coartazione Istmica Aortica
Coartazione Istmica Aortica
• Risonanza Magnetica
Tetralogia di Fallot
1. Stenosi infundibolo-valvolare polmonare e a volte
sopravalvolare
2. Difetto interventricolare da deviazione anteriore del
setto infundibolare
3. Aorta destroposta e a cavaliere SIV
4. Ipertrofia Ventricolare destra
–
–
Morfologia varia da moderata stenosi polmonare a atresia
polmonare con DIV
Collaterali Aorto-Polmonare maggiori (MAPCA’s)
Tetralogia di Fallot
Tetralogia di Fallot
• Quadro clinico a seconda stenosi polmonare
• Cianosi neonatale grave, dotto dipendenza
polmonare (Atresia polmonare)
• Cianosi con soffio sistolico eiettivo, crisi
ipossiche da spasmo infundibolare
• Squatting (infante)
Tetralogia di Fallot
• Soffio eiettivo polmonare
• T2 unico
Tetralogia di Fallot
Tetralogia di Fallot
Tetralogia di Fallot
Tetralogia di Fallot
Terapia
• PGE1 se forma grave (stenosi serrata o atresia)
• Correzione cardiochirurgica
– Palliativa
• Shunt sistemico -polmonare (BT shunt)
– Correttivo ( peso >6 kg)
• Transatriale resezione infundibolare
• Patch transanulare
• Plastica Tronco e arteria polmonare sn
Tetralogia di Fallot
Shunt sistemico-polmonare
Blalock-Taussig modificato
condotto di Gore Tex 3-4 mm di
diametro interposto tra arteria
succlavia e arteria polmonare
Trasposizione delle Grandi Arterie
• Discordanza ventricolo-arteriosa
– Aorta nasce da ventricolo destro
– Tronco Polmonare nasce da ventricolo sinistro
• Anomalie associate
– DIV
– Stenosi polmonare
– Anomalie coronariche
Trasposizione delle Grandi Arterie
Trasposizione delle Grandi Arterie
• Si realizza circolo in parallelo
– Il sangue ossigenato dalle Vene Polmonari ritorna in arteria
polmonare e Polmone
– Il sangue venoso proveniente dalle vene cave circola in Aorta e
periferia sistemica
• Comunicazione interatriale permette mescolamento di
sangue venoso e arterioso e stabilità emodinamica
• Mescolamento aiutato da DIV e Dotto di Botallo
Trasposizione delle Grandi Arterie
• Cianosi neonatale
– Severa se Stenosi Polmonare
– Lieve se DIV ampio
• Segni di scompenso (Tachicardia, galoppo, FR >60/min)
• ECG: IVdx
• Telecuore: Iperafflusso polmonare, ombra cardiaca a
“uovo”
• Ecocardiogramma diagnostico
Trasposizione delle Grandi Arterie
Trasposizione delle Grandi Arterie
• Terapia
– PGE1
– Settostomia atriale percutanea
– Intervento cardiochirurgico 10-20 gg di vita->Switch
Arterioso con reimpianto delle coronarie
– Se Stenosi polmonare o anomalia coronarica:
intervento 20-30 gg di switch atriale (Mustard,
Senning)
Cardiopatie Congenite Dotto
dipendenti
Cardiopatie Congenite
dotto-dipendenti: necessità di PGE alla nascita
Coartazione Ao
Atresia V. Pol.
TGA
Ipoplasia Vsn
Prostaglandine PGE1
Indicato nelle cardiopatie congenite dotto-dipendenti
Dilatazione e mantenimento della pervietà del dotto
arterioso
Vasodilatazione circolo polmonare
Vasodilatazione circolo sistemico
PGE1-somministrazione
Dose iniziale 0.05-0.1 µg/kg/min dopo 2-3 ore se
della SatO2 e normalizzazione del pH ridurre
gradualmente a 0.005-0.002 µg/kg/min.
vena o arteria ombelicale o v. periferica
Durante la somministrazione di PGE1 è
consigliabile il monitoraggio invasivo della PA
Se ipotensione somministrazione liquidi e inotropi
Controindicata nelle cianosi respiratorie
PGE1-effetti collaterali
Depressione respiratoria ->Apnea
Ipotensione sistemica
Flushing
Febbre (effetto centrale su ipotalamo)
Irritabilità
Diarrea
IpoCa
ridotta funzione piastrinica (DIC - emorragia)
Terapia
Intervenzionale/Cardiochirurgica
Cardiologia interventistica urgente
• Settostomia atriale percutanea con palloncino
nelle cardiopatie con necessità di ampia
comunicazione interatriale
• Valvuloplastica polmonare o aortica con
palloncino per severa stenosi neonatale
• Perforazione e angioplastica percutanea di Atresia
Polmonare a Setto Intatto
Cardiopatie che necessitano di
Settostomia Atriale percutanea con
palloncino (Rashkind)
• Trasposizione delle Grandi Arterie
• Atresia della valvola tricuspide
• Atresia polmonare a setto intatto
• M. di Ebstein (DIA restrittivo)
Settostomia Atriale con Palloncino
-tecnica di Rashkind-
Valvuloplastica Percutanea con
Palloncino
Devices
Cardiochirurgia in età neonatale
• Palliativa (temporanea): shunt sistemicopolmonare, bendaggio polmonare
• Correttiva: Legatura dotto di Botallo,
Coartectomia, ricostruzione arco
aortico,“Switch” arterioso, Correzione di
ritorno venoso anomalo polmonare totale
Procedura
•
•
•
•
•
•
•
•
•
•
•
•
Anestesia generale
Arteria femorale destra (7 F)
Passaggio guida attraverso la coartazione in via retrograda
Aortografia con PT AP e LL
Diametri arco aortico a livello succlavia, istmo, aorta discendente a
livello diaframma
Guida da cambio
Introduttore Mullins 13 F
Posizionamento sistema Pallone-Stent in zona coartata
Angiografia di controllo
Se necessario dilatazione stent con pallone di maggiore diametro
Controllo angiografico finale
Rimozione introduttore per via chirurgica
BIB Balloon
A.M. 16 aa Agio-RM aortica
AoAsc
AoDisc
A.M. 16 aa Angio pre-PTA
A.M. 16 aa Angio post Stent
Coartazione Istmica Aortica
angiografia pre-PTA
Coartazione Istmica Aortica
angiografia post-PTA e Stent
A che età chiudere il DIA II?
• La tendenza è la chiusura del DIA nell’infanzia o
nell’adolescenza
• DIA emodinamicamente significativi possono
richiedere una chiusura anticipata
Quanto piu’ precoce è la chiusura percutanea, tanto
migliore è la prognosi a distanza.
Requisiti Anatomici
• Bordi ben rappresentati soprattutto
l’inferiore, il posteriore e il superiore
• 2-5 mm adulto, 7 mm in età pediatrica
• relativa importanza ha il margine anteriore in
corrispondenza del torus aorticus (radice aortica).
• Vi è indicazione chirurgica se la misura
del device da utilizzare supera la
lunghezza del setto interatriale misurato
in 4-camere apicale
• (diametro eco del DIA + 12 o 14 mm per ASO o
diametro del DIA moltiplicato per 1,8 nel caso di
CS)
DIA II
3D echocardiogram
TT-Echo
TE-Echo
Procedura
• In età pediatrica (anestesia generale sempre).
• In età adulta ecocardiogramma intracardiaco (AcuNav™ Acuson
Siemens) in anestesia locale.
• VFdx 7F, VFsn 11 F
• Eparinizzazione.
• Studio emodinamico basale
• Guida dedicata in vena polmonare superiore sinistra
• Diametro forzato con pallone AGA (24 o 34 mm)
• Scelta disco (ASO-AGA; CardioSEAL STARFlex NMT).
• Rilascio della protesi
• Rimozione introduttori.
• Anticoagulazione per 24 ore con eparina sodica ev o eparina a basso
peso molecolare 100 UI/kg
• Antiaggregante per sei mesi.
ASD Amplatzer
DIA II #1
DIA II #1
DIA II #2
DIA tipo Ostium Secundum
ASD Amplatzer ecocardiografia
intracardiaca con Acunav™
The AcuNav™ (Acuson Siemens) ultrasound
diagnostic Catheter
from AcuNav Users Manual
Ecocardiografia Intracardiaca
ACuNav™
• Vantaggi
– Evita anestesia Generale nei pazienti adulti
• Maggior comfort per il pz
• Riduce i tempi di occupazione sala
– Una maggiore definizione anatomica del setto interatriale,
particolarmente utile nei DIA II multipli
– Meno preciso nei setti interatriali aneurismatici
• Limitazioni
– Le dimensioni del catetere non permette l’utilizzo nel
bambino
– Costo
Pervietà del Foramen Ovale (PFO)
• Il Foramen Ovale, costituito dal limbus del septum
secundum e dalla membrana del foramen ovale, è
pervio durante tutta la vita fetale; esso consente il
fisiologico shunt dx-sn
• Alla nascita l’aumento delle pressioni sinistre,
determina la chiusura funzionale del FO. La chiusura
definitiva avviene entro il primo anno di vita
• Una PFO rappresenta una potenziale via per il
passaggio di emboli paradossi
Pervietà del Foramen Ovale
anatomia
CardioSEAL STARflex
PFO
Pervietà Dotto Arterioso di Botallo
• Persistenza di comunicazione aortopolmonare
attraverso dotto arerioso
• 10-15% CC
• Varia morfologia in genere ampulla duttale ampia
e versante polmonare diametro inferiore
• Nell’adulto dilatazione aneurismatica,
calcificazione
• Endocardite Infettiva 1-5%
PDA Amplatzer
Flipper Cook
Rashkind e angio
Settostomia Atriale Rashkind
Valvuloplastica Polmonare
Difetto del Setto Interventricolare (DIV)
• Comunicazione tra i due ventricoli per incompleta
formazione delle componenti del SIV
• 28% CC nel 1° anno di vita
• Frequente nei pz S. Down
Difetto del Setto Interventricolare (DIV)
anatomia patologica
• Difetti perimembranosi
– Estensione Setto posteriore
– Estensione sottoartica
– Associati a IAO da prolasso
cuspide aortica
• Difetti muscolari
–
–
–
–
Trabecolo-apicale
Efflusso
Sottopolmonare
multipli
DIV perimembranoso
DIV perimembranoso