-Parte Seconda-
1
Reazioni chimiche
ENDOERGONICHE
Le reazioni endoergoniche sono
quelle reazioni che per avvenire
necessitano di energia.
ESOERGONICHE
Le reazione esoergoniche all’
opposto invece quando
avvengono liberano energia.
Potenziale di ossidoriduzione
Il potenziale di ossidoriduzione è l’unità di misura
dell’energia libera di reazione delle varie sostanze.
2
IL ruolo dell’ ATP e la catena respiratoria.
La molecola di ATP quando si forma immagazzina molta energia
che rilascerà in seguito, quando per esempio, dovrà attivare un
trasportatore.
La catena respiratoria invece è caratterizzata da altre sostanze
che sono: un neuclotide piridinico (NAD), una flavoproteina, il
coenzima Q e più citocromi. Questa catena irreversibile che
avviene nella membrana interna dei mitocondri libera energia ad
ogni suo stadio e può essere inibita solo dalla presenza di ioni CN-.
E’ da sottolineare che l’ATP è stettamente legato alla respirazione
infatti se la pianta deve effettuare un trasporto attivo
aumenterà la respirazione per incrementare la produzione di ATP.
3
Catalizzatori ed enzimi
I catalizzatori, come anche gli enzimi, sono quelle sostanze che
aiutano una reazione ad avvenire cioè abbassano il livello di
energia necessaria per svolgerla.
Riassumendo, quindi, gli enzimi hanno le seguenti funzioni:
1.
Abbassano l’energia di attivazione.
2.
Essendo di natura proteica hanno un’elevata specificità.
3.
Oltre ad accelerare le reazioni cellulari le controllano e le
sincronizzano.
4
Energia di attivazione: intervento dei catalizzatori
Per svolgere una reazione abbastanza velocemente le molecole
devono essere in uno stato attivato. Le molecole vengono
principalmente attivate da un innalzamento di temperatura ma ciò
non può essere effettuato per le molecole biologiche le quali
vengono attivate dai catalizzatori.
5
Cinetica delle reazioni enzimatiche.
Per velocità di una reazione enzimatica si intende la quantità di
substrato trasformato nell’ unità di tempo.
In genere la velocità delle reazioni enzimatiche diminuisce con il
passare del tempo come anche la quantità di substrato
trasformato.
In generale le reazioni enzimatiche possono essere influenzate dai
seguenti fattori:
1.
Concentrazione dell’ enzima.
2.
Concentrazione del substrato.
3.
Temperatura
4.
Ph
5.
Presenza di cofattori enzimatici
6.
Presenza di inibitori
6
1- Concentrazione dell’enzima.
La quantità di substrato trasformato è proporzionale alla
concentrazione dell’enzima.
Quindi la concentrazione dell’enzima è direttamente proporzionale
alla quantità di prodotto formato.
E’ importante sottolineare, però, che in base alla quantità di
enzima si otterranno prodotti diversi.
7
2- Concentrazione del substrato.
La velocità di una reazione enzimatica aumenta proporzionalmente
all’aumento della concentrazione del substrato solo per un breve
tratto fino ad un limite massimo detta velocità massima.
Ciò si spiega per 2 motivi:
Il primo, è che una volta saturato tutto l’enzima la velocità
diminuisce esponenzialmente non essendoci più catalizzatori.
Il secondo, è che, se il substrato è minore dell’enzima
una parte di quest’ultimo rimarrà non saturato non potendo
sviluppare così la velocità massima .
8
3- Temperatura
Ogni enzima ha una temperatura ottimale per poter svolgere
regolarmente le sue funzioni.
Generalmente la temperatura ottimale è quella che permette
l’equilibrio fra i processi di attivazione1 e quelli di denaturazione2
dell’enzima.
La temperatura può comunque modificare:
La stabilità dell’enzima.
L’affinità dell’enzima per il substrato
L’affinità dell’enzima con attivatori e/o inibitori
1: E’ quell’ azione che, tramite determinate sostanze, permette all’enzima di essere attivato cioè di poter svolgere le
proprie funzioni.
2: E’ quell’ azione che, tramite determinate sostanze, permette all’enzima di essere denaturato cioè di ritornare allo
stadio precedente di quello attivato rendendolo riutilizzabile (previa attivazione) successivamente.
9
4- Ph
Ogni enzima ha un ph ottimale che gli permette di svolgere al
meglio le sue funzioni.
Generalmente il ph può influenzare:
La velocità di denaturazione dell’enzima.
il substrato.
i centri attivi dell’enzima.
10
Peresenza di cofattori enzimatici.
Alcuni enzimi per poter svolgere le loro funzioni hanno bisogno
dell’ausilio dei cofattori. Questi possono essere ioni metallici o una
molecola organica detta coenzima. Essi svolgono molte funzioni tra
cui: favorire la formazione del complesso enzima-substrato o
modificare la conformazione dell’enzima.
I coenzimi si possono dividere in 2 classi:
Trasportatori di idrogeno o elettroni
Trasportatori di gruppi
11
Presenza di inibitori.
Gli inibitori sono quegli agenti che aggiunti al substrato rallentano
la velocità della reazione catalizzata dall’enzima. L’inibizione può
essere: irreversibile o reversibile.
Nel primo caso usa il termine di inattivatori.
Nel secondo caso, invece, l’allontanamento degli inibitori porta ad
una riattivazione dell’ attività del sistema.
Inibizione competitiva
Inibizione non competitiva
In questo tipo di competizione
In questo caso l’inibitore può
il substrato e l’inibitore compefissarsi al complesso enzimatono nel legarsi all’enzima.
substrato o all’enzima (in un
Gli inibitori competitivi sono
punto diverso dal sito riservato
sostanze simili al substrato,
al substrato). In entrambi i casi
aumentando la concentrazione
i complessi sono inattivi, inoltre,
di quest’ultimo l’effetto dell’
un aumento della concentrazione
inibitore viene ridotto.
del substrato non rimuoverebbe
l’inibizione
12
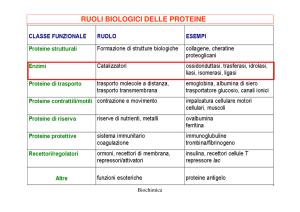
Classificazione degli enzimi
Gli enzimi sono stati classificati dalla Commissione sugli Enzimi
dell’Unione Internazionale di Biochimica in sei classi:
1. Ossidoreduttasi: enzimi che catalizzano reazioni di ossidoriduzione.
2. Transferasi: enzimi che catalizzano reazioni di trasferimento
di gruppi.
3. Idrolasi: enzimi che catalizzano processi idrolitici.
4. Liasi: enzimi che catalizzano la scissione o la formazione di
legami C-C, C-O, C-N, C-S.
5. Isomerasi: enzimi che catalizzano reazioni di isomerizzazione
6. Sintetasi o Ligasi: enzimi che catalizzano la formazione di un
legame tra due molecole accoppiata alla scissione di ATP.
13
Gli enzimi allosterici.
Partendo dal principio che gli enzimi che svolgono funzioni generali
all’interno della pianta agiscono tutti con un ritardo di tempo è
facile dedurre che sia necessaria la presenza di enzimi che
“rispondano” immediatamente agli stimoli.
Questi enzimi sono detti enzimi allosterici.
La loro caratteristica principale è la loro capacità di essere attivati o
inibiti da sostanze che non hanno somiglianze con il substrato
enzimatico: queste sostanze sono chiamate: effettori allosterici.
Un enzima allosterico per aumentare il suo effetto ha due siti di
attacco: i siti allosterici e i siti catalitici:
14