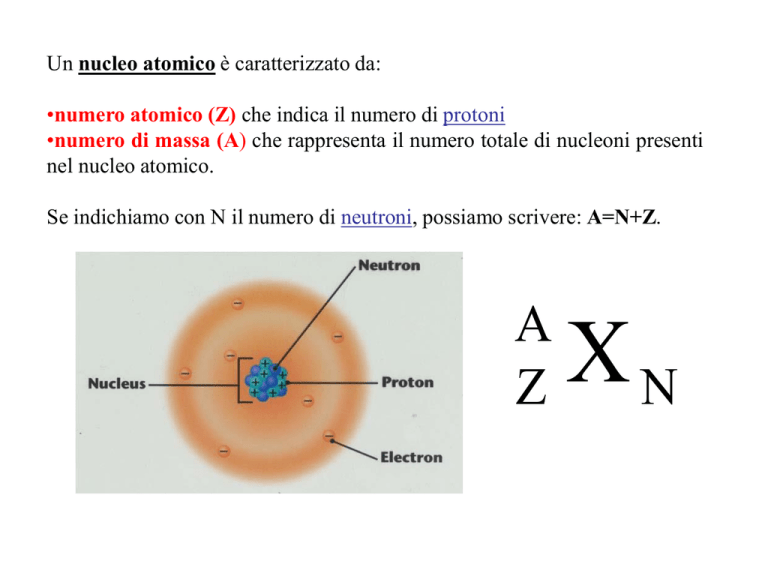
Un nucleo atomico è caratterizzato da:
•numero atomico (Z) che indica il numero di protoni
•numero di massa (A) che rappresenta il numero totale di nucleoni presenti
nel nucleo atomico.
Se indichiamo con N il numero di neutroni, possiamo scrivere: A=N+Z.
A
Z
XN
Notazione simbolica per gli
elementi chimici
•N.ro di Massa
A
c
carica
X
•N.ro Atomico
Z
•X è il simbolo dell’elemento chimico.
•Il numero atomico Z è _______________
•Il numero di massa A è _______________
Nuclidi
• Simbolo dell’elemento X, numero di massa
A e numero atomico Z.
Il simbolo nel suo complesso indica quello
che in fisica nucleare è definito nuclide.
A
Z
X
Esercizio 1
• Determinare il
–numero di protoni
–numero di neutroni
–numero di elettroni
–numero atomico
–numero di massa
19
9
F
Esercizio 2
Determinare
il
– numero di protoni
– numero di neutroni
– numero di elettroni
– numero atomico
– numero di massa
80
35
Br
Esercizio 3
Se
un elemento chimico è
caratterizzato da un numero atomico
34 ed un numero di massa 78
determinare:
– Numero di protoni
– Numero di neutroni
– Numero di nucleoni
– Simbolo del nuclide
Esercizio 4
Se
un elemento chimico contiene 91
protoni e 140 neutroni, determinare:
– Numero di massa
– Numero atomico
– Numero di elettroni
– Simbolo del nuclide
Esercizio 5
Se
un elemento chimico contiene 78
elettroni e 117 neutroni, determinare:
– Numero di massa
– Numero atomico
– Numero di protoni
– Simbolo del nuclide
• ISOBARI
Nuclidi con eguale numero di massa A
• ISOTOPI
Nuclidi con eguale numero atomico Z
• ISOTONI
Nuclidi con eguale numero di neutroni N
Esempio di Isobari
131
131
I
Xe
Isobars
Z
N
53
54
78
77
A
131
131
Esempio di Isotoni
130
131
I
Xe
Isotones
Z
N
53
54
77
77
A
130
131
Isotopi
Sono isotopi due o più forme di uno stesso elemento
stesso numero atomico [Z], ma con diverso numero di
massa [A].
Ovvero: stesso numero di protoni, ma diverso numero di
neutroni.
Gli isotopi di un dato elemento presentano
tutti le stesse caratteristiche chimiche, anche se
possono essere:
fisicamente stabili (non radioattivi)
oppure
instabili (radioattivi).
Esempio di isotopi
gli isotopi dell'idrogeno sono:
l'idrogeno comune (1H) che ha 1 p (Z=1) e 0 n
(A=1) ed è il più abbondante in natura;
il deuterio (2H) che ha 1 p (Z=1) e 1 n (A=2) ed è
presente in natura anche se raro (lo 0.8%
dell'idrogeno naturale);
il trizio (3H) che ha 1 p (Z=1) e 2 n (A=3), esiste
solo perché prodotto artificialmente ed è
fisicamente instabile.
Esercizi: sul Tottola, pag 109 n. 43, 44, 45,46
Come si misura la Massa di
un Atomo?
• L’unità di misura è l’Unità di Massa Atomica
(a.m.u.)
• 1 a.m.u. corrisponde ad 1/12 della massa di un
atomo di Carbonio-12.
• poichè ciascun isotopo ha la propria massa
atomica, se vogliamo la massa di un elemento
dobbiamo considerare il suo valore medio
tenendo conto delle abbondanze relative di
ciascun isotopo (media ponderata)
Esercizio 7
Calcolare la massa atomica del rame,
sapendo che il rame ha due isotopi, dei
quali
• il 69.1% ha una massa pari a 62.93
a.m.u. ed
• il rimanente ha una massa di 64.93 a.m.u.
Esercizio 8
• Il Magnesio ha 3 isotopi.
• Il 78.99% magnesio - 24 con una massa di
23.9850 amu,
• Il 10.00% magnesio - 25 con una massa di
24.9858 amu, ed
• Il resto magnesio - 26 con una massa di 25.9826
amu.
Qual è la massa atomica del magnesio?
N.B. se non detto esplicitamente, il numero di
massa dell’isotopo corrisponde sempre al valore
intero della massa dell’isotopo espressa in a.m.u.
Spettrometro di Massa
Isotopi naturali
• È noto che molti elementi, a eccezione di
berillio, alluminio, fosforo e sodio, sono
costituiti nel loro stato naturale da una miscela
di due o più isotopi. Il peso atomico di un
elemento è allora la media ponderata dei pesi
atomici dei singoli isotopi.
• Tutti gli isotopi degli elementi che hanno peso
atomico maggiore di 83, e che si trovano oltre il
bismuto nella tavola periodica, sono radioattivi,
mentre gli isotopi più leggeri sono, nella
maggior parte dei casi, stabili.
• Globalmente si conoscono circa 280 isotopi
naturali stabili.
Isotopi artificiali
• Gli isotopi radioattivi artificiali, noti come
radioisotopi, furono prodotti per la prima
volta nel 1933 dai fisici francesi Irène e
Frédéric Joliot-Curie.
• Possono essere preparati in acceleratori
di particelle, bombardando i nuclei degli
atomi stabili con particelle nucleari come
neutroni, elettroni, protoni e particelle .
il nucleo è fatto di
protoni (p), carichi positivamente,
e neutroni (n), privi di carica
Ma i protoni e i neutroni sonole particelle
fondamentali?
I fisici hanno scoperto che i protoni e i neutroni
sono composti di
particelle ancora più piccole, chiamate quark
Per quanto ne sappiamo fino ad ora, i
quark non sono
fatti di nient’altro: sono
FONDAMENTALI
Dopo molti esperimenti gli scienziati ora
credono che
i quark e gli elettroni (e qualche altra
particella) siano fondamentali
I fisici hanno sviluppato una teoria chiamata Modello Standard
che spiega di cosa il mondo è fatto e cosa lo tiene assieme
Il Modello Standard spiega tutte le centinaia di particelle e le
complesse interazioni che le legano con una semplice ricetta:
6 quark (che formano le particelle più pesanti, tra cui protone
e neutrone)
+
6 leptoni (particelle più leggere, tra cui l’elettrone)
+
Particelle che trasportano le forze ( fotoni, bosoni nucleoni )
Quark
La maggior parte della materia che ci circonda è fatta
di protoni e neutroni, che sono composti di quark
Ci sono sei quark, raggruppati in tre coppie:
up/down (su/giù), charm/strange (incanto/strano) e
top/bottom (cima/fondo)
I quark hanno carica elettrica frazionaria
Il quark più misterioso, il quark top, fu scoperto
nel 1995, mentre la sua esistenza era stata
teorizzata venti anni prima!
i quark si combinano
in modo da formare particelle (chiamate adroni) con carica
elettrica intera
Ci sono due tipi di adroni:
Barioni (dal greco=pesanti)
…che sono fatti di tre quark
Mesoni (dal greco=in mezzo)
…che sono fatti di un quark
e di un antiquark
Leptoni
Sono un altra famiglia di particelle di materia, che a differenza
dei quark non stanno uniti ma preferiscono vivere da soli…
Ci sono sei leptoni, tre con carica elettrica e tre neutri
Il leptone carico più famoso e’ l’elettrone.
Poi ci sono due elettroni più pesanti, il muone e il tau
Gli altri tre leptoni sono i tre tipi di neutrino. Essi non hanno
carica elettrica, sono leggerissimi e difficilissimi da “vedere”
I neutrini sono stati previsti come spiegazione alla massa
mancante nel decadimento del neutrone (E. Fermi)
Per ogni tipo di particella di materia che abbiamo incontrato finora
esiste anche una particella di antimateria, chiamata antiparticella
Le antiparticelle sono uguali alle corrispondenti
particelle di materia, ma hanno carica elettrica opposta
Quando una particella e la corrispondente antiparticella si
scontrano, si annichiliscono in pura energia!
Finora sono state scoperte circa 200 particelle, che sono
composte dai mattoncini che abbiamo visto in precedenza:
troppe?
Enrico Fermi una volta disse ad un suo studente:
“Giovanotto, se fossi in grado di ricordarmi i nomi
di tutte queste particelle sarei stato un botanico!”
Abbiamo visto quali sono le particelle fondamentali che
compongono l’universo: ma come interagiscono tra loro?
Ci sono quattro interazioni fondamentali tra le particelle, e tutte le
forze possono essere attribuite a queste quattro interazioni. Qualunque
forza si consideri - l’attrito, il magnetismo, la gravità, le reazioni nucleari
e così via – è causata da una di queste quattro interazioni fondamentali:
Nel mondo delle particelle la forza di
trascurabile
gravità ha un ruolo
Ma cosa vuol dire che due particelle interagiscono?
Se due pattinatori sul ghiaccio si scambiano una palla, l’effetto
di azione e reazione li farà spostare entrambi dall’equilibrio:
Allo stesso modo due particelle interagiscono scambiandosi
una particella che trasporta la forza, spostandosi dall’equilibrio…
La forza elettromagnetica fa si che oggetti
con la stessa carica si respingano e che
oggetti con carica opposta si attraggano
Ad esempio la forza che tiene uniti gli atomi e che rende la
materia “solida” e impenetrabile è di natura elettromagnetica!
La forza nucleare “forte” tiene assieme i
protoni e i neutroni nei nuclei degli atomi, e lega i quark
che formano i protoni e i neutroni.
Poichè tiene assieme particelle con la stessa
carica elettrica, che tendono a respingersi,
deve essere una forza, appunto, “forte”
Le particelle che mediano la forza “forte” tra i
quark sono chiamati “gluoni”, perchè tengono
incollati
tra loro i quark (in Inglese glue=colla)
La forza nucleare “debole” è
responsabile del decadimento di quark e
leptoni pesanti in
quark e leptoni più leggeri
Quando una particella decade scompare, e viene
rimpiazzata da due o più particelle diverse.
Ad esempio nel decadimento del neutrone:
neutrone
protone
Le tre particelle che mediano la forza “debole”, sono
chiamate bosoni W+, W-, Z0
(scoperti da C. Rubbia nel 1983)
Che cos’è la luce?
UN FLUSSO DI PARTICELLE
MICROSCOPICHE
emesse a ritmo continuo dalle
sorgenti luminose
UN’ ONDA
cioè energia
che si propaga
fotoni
TEORIA CORPUSCOLARE
TEORIA ONDULATORIA
DELLA NATURA "AMBIGUA"
DELLA LUCE
Il dibattito sulla natura
➢ corpuscolare
o
➢ ondulatoria
della luce
nasce nel XVII secolo in
seguito alla contrapposizione
fra le teorie di Isaac Newton
e di Christian Huygens
Secondo Newton lo spazio è vuoto e la
luce ha natura corpuscolare (1687)
Newton scopre la rifrazione
L’IPOTESI CORPUSCOLARE DI
NEWTON
Riusciva a spiegare i fenomeni di ottica geometrica :
•
•
•
•
Riflessione
Rifrazione
Diffusione
Dispersione
Ma non riusciva a spiegare i fenomeni di ottica fisica:
• Interferenza
• Diffrazione
• Polarizzazione
Secondo Huyghens
la luce ha natura ondulatoria
Christian Huygens (1629-95) e Augustin Jean
Fresnel ritenevano che la luce, come il suono, fosse
dovuta alla
vibrazione meccanica di un
mezzo, l’etere cosmico, che riempie
l’universo. Traité de la Lumière (1690).
Tale teoria riusciva a spiegare sia i fenomeni dell’
ottica geometrica sia quelli dell’ottica fisica, ma
ammetteva l’esistenza di un etere cosmico
• già
Cartesio considerava lo spazio tutto
pieno di una materia sottile onnipervadente
(etere) il cui movimento rotatorio intorno al Sole
sarebbe, per esempio, la causa dei moti dei
pianeti (teoria dei vortici).
•così scrive Huygens : "Non c’è dubbio che la luce
arrivi da un corpo luminoso a noi come moto
impresso alla materia interposta".
• Nella seconda metà
del XIX sec. James
Clerk Maxwell (18311879) scoprì che una
carica elettrica
oscillante produce un
campo elettrico e un
campo magnetico tra
loro perpendicolari
che si propagano in
forma d onde alla
velocità della luce.
I campi elettromagnetici sono prodotti
dall’oscillazione delle cariche elettriche.
• L’oscillazione di una carica determina la
variazione del flusso del campo elettrico.
A causa di questa variazione viene generato un campo
magnetico variabile il quale a sua volta determina la
variazione del campo elettrico e così via.
Una volta che il campo elettromagnetico è stato
prodotto dall’oscillazione di una carica, esso ha
un’esistenza autonoma.
Essendo questa una caratteristica delle onde si parla
di onde elettromagnetiche.
Tutte le radiazioni elettromagnetiche sono onde
tridimensionali che vengono generate accelerando una carica
elettrica
Se il moto della carica è oscillante con
andamento sinusoidale anche il campo
elettromagnetico in ogni punto dello
spazio varia in modo sinusoidale con la
stessa frequenza
• Ciascuna delle due
componenti dell’onda
elettromagnetica,
elettrica e magnetica,
trasporta la stessa
quantità di energia.
La luce è costituita da onde elettromagnetiche formate
dalla simultanea propagazione di un campo elettrico e di
un campo magnetico tra loro perpendicolari.
Caratterizzata da:
Lunghezza d’onda
si misura in nanometri
(1nm=10-9 m)
Periodo T = tempo
impiegato per
percorrere la distanza
Frequenza si
misura in Hertz (Hz)
() è legata al colore
piccole ( grandi)
viola
grandi ( piccole)
rosso
Luce bianca: composta da
colori che possono essere
dispersi e ricombinati
mediante un prisma
energia
frequenza
Spettro delle onde
elettromagnetiche
Lo spettro elettromagnetico
nelle scale di:
Lunghezze d’onda,
Frequenza, =c/
Energia, E=h
dove l’energia è espressa in
electronVolt (eV)
1 eV = 1.6 10-19 J
Lunghezza
d’onda
Lunghezza d’onda, frequenza, energia
(fm)
(Å) (nm)
(m)
10–14
10–10
RAGGI
X
RAGGI
GAMMA
(Hz)
10–12
1022
1020
GeV
MeV
109
106
10–8
10–6
keV
103
1016
10–4
10–2
MICRO
ONDE
1014
1012
VISIBILE
1010
E
(m)
102
1
ONDE
RADIO
108
= c
E
(eV)
(mm) (cm)
INFRA-ROSSO
ULTRA-VIOLETTO
1018
Raggi X :
(mm)
10 10–3 Å
1017 1021 Hz
10 eV 200 keV
106
(Hz)
E = h
Spettro delle onde
elettromagnetiche
Raggi X e Raggi
1896 - Roentgen scopre i raggi X.
1914 - Rutherford identifica i raggi
I raggi X sono prodotti nelle transizioni
elettroniche negli atomi di elettroni di
shell interne.
I raggi sono prodotti nelle reazioni
nucleari.
Spettro delle onde
elettromagnetiche
Ultravioletto (UV)
1801 – Ritter in modo analogo all’IR
scopre la luce ultravioletta.
L’UV è prodotto da transizioni
elettroniche di atomi ionizzati.
Spettro delle onde
elettromagnetiche
Visibile
1666 – Newton disperde la luce visibile
con un prisma.
Il visibile è prodotto
-da transizioni degli elettroni di atomi
e molecole
-e da corpi molto caldi.
Spettro delle onde
elettromagnetiche
Infrarosso
1800 – Herschel mostra che la radiazione solare si estende nell’infrarosso.
L’infrarosso è prodotto
-da transizioni rotazionali e vibrazionali
delle molecole
- e da corpi caldi.
Spettro delle onde
elettromagnetiche
Onde radio e microonde
1885 – Hertz scopre le onde radio.
Le onde radio sono prodotte da
dispositivi elettrici e elettronici.
Onde radio
Nel 1887 Hertz fece i primi esperimenti con le onde
elettromagnetiche
Negli anni successivi Marconi effettuò le prime
trasmissioni a distanza
Una sorgente di onde elettromagnetiche può essere
costituita da:
• Antenna trasmittente:
►Un conduttore in cui circola una corrente alternata
• Antenna ricevente.
► La stessa onda elettromagnetica genera una
tensione alternata di uguale frequenza
Corpo nero
Si dice corpo nero una
cavità isolata dal mondo
circostante in cui non vi
è scambio energetico
con l’esterno.
Il corpo nero riesce ad assorbire tutte le radiazioni
che lo colpiscono e ad emettere la radiazione su
un’unica frequenza
Potenza
emessa per
unità di
superficie da
un corpo
nero in
funzione
della
frequenza
per 3 diverse
temperature
T1, T2,T3
L’irraggiamento dipende dalla temperatura del corpo
nero
Planck
Planck osservò che:
• le onde elettromagnetiche trasportano
energia e se incontrano un corpo materiale
trasferiscono ad esso energia
• ogni corpo caldo emette uno spettro invisibile
a temperatura ordinaria, perché la cade
nell’infrarosso.
– 500°C radiazioni rosse
– 650°C radiazioni verdi
– 800°C radiazioni azzurre
– 1200°C radiazioni violette
Corpo nero
• A temperatura ambiente un oggetto nero, per esempio il
carbone, non emette luce visibile (ma solo raggi
infrarossi); al contrario, quando viene scaldato, emette
luce rossa. Se viene portato a temperature più alte, il
colore si sposta verso il giallo; quando arriva a
temperature superiori ai 10.000 gradi (l'oggetto si è
ormai vaporizzato), il colore incomincia a tendere verso
l'azzurro e buona parte della radiazione è concentrata
nell'ultravioletto.
• In altri termini la radiazione emessa ha un massimo ad
una frequenza che è proporzionale alla temperatura.
Legge di Wien
Legame tra lunghezza d’onda di massima
emissione e temperatura
max T 2,9 10 mKK
3
LO SPETTRO DI CORPO NERO
Planck 1900
Sole
Cavità
Radiazione cosmica
di fondo
Planck 14 dicembre 1900
Planck per spiegare l'emissione di energia
del corpo nero suppose che gli atomi si
comportassero come tanti oscillatori che
irradiano energia per salti, non con
continuità.
E = hν
h = 6,63 10-34 Js
Galileo Galilei: “natura non facit saltus”
esercizi
• (a) Calcolare l’energia e la frequenza di
un fotone “rosso”, con lunghezza d’onda
λ=650 nm.
• (b) calcolare la lunghezza d’onda alla
quale un oggetto a temperatura ambiente
(T=20°C) emette la massima radiazione
termica e stabilire fino a quale temperatura
va riscaldato l’oggetto perché si presenti di
colore rosso (λ=650 nm).
h
La più grande e feconda
scoperta del 1900
Compare tutte le volte che si
studia un fenomeno microscopico
h è trascurabile nel
mondo macroscopico
"Mi sono visto costretto ad ammettere che
l'energia associata a un'onda
elettromagnetica non è continua ma
suddivisa in quanti ...“ Planck
1905 Einstein estende la teoria di
Planck ammettendo la
quantizzazione della stessa energia
• 1923 La luce è costituita da un flusso di
“particelle “ di energia, o quanti di luce,
chiamati fotoni
Che natura ha la luce?
COMPORTAMENTO
“ONDULATORIO” DELLA LUCE
La rifrazione
della luce
Il raggio incidente, passando dall'aria
al vetro, è stato deflesso verso la
normale alla superficie di separazione
dei due mezzi;
Quando un raggio di luce
attraversa la superficie di
separazione di due materiali
trasparenti di differente
densità, subisce una
deviazione. Tale fenomeno è
detto rifrazione.
nel passaggio opposto il raggio è
stato,
invece,
allontanato
dalla
normale.
L'angolo di rifrazione dipende
dalle densità ottiche dei due
mezzi trasparenti.
Le righe spettrali
• La luce che si ottiene riscaldando un elemento chimico non
contiene l’intero arcobaleno ma solo determinate righe dette
righe spettrali
– Ogni atomo quando viene sollecitato emette un insieme ben
preciso di colori (spettro di emissione)
– Le righe spettrali sono una sorta di firma dell’atomo
Le lampade per l’illuminazione stradale, ad es., utilizzano vapori al sodio
e vapori al mercurio. Se facciamo passare la loro luce attraverso un
prisma vediamo righe separate
• La spettroscopia è la scienza che utilizza le righe spettrali per
individuare la composizione di un determinato oggetto (es.
stelle lontane)
Le righe spettrali
• Osservate per la prima volta nello spettro della luce solare
da Wollaston (1802)
• Fraunhofer (1814) le studiò e le catalogò registrando la loro
posizione senza capirne l’origine e il significato
• Kirkhhoff e Bunsen (1850) esposero varie sostanze alla
fiamma di un becco Bunsen
Un dato elemento produceva sempre lo
stesso spettro, differente da quello di ogni
altro elemento
cesio e rubidio vennero scoperti perchè le
loro righe spettrali non corrispondevano a
quelle di nessun elemento conosciuto
In seguito anche il gallio, l’elio, l’argon, il neon, il kripton e lo
xenon vennero scoperti per mezzo della spettroscopia
Spettroscopio di Kirkhhoff-Bunsen
• Costituito da una piattaforma orizzontale fissa che porta un prisma, un
collimatore, un cannocchiale e un proiettore.
Il collimatore è costituito da un tubo
metallico che porta, all’estremità rivolta
verso il prisma, una lente convergente
acromatica e all’altra una fenditura (di
larghezza regolabile mediante vite
micrometrica) parallela allo spigolo del
prisma e posta nel piano focale della lente
convergente
• Scopo del collimatore è quello di fornire, quando la lente è
illuminata attraverso la fenditura, un fascio di raggi paralleli che
poi incide su una faccia del prisma
– Il fascio incidente di raggi paralleli è disperso dal prisma in tanti fasci
diversamente inclinati a seconda della lunghezza d’onda che forniscono
nel cannocchiale altrettante immagini della fenditura
• La luce bianca dà uno spettro continuo, dal rosso (meno deviato) al
violetto (più deviato), altre luci danno spettri di righe o bande
Il cannocchiale è
mobile con una piccola
escursione nel piano
orizzontale, per poter
osservare tutto lo spettro
visibile.
Il proiettore è costituito da un tubo fissato sulla piattaforma in posizione
opportuna rispetto al prisma e al cannocchiale. All’estremità verso il
prisma porta una lente convergente e all’altra estremità una scala
graduata che illuminata all’esterno del tubo da una lampada, viene
raccolta nel cannocchiale.
– Nel campo del cannocchiale si vedono sovrapposti lo spettro
della luce in esame e l’immagine della scala graduata
– È possibile riferire quindi le posizioni delle righe dello spettro
alla graduazione della scala
Spettroscopio di Bunsen e Kirchhoff
prisma
collimatore costituito da una
fenditura verticale la cui apertura è
regolabile per mezzo di una vite
micrometrica.
Di fronte alla fenditura c’è un
piccolo prisma a riflessione totale la
cui altezza è circa la metà di quella
della fenditura.
La luce che attraversa il collimatore viene
dispersa dal prisma centrale e, attraverso
l’oculare del cannocchiale, si può
osservarne lo spettro.
Continuo
emesso da solidi, liquidi, gas
densi incandescenti
Discontinuo
emesso da gas
rarefatti eccitati
mediante
riscaldamento o
scariche
elettriche
Spettri di assorbimento
Dovuti a gas i freddi
interposti tra una sorgente
di spettro continuo e lo
spettroscopio
Righe di Fraunhofer
Gli spettri di assorbimento
•Fraunhofer osservò fortuitamente che, lo spettro continuo della
luce solare contiene una serie di righe scure
Fraunhofer stava scoprendo che c’é un altro modo in cui gli
elementi possono produrre uno spettro
lo spettro continuo della luce solare possiede circa 600 righe
scure che Fraunhofer osservò (e che ora hanno il nome di
righe di Fraunhofer)
Lo spettro di assorbimento
• Si ottiee quando un gas freddo è attraversato da un fascio di
luce bianca (che contiene luce visibile di ogni lunghezza
d’onda)
tutte le onde attraversano il gas, tranne quelle con una
particolare lunghezza d’onda che vengono invece assorbite
– lo spettro con queste frequenze mancanti è detto spettro di
assorbimento
• Confrontando spettro di emissione e spettro di assorbimento per uno stesso
elemento si nota che
– Le righe scure di uno spettro di assorbimento appaiono alle stesse
lunghezze d’onda alle quali si trovano le righe luminose del
corrispondente spettro di emissione
• Nessuno fu in grado di spiegare il significato delle righe spettrali per decine
di anni...
Caratteristiche dello spettro
I tubi di Pluker
COMPORTAMENTO
“CORPUSCOLARE” DELLA LUCE
1. Lo spettro di corpo nero
Planck, 1900
2. L’ effetto fotoelettrico
Einstein, 1905
3. L’ effetto Compton
Compton, 1922
Effetto fotoelettrico
Lenard
Einstein
• Quando la luce colpisce
una sostanza vengono
emessi elettroni (effetto
fotoelettrico) perché il
campo elettrico associato
alla radiazione
elettromagnetica accelera
gli elettroni facendo loro
acquistare l’energia
sufficiente ad
abbandonare la superficie
del metallo.
Il fotone cede energia
all’elettrone che ne spende.
-una parte nel lavoro di
estrazione,
-la restante energia
aumenta l’energia cinetica
dell’elettrone.
hν = ½ m v2(max) + Eestr
L'energia cinetica con cui vengono emessi gli elettroni non
dipende dall'intensità della radiazione ma dipende
linearmente dalla frequenza.
• Aumentando l'intensità della luce si aumenta il numero di
elettroni emessi ma non la loro energia cinetica.
• Esiste una frequenza di soglia ν0 che può andare
dall'infrarosso, per certi sali di cesio, all'ultravioletto, per il
platino, al di sotto della quale non si osserva emissione di
elettroni; per i metalli alcalini ν0 è centrato nel visibile.
L’ EFFETTO FOTOELETTRICO
Scoperta:
Hertz 1887
Effetto a soglia: E>Eestr
Nelettr. intensità dell’ onda
Ecin ele. frequenza dell’onda
Teoria: Einstein
1905
FOTONI
1/2 mv2 = ħν - Eestr
L’ EFFETTO COMPTON
Interazione fotone-elettrone
Compton 1922
L’effetto dell’urto perfettamente
elastico tra un fotone, con energia
sufficientemente elevata, e un
elettrone debolmente legato provoca
l’espulsione dell’elettrone e
l’emissione di un fotone a minor
energia ( maggior λ e minor ν)
Qual è la
differenza con
l’effetto
fotoelettrico?
1902 modello atomico di Thomson
1911: teoria atomica di Rutherford
1913: teoria atomica di Bohr
Mezzo secolo di
storia dell’atomo
1916: Einstein descrive le orbite degli elettroni più lontani
1927: principio di indeterminazione di Heisenberg
1925: principio di esclusione di Pauli
1926: equazioni di Schroedinger
1932: scoperta del neutrone ( Chadwich )
1942: prima reazione nucleare ( Fermi )
1951: prime centrali nucleari negli U.S.A.
ULTIME SCOPERTE
1968: si scoprono i Quark
1993: progetto di fissione nucleare ( Rubbia )
1997: si produce in laboratorio l’anti idrogeno
L’energia negli atomi
Bohr riprese il modello di Rutherford e postulò che.
1. gli elettroni in un atomo hanno specifici livelli di energia nei
quali possono stare,
2. quando saltano da un livello ad un altro assorbono od
emettono un fotone di energia pari alla differenza tra le
energie necessarie a percorrere le due orbite.
Attenzione a questo termine usato
da Bohr, oggi non è più accettabile
Modello atomico di Bohr 1913
quando una particella si muove lungo un'orbita
circolare subisce un'accelerazione centripeta.
Ogni carica che si muove di moto non
uniforme emette onde elettromagnetiche.
Per la conservazione dell'energia, l'energia di
queste onde deve provenire dall'energia di moto,
dunque l'orbita dell'elettrone dovrebbe restringersi
fino a far cadere l’elettrone sul nucleo.
Bohr ipotizzò l’esistenza di orbite stazionarie
r = nh/ 2πmv
di raggio
che gli elettroni possono percorrere senza
irradiare energia .
1° postulato di Bohr
o postulato della
quantizzazione delle orbite
Come è arrivato Bohr a
calcolare i raggi delle
orbite elettroniche?
Ha eguagliato la forza
attrattiva alla forza
centrifuga
Da che cosa dipende la forza attrattiva?
1
E la forza centrifuga?
e2
r2
mv2
=
r
Ricorda che in base al
1°postulato di Bohr
v = nh/2πmr
Sostituisci e ricava r
Modello di Bohr
Raggi orbite permesse
rn
n h o
2
2
mZe
2
Es.: Z = 1, n = 1 si ottiene r1= 5,29·10-11 m
raggio di Bohr
Atomo di Bohr
Quindi:
13,6
E n 2 eV
n
Energia di legame
dell’elettrone
Dalla quantizzazione del momento angolare
derivano la quantizzazione di r e di E
Le dimensioni atomiche
L’energia totale dell’elettrone è data dalla somma dell’energia
E tot = E cin. +E pot.
cinetica + l’energia potenziale
ovvero E = mv2/2 – e2 /r2
Ricavando v2 dall’equazione 1
raggio
a0 =
ao
otteniamo la formula del
h
2
4 e me
2 2
c
mec
2
Il “raggio di Bohr” per l’atomo di H ao= 0,53 ·10-10m
dipende solo dalle costanti naturali (h, c, e, me)
I Livelli energetici
Dunque, secondo Bohr, esistono dei livelli energetici
in cui l’elettrone può orbitare senza perdere energia.
1 K
E=- 2
n
Quando fornisco energia (ad es., calore)
all’atomo, cosa succede?
Stati eccitati
Stato fondamentale
2° postulato di Bohr o postulato della
quantizzazione delle energie:
• l'atomo irraggia solo quando l'elettrone effettua una
transizione da uno stato stazionario superiore ad un
altro inferiore.
• La frequenza della radiazione è legata alle energie
dei livelli di partenza e di arrivo dalla relazione:
•dove h è la costante di Planck,
mentre Ei ed Ef sono le energie
dell'orbita iniziale e finale.
L’energia negli atomi
Il più basso livello di energia in cui si può trovare l'elettrone di un
atomo si chiama,
Stato fondamentale
quando l’elettrone assorbe energia
esso salta ad un livello di maggiore
energia, detto
Stato eccitato
Quando dallo stato eccitato l’elettrone
ritorna allo stato fondamentale
restituisce energia sotto forma di onde
elettromagnetiche
Emissione di fotoni in un atomo
eccitato di Idrogeno
n = numero
quantico
principale
stati eccitati
n = 2, 3
Stato fondamentale
n=1
3°postulato di Bohr o postulato della
quantizzazione del momento
angolare della particella
• il momento angolare dell'elettrone in
un'orbita stabile è uguale nh/2π
L’atomo di Bohr (1913)
Per spiegare il mistero delle righe spettrali, Bohr propose un modello
atomico radicalmente diverso (1913)
1. Gli elettroni ruotano su orbite circolari attorno al nucleo. Se l’elettrone
rimane su un’orbita permessa (stato stazionario) l’atomo non emette
energia
gli elettroni possono stare solo
su orbite speciali
2. L’energia, sotto forma di fotoni
(pacchetti di energia), è
emessa o assorbita solo per
transizioni da uno stato
stazionario ad un altro
L’energia degli elettroni può
cambiare solo per piccoli salti
discreti (quanti)
I fotoni assorbiti o emessi
hanno energia che corrisponde
alla spaziatura (energetica) tra
uno stato stazionario e l’altro
I fotoni sono radiazioni ad
energia quindi lunghezza
d’onda fissata ecco il perchè
delle righe discrete
Il modello
di Bohr
spiega
l’emissione
delle righe
spettrali di
Balmer
Paschen
Balmer
Lymann
Perchè le righe spettrali
• Riscaldando gli atomi di una determinata sostanza si fornisce loro
energia e qualche elettrone può saltare ad un livello energetico
superiore. Quando ritorna al livello inferiore, l’atomo emette un
fotone ad una delle frequenze caratteristiche dell’elemento (o degli
elementi) che compongono la sostanza spettro di emissione
– Ogni elemento ha uno spettro di emissione caratteristico
• Quando i fotoni che provengono da una sorgente bianca (che
contiene luce visibile di ogni lunghezza d’onda) interagiscono con gli
atomi di un gas freddo, possono venire assorbiti purché abbiano la
lunghezza d’onda necessaria per portare un elettrone da un livello
energetico ad un altro.
Tutte le altre frequenze attraversano il gas senza interagire
Lo spettro continuo della luce bianca ha delle lacune (righe nere)
in corrispondenza delle lunghezze d’onda assorbite
Gas semplici spettro a righe
Gas poliatomici complessi spettro a bande
Solidi spettro continuo
spettro di
assorbimento
Modello di Bohr
n=
emissione/
n=4
assorbimento
assorbimento
n=3
13.6 eV
n=2
Balmer
(V)
instabile
12.8 eV
12.1 eV
10.2 eV
Lyman
n=1
(UV)
stabile
COSA GLI MANCA? Non funziona per atomi con 2 o più
elettroni; non riesce a predire le intensità delle linee; non è
“indeterminato”!
LA fisica ONDULATORIA
Nel 1924 il fisico francese Louis De Broglie, in
analogia con il caso della luce, propose di
studiare le proprietà ondulatorie degli elettroni e,
più in generale, di tutte le particelle.
Dunque il dualismo onda-corpuscolo riflette una
simmetria di carattere generale, è una legge della natura
Dualismo Onda Dualismo OndaCorpuscolo
Secondo De Broglie, l’elettrone poteva
essere descritto come un’onda. Per
farlo si dovevano collegare i parametri
fondamentali dell’onda a grandezze
fisiche appartenenti all’elettrone.
De Broglie suggerì che il collegamento per
la descrizione degli elettroni in termini
onda-particella fosse dato dalla
relazione
λ= h/ mv
• dove λ è la lunghezza dell’onda
• m e v sono rispettivamente la massa e
la velocità dell’elettrone.
• L’ipotesi trovò conferma negli
esperimenti di diffrazione elettronica
Ipotesi di De Broglie
• Nel 1924 De Broglie estese alla
materia il concetto del dualismo
onda-corpuscolo
• Ad ogni particella materiale con
quantità di moto p deve essere
associata un’onda di lunghezza
d’onda λ
• Agli oggetti macroscopici
corrispondono lunghezze d’onda
praticamente nulle e non
generano alcun effetto
osservabile
h
p
• Combinando le due relazioni si ottiene che
Considerando che λѴ = c
Si ottiene λ= h/ mv
Da cui
λ= h/ mv
Se un elettrone descrive indisturbato una certa
orbita, ad esso deve essere associata un’onda
stazionaria, cioè un’onda che permanga invariata
fino a che l’elettrone non cambia stato di moto.
La lunghezza dell’orbita non può avere
un valore arbitrario, ma deve essere un
multiplo della associata all’elettrone
2r = n
Per l’ipotesi di De Broglie
2r = n(h/p)
2r = n(h/mv)
h
mvr n
2
Coincide con l’ipotesi di quantizzazione di Bohr
L’onda elettronica è stazionaria
• Le onde tendono ad interferire distruttivamente
se non sono in concordanza di fase secondo la
relazione
Formula di Rydberg Ritz
• Sperimentalmente, righe
emesse dall’idrogeno o dagli
idrogenoidi sono
raggruppate in serie con
frequenze ben rappresentate
dalla formula di Rydberg-Ritz
(1890)
• dove R è una costante (per
l’idrogeno R 3,29·1015Hz),
Z è il numero atomico e m e
n due numeri naturali con
n>m
1
1
RZ 2 2
n
m
2
Ma il modello di Bohr dice che:
E 2 E1 1
1
1
1
1
13,6 1,6 10 19 Z 2 2 2 3,28 1015 2 2
h
h
n
n
m
m
dove si è posto Z = 1 per l’atomo di idrogeno.
Ponendo m = 1, n = 2,3,4… si ottiene la serie di Lyman (ultravioletto).
Ponendo m = 2, n = 3,4,5… si ottiene la serie di Balmer (visibile).
Ponendo m = 3, n = 4,5,6… si ottiene la serie di Paschen (infrarosso).
m = 4, n = 5,6,7 serie di Brackett
m = 5 n = 6,7,8 serie di Pfund
m = 2:
n = 3 = 4,57·1014 Hz da cui = 656.3 nm, ossia H.
n = 4 H ( = 486.1 nm)
n = 5 H ( = 434.1 nm)
n = 6 H ( = 410.2 nm)
W. HEISENBERG
Nel 1927 Wemer Heisenberg formulò in
principio di indeterminazione secondo il
quale è impossibile conoscere
simultaneamente e con assoluta
precisione sia la posizione (x), sia la
quantità di moto (p) di un elettrone.
Conoscere significa misurare,
misurare significa perturbare
• Per misurare la POSIZIONE di un oggetto
microscopico come un elettrone occorre
investirlo con un raggio di luce (fotoni) o
comunque qualcosa che in ultima analisi
risulta avere all'incirca le medesime
dimensioni dell'elettrone.
• Questo fa si che l'elettrone risulti
perturbato da questa interazione che ne
modifica inesorabilmente la velocità.
E. SCHRODINGER
Erwin Scrodinger pubblicò nel 1926 un saggio
riguardante un’equazione con la quale è possibile
calcolare la funzione d’onda dell’elettrone e quindi
calcolare la probabilità di trovare un elettrone in un
dato punto dell’orbitale e anche il suo livello
energetico.
Le soluzioni dell’equazione di Schrodingher: funzioni d’onda,
ψ permettono di calcolare le energie quantizzate degli stati
elettronici.
Ψ2 (densità di probabilità), calcolato per una determinata
porzione di spazio, esprime la probabilità di trovare l’elettrone
nello spazio considerato
e per i più curiosi………
Atomo di idrogeno: equazione di Schrödinger
2
2
pr2
L
Ze
H (r , , )
(r , , ) E (r , , )
2m 2mr 2
r
(r , , ) R(r )Yl
ml
u (r ) ml
( , )
Yl ( , )
r
2 ml
2 ml
L Yl (, ) l (l 1) Yl (, )
•
•
•
•
ψ funzione d'onda (orbitale)
ψ 2 probabilità di trovare l'elettrone
Energia quantizzata (E)
numeri quantici n l ml ms
Robert Mulliken
Nel 1932 coniò il termine orbitale
Gli elettroni
Si caratterizzano dal punto di vista energetico mediante
4 numeri quantici:
• n numero quantico principale che determina l'energia dell’elettrone
nell'orbitale.
• l numero quantico azimutale che caratterizza la forma dell'orbitale
• m numero quantico magnetico in relazione con l'orientazione dell'orbitale
nello spazio
• s numero quantico che esprime lo spin dell’elettrone ( la polarizzazione
dell’onda)
principio di esclusione di Pauli:
“non possono esistere nello stesso atomo due o più
elettroni con gli stessi numeri quantici, ossia nello stesso stato
energetico. Da ciò deriva che ogni orbitale può essere
occupato al massimo da due elettroni con spin opposto”.
n numero quantico principale,
determina l'energia dell'orbitale
n 1 (1,2,3.....)
l numero quantico di momento angolare o secondario o
azimutale
0 l (n-1) determina la forma dell'orbitale
m numero quantico magnetico
-l m l (-l,-l+1,...,l-1,l)
determina la direzione di sviluppo dell'orbitale in un campo
magnetico
ms numero quantico di spin
+1/2 ; -1/2
ORBITALI
Distribuzioni radiali di probabilità (probabilità di trovare
l’elettrone ad una certa distanza dal nucleo)
Confronto tra gli orbitali 1s 2s 3s con la presenza di 0,
1 e 2 nodi radiali
Orbitali Atomici
• s orbitali sferici
Orbitali Atomici
• orbitali p
Orbitali Atomici
orbitali d
orbitali f
Che cosa indica l , il numero quantico angolare?
= 0 orbitale tipo s
1s
2s
z
= 1 orbitale tipo p
x
y
z
pz
z
x
y
px
x
y
py
Alcuni esperimenti hanno mostrato che gli elettroni
ruotano (in inglese: to spin) attorno ad un asse ed,
essendo particelle cariche, generano un debole
campo magnetico
N
S
S
N
L’elettrone ha un momento
angolare intrinseco :
spin
(esperimento di Stern-Gerlach,
1922)
Numero quantico di spin
Una particella carica, che ruota su stessa,
genera un campo magnetico.
S
N
Un elettrone possiede un numero quantico di campo
magnetico di “spin”, che può avere solo due valori,
s = + ½ e s = - ½.
In presenza di più elettroni l’energia degli orbitali
risente dell’interazione elettrone-elettrone
• Il principio Aufbau descrive l’ordine di
riempimento degli orbitali
Configurazioni elettroniche
1s
1
H
Configurat ion
1s
1s
Configurat ion
1
H
2
He
1
1
1s
1s
2
st
1 e
-
n
m
1
0
0
ms
1/2
n
m
1
0
0
e 1
0
0
2
0
0
4 th e - 2
0
0
5th e - 2
1
-1
1/2
2 s electrons
1/2
1/2
2
1
0
1/2
7 th e - 2
1
1
1/2
1st e 2
nd
rd
3 e
th
6 e
-
-
-
ms
1/2
1 s electrons
- 1/2
n
m
[Ar] 19 th e -
4
0
0
20 th e -
4
0
0
21st e -
3
2
-2
1/2
4 s electrons
1/2
1/2
22 nd e -
3
2
-1
1/2
23rd e -
3
2
0
1/2
24 th e -
3
2
1
1/2
25 th e -
3
2
2
1/2
26 th e -
You do it!
ms












