CORSO DI IMMUNOLOGIA
per il corso di Laurea in biotecnologie
a.a. 2005-2006 II semestre
DOCENTE:
Dott.ssa Vladia Monsurrò
Dipartimento di patologia
Sezione di immunologia
Universita’ degli Studi di Verona
045 8074256
[email protected]
ORARIO DELLE LEZIONI:
lunedì:
4:00-5:30
giovedì
4:00-5:30
dal 20 marzo al 25 maggio 2006
aula F Facolta’ di Scienze
DOVE TROVARE LE LEZIONI on
line:
http://www.scienze.univr.it/fol/main?ent=oi&cs=6&id=20061&lang=it
In “materiale didattico”
Per qunato riguarda il programma e l’esame e’ come discusso in classe
PROGRAMMA LEZIONI
Mar 21 Marzo lezione 1
Generalità sul corso
Il sistema immunitario (Introduzione)
Giov 23 Marzo lezione 2
Cellule e tessuti del sistema immunitario
Lun 27 Marzo lezione 3
Riconoscimento dell’antigene:
Molecole del Sistema Immunitario:
Antigeni e anticorpi
Giov 30 Marzo lezione 4
MHC (Major histocompatibility complex)
Lun 3 Aprile lezione 5
MHC-Antigene:
Sua
captazione,
processamento e presentazione.
Giov 6 Aprile lezione 6
TCR
Antigeni tumorali e immunoterapia
preparazione del talk)
(in
Lun 10 Aprile lezione 7
Maturazione, attivazione e regolazione dei
linfociti:
Maturazione dei linfociti ed espressione dei
recettori (genetica Ig e TCR)
Giov 13 Aprile lezione 8
Immunita’ e tumori
Parmiani Talk (ore 17:00)-vedi volantino
Giov 20 Aprile lezione 9
Attivazione
segnale.
linfocitaria,
trasduzione
del
Lun 24 Aprile lezione 10
Attivazione dei linfociti B e produzione di Ab
Giov 27 Aprile lezione 11
Tolleranza immunologica
Giov 4 Maggio lezione 12
Meccanismi effettori
Citochine, Immunita’ innata
Lun 8 Maggio lezione 13
Meccanismi effettori dell’immunita’ cellulomediata, reazioni DTH
Giov 11 Maggio lezione 14
Meccansimi effettori dell’immunita’ umorale
complemento
Lun 15 Maggio lezione 15
Rapporti tra fisiologia e patologia
Ipersensibilità concetti generali
Ipersensibilità di tipo I
Giov 18 Maggio lezione 16
Test prove esami-recupero
Merc 7 giugno e 28 giugno
ESAMI
I RECETTORI PER GLI
ANTIGENI:
• IG
• MHC
• TCR
STRUTTURA FONDAMENTALE DI UNA
MOLECOLA DI IMMUNOGLOBULINA:
• catene PESANTI
• catene LEGGERE
due catene
leggere
(isotipo k o )
due catene
pesanti (isotipo
oppure , , , )
ponti disolfuro che
legano tra loro le due
catene pesanti e
ciascuna catena
leggera ad una catena
pesante
REGIONI COSTANTI E REGIONI VARIABILI
regioni
VARIABILI
VH
CH1
VL
CL
regioni
COSTANTI
CH2
CH3
STRUTTURA FONDAMENTALE DI
UNA MOLECOLA DI
IMMUNOGLOBULINA
VH
CH1
catena leggera:
-1 dominio variabile VL
-1 dominio costante CL
catena pesante:
1 dominio variabile VH
3 o 4 domini costanti CH, a
seconda dell'isotipo
VL
CL
CH2
CH3
Struttura molecolare degli anticorpi:
PRODUZIONE DI ANTICORPI MONOCLONALI
I RECETTORI PER GLI
ANTIGENI:
• IG
• MHC
• TCR
RICONOSCIMENTO DELL’ANTIGENE :
- linfociti B
-linfociti T
antigene in forma nativa
antigene processato da
cellule accessorie
(cellule presentanti
l’antigene )
• I linfociti T contro microbi intracellulari e
l’attivazione di altre cellule (macrofagi e
linfociti B)
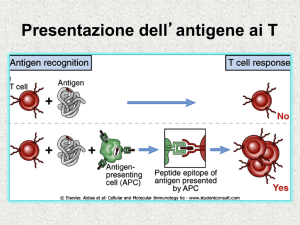
Le APC (=Antigen Presenting Cell)
“PROFESSIONISTE” presentano l’antigene processato
ai linfociti T associato alle molecole MHC
recettore MHC legante
l’antigene processato in peptidi
Cellula
dendritica
Macrofago
Linfocita B
PRESENTAZIONE DELL’ANTIGENE CAPTATO DALL’ESTERNO
E PROCESSATO DA PARTE DELLE CELLULE DENDRITICHE
Cellula
dendritica
MHC-II
Antigene
processato
MHC-I
Antigene
processato
Linfocita T helper e suoi
recettori e co-recettori
per l’antigene
Linfocita T citotossico,
suoi recettori per
l'antigene e co-recettori
CD8
Le molecole
MHC-I presentano
l’ Ag ai T citotossici
Le molecole
MHC-II presentano
l’ Ag ai T helper
MOLECOLE MHC
struttura
e
genetica
Cosa significa MHC?
• MHC (complesso maggiore di
istocompatibilità)
è il locus dove mappano gli HLA
• È chiamato così perché storicamente e’
stato associato ai rigetti di trapianto
(altamente polimorfico e immunogeno).
• Un allele è una variante di un gene
polimorfo
• Un individuo è:
Omozigote se ha 2 alleli uguali
Eterozigote se ha 2 alleli differenti
• Topi singenici hanno tutti i geni identici
• Due ceppi allogenici sono due gruppi di
topi singenici differenti fra loro
IL COMPLESSO GENETICO MHC VENNE INIZIALMENTE IDENTIFICATO
COME REGIONE GENETICA CHE CONTROLLAVA IL RIGETTO DEI TRAPIANTI
TRA TOPI DI CEPPI INBRED DIVERSI (Snell-1940)
Benacerraf e McDevitt scoprirono tra gli
anni 1960/1970 che il complesso MHC
controllava anche la RISPOSTA
ANTICORPALE contro determinati
antigeni proteici, ed era diversa a seconda
degli alleli MHC di ciascun ceppo
Questo perchè alcuni peptidi li legavano
e generavano rispost aT helper, altri no
Esistono dei geni di istocompatibilità
Regione MHC nell’uomo e nel topo
centromero
centromero
telomero
telomero
Regione MHC nell’uomo
centromero
telomero
Map of the human MHC. This map is simplified to exclude many genes that are of unknown function. HLA-E, HLA-F,
HLA-G, HLA-J, and HLA-X are class I-like molecules; HLA-H does not appear to be involved in the immune system.
C4, C2, B, complement proteins; DM, TAP, proteasomes, proteins involved in antigen processing; HLA, human
leukocyte antigen; HSP, heat shock protein; LT, TNF, cytokines
Collocazione dei geni MHC e dei geni
MHC-relati sui cromosomi umani
• Gli MHC nell’uomo sono chiamati HLA
(antigeni leucocitari umani) perche’
identificati per vie sierologiche mediante
Ab che riconoscevano i leucociti durante le
trasfusioni
NOMENCLATURA HLA
Nomenclature of human leukocyte antigen (HLA) loci and alleles
Nomenclature
Definition
HLA
The HLA region and prefix for an HLA gene
HLA-DRB1
A particular HLA locus (i.e., DRB1)
HLA-DRB1*13
A group of alleles that encode the DR13 antigen defined
serologically by microlymphocytotoxicity or by mixed lymphocyte reactivity
HLA-DRB1*1301
A specific HLA allele
HLADRB1*1301N
A null allele (i.e., nonexpressed)
HLADRB1*13012
An allele that differs by a synonymous mutation (i.e., identical amino acid
encoded by a different codon)
HLADRB1*1301102
An allele that contains a mutation outside the coding region
HLADRB1*1301102N
A null allele that contains a mutation outside the coding region
© 2003 by LIPPINCOTT WILLIAMS & WILKINS
Renal graft survival improves with
fewer human leukocyte antigen
(HLA) mismatches. Cumulative
data for graft survival are plotted
as a function of time. Curves 1, 2,
and 3 represent the groups with
no class II HLA mismatches and
four or fewer class I HLA
mismatches, whereas curve 4
shows the graft survival of those
with fewer than two class II
mismatches and no class I
mismatch. The worst survivals
are clearly those with both HLA
class I and class II mismatches
RICONOSCIMENTO ANTIGENICO NEI TRAPIANTI
• Gli alleli dell’ MHC sono altamente polimorfici
• Codominanti
• Cl I e Cl II sono distinte ma omologhe
POLIMORFISMO DELLE MOLECOLE
MHC
• Un allele ad un locus genetico che abbia una frequenza
0.01 è denominato “rara variante allelica”.
• Un allele con una frequenza 0.01 (ma 1) è definito
come “polimorfico”.
• Gli alleli ai loci MHC sono polimorfici poichè presentano
sempre frequenze elevate nella popolazione.
• Il polimorfismo è concentrato negli esoni che codificano
per i domini che legano il peptide e il TCR.
I
NUMERO DI ALLELI HLA AD
loci MHCALCUNI
presentano
un
numero
LOCI
molto elevato di alleli:
Frequenze alleliche in popolazioni diverse
I geni MHC sono espressi in maniera codominante
• Struttura dell’MHC
• Similitudini Cl I e Cl II
1. Hanno una tasca di legame per il
peptide, due domini Ig, dominio
transmembrana e dominio citoplasmatico
2. Il polimorfismo e’ nella tasca
3. Le zone non polimorfe legano i recettori
CD4 o CD8
STRUTTURA SCHEMATICA DELLE MOLECOLE
MHC CLASSICHE
Secondo la regola: 1 gene-1 catena polipeptidica
-1 gene per la catena
- 1 gene per la catena
• Similitudini ClI e Cl II
1. Hanno una tasca di legame pe ril
peptide, due domini Ig, dominio
transmembrana e dominio citoplasmatico
2. Il polimorfismo e’ nella tasca
3. Le zone non polimorfe legano i recettori
CD4 o CD8
STRUTTURA DEL TCR
T cell recognition of a peptide-MHC complex. This schematic illustration shows an MHC molecule binding and displaying
a peptide and a T cell receptor recognizing two polymorphic residues of the MHC molecule and one residue of the peptide.
Details of the interactions among peptides, MHC molecules, and T cell receptors are described in Chapters 4, 5, and 6.
Modello delle interazioni molecolari tra MHC-II/peptide,
TCR e CD4, e MHC-I/peptide, TCR e CD4
APC
o cell.
bersaglio
MHC-II
MHC-I
CD4
TCR
CD4 si lega al
dominio 2 di
MHC-II
CD8
CD8 si lega al
dominio 3 di
MHC-I
Cellula
T
TCR
•MHC Cl I
2 tipi di Molecole MHC-I
classiche, MHC-Ia:
non classiche, MHC-Ib:
•
•
•
•
•
•
•
HLA-A,-B,-C (uomo)
H-2K,-D,-L (topo)
sono polimorfiche e
legano peptidi antigenici
che presentano ai TCR
associati a CD8
Essendo codominanti
ogni cellula ne esprime
6 diverse
CD1
H2-M3
MICA
nFcR
Rae1
Presentano polimorfismo
molto limitato e spesso il
solco di legame con il
peptide è molto ridotto
STRUTTURA SCHEMATICA DELLE MOLECOLE MHC
Catena :
44-47kD
Peptide 8-10 aa
Catena :
2-microglobulina,
12kD
• 2 catene polipeptidiche e
• associate non covalentemente
• con strutture secondarie costituite da foglietti
e -eliche.
•MHC Cl II
STRUTTURA SCHEMATICA DELLE MOLECOLE MHC
Catena :
32-34kD
Peptide fino a 30 aa
Catena :
29-32kD
• 2 catene polipeptidiche e
• associate non covalentemente
• con strutture secondarie costituite da foglietti
e -eliche.
Circa 20 possibili combinazioni perche’ DQ
puo’ legarsi anche a DP e DR, sia materno
che paterno
Le molecole MHC-I ed MHC-II completamente
assemblate sono eterotrimeri, composti da:
1. una catena ;
2. una catena ;
3. il peptide antigenico nella tasca.
L’espressione stabile sulla membrana cellulare
richiede la presenza di tutti e tre i componenti.
CDR= ragione che determina la complementarieta’
Ig= immunoglobulina
Kd= costante di dissociazione
MHC= complesso maggiore di istocompatibilita’
VH= dominio variabile della catena pesante
VL= dominio variabile della catena leggera
Legame MHC-antigene
• Similitudini ClI e Cl II
1. Hanno una tasca di legame pe ril
peptide, due domini Ig, dominio
transmembrana e dominio citoplasmatico
2. Il polimorfismo e’ nella tasca
3. Le zone non polimorfe legano i recettori
CD4 o CD8
La variabilità delle sequenze aminoacidiche tra i diversi
alleli ad un locus è diversa a seconda del dominio molecolare:
è concentrata nei domini che legano il peptide.
Polymorphic residues of a class I MHC molecule. The polymorphic residues of class I and class II MHC molecules (shown as
red circles) are located in the peptide-binding clefts and the a-helices around the clefts. In the class II molecule shown (HLA-DR),
essentially all the polymorphism is in the b chain. However, other class II molecules in humans and mice show varying degrees of
polymorphism in the a chain and usually much more in the b chain.
Peptide binding to MHC molecules. A. These top views of the crystal structures of MHC molecules show how peptides (in
yellow) lie on the floors of the peptide-binding clefts and are available for recognition by T cells. The class I molecule shown is
HLA-A2, and the class II molecule is HLA-DR1. Note that the cleft of the class I molecule is closed, whereas that of the class II
molecule is open. As a result, class II molecules accommodate longer peptides than do class I molecules. (Courtesy of Dr. P.
Bjorkman, California Institute of Technology, Pasadena.) B. The side view of a cut-out of a peptide bound to a class II MHC
molecule shows how anchor residues of the peptide hold it in the pockets in the cleft of the MHC molecule. (From Scott CA, PA
Peterson, L Teyton, and IA Wilson. Crystal structures of two I-Ad-peptide complexes reveal that high affinity can be achieved
without large anchor residues. Immunity 8:319-329, 1998. Copyright 1998, with permission from Elsevier Science.)
MHC-I:
peptide
di 8-10 AA
MHC-II:
peptide
anche di più
di 30 AA
Rappresentazione della localizzazione di un peptide
legato nella tasca formata dai domini 1 e 2 di una
molecola MHC-I.
Peptide
(in viola)
Molecole di acqua
(sfere azzurre)
MHC-binding residues and T cell receptor contact residues of a model peptide antigen. The immunodominant epitope of
the protein hen egg lysozyme (HEL) in H-2k mice is a peptide composed of residues 52-62. The ribbon diagrams modeled after
crystal structures show the surface of the peptide-binding cleft of the I-Ak class II molecule and the bound HEL peptide with
amino acid residues (P1-P9) indicated as spheres (A) and with side chains (B). Mutational analysis of the peptide has shown
that the residues involved in binding to MHC molecules are P1 (Asp52), P4 (Ile55), P6 (Gln57), P7 (Ile 58), and P9 (Ser60);
these are the residues that project down and fit into the peptide-binding cleft. The residues involved in recognition by T cells are
P2 (Tyr53), P5 (Leu56), P8 (Asn59), P10 (Arg61), and P11 (Trp62); these residues project upward and are available to T cells.
(From Fremont DH, D Monnale, CA Nelson, WA Hendrickson, and ER Unanue. Crystal structure of I-A in complex with a
dominant epitope of lysozyme. Immunity 8:305-317, 1998. Copyright 1998, with permission from Elsevier Science.)
Caratteristiche delle interazioni peptide-MHC:
- le molecole MHC hanno una certa promiscuità nel legame col
peptide;
-ogni molecola MHC-I o -II possiede una sola tasca di
legame con il peptide, che può ospitare, in momenti diversi,
molti peptidi differenti, ma con alcune caratteristiche
strutturali in comune ;
- la fine specificità del riconoscimento antigenico
è dovuta prevalentemente alla selettività del TCR;
- il legame dei peptidi alle molecole MHC è un’interazione
non covalente tra residui AA del peptide e residui AA della
tasca della molecola MHC, saturabile a bassa affinità, con bassi
tassi di associazione e di dissociazione;
- le molecole MHC di un individuo non distinguono tra peptidi
estranei (es. da Ag microbici) e peptidi self (= da Ag derivati da
proteine proprie).
Antigen competition for T cells. A T cell recognizes a peptide presented by one MHC molecule. An
excess of a different peptide that binds to the same MHC molecule competitively inhibits presentation of the
peptide that the T cell recognizes. APC, antigen-presenting cell.
Lista di alcuni peptidi trovati associati a
molecole MHC-I
Schema dell’interazione MHC-I/peptide
Schema dell’interazione MHC-II/peptide
Lista di alcuni peptidi trovati associati a molecole MHC-II
Scoperta di epitopi:
iTOPIA (filmino)
CTL
Tumor cell
TAA
Monsurro’ and Nagorsen ASHI Q 2002
2 microglobulin
Soluble tagged HC
(HLA)
peptide
Refolding and biotinylation
Avidin labeled with PE
Biotinilated monomer
tHLA PE
CTL
Tumor cell
CD8FITC
TAA
Monsurro’ and Nagorsen ASHI Q 2002
Kinetics of expansion
of vaccine specific CD8+ cells (ex vivo)
8i
t209-2M PE
0i
0%
16i
0.4%
0.3%
24i
2.2%
CD8 FITC
Monsurro’ Blood 2005
Utilizzo biotecnologico dell’MHC
Tetrameri (filmino)
Enhancement of class II MHC expression by IFN-g. IFN-g, produced by NK cells during innate immune reactions to
microbes or by T cells during adaptive immune reactions, stimulates class II MHC expression on antigen-presenting cells
(APCs) and thus enhances the activation of CD4+ T cells. IFN-g has a similar effect on the expression of class I MHC
molecules and the activation of CD8+ T cells
The end
Response rate after peptide-based vaccinations
against melanoma
Responses
Patients
%
MART -127-35 in IFA
0
20
0
g209-2M in IFA
0
11
0
g209-2M in IFA +
IL-2 (720,000 IU/Kg TID)
13
31
42
Treatment:
Rosenberg et al. Nature Med,1998
Come è possibile che le molecole MHC
presentino un numero di peptidi diversi
sufficiente a coprire la maggior parte
delle proteine antigeniche ?
Attraverso duplicazione genica ed elevato
polimorfismo:
• tanti loci codificanti per molecole simili
• alleli polimorfici allo stesso locus
• codominanza
Ricadute del polimorfismo dell’MHC
sull’ immunopatologia :
• Trapianti
• Suscettibilità a varie patologie, spesso
autoimmuni
E’ importante in alcuni casi tipizzare
i pazienti per il genotipo MHC
Corrispondenza tra gli esoni dei geni MHC
e i domini della struttura proteica
MHC-I
MHC-II
Ereditarietà dell’MHC nell’uomo
Lista degli alleli HLA di classe II
Lista degli alleli HLA di classe I