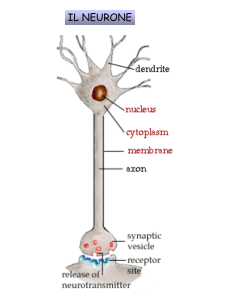
AMINOGLICOSIDI
DESOSSISTREPTAMINA 4,5-DISOSTITUITA
Glicidi o aminoglicidi
HO
5''
OR4
2'
O
H2N
HO
O
R3
OH
O
6'
R2
4
5
O
HO
R1HN
•Neomicina B
•Paramomicina I
•Lividomicina A
•Ribostamicina
NH2
1
3
2-desossistreptamina (aglicone)
DESOSSISTREPTAMINA 4,5-DISOSTITUITA
Y=
X=
OH
NH2
O
H2N
NH2
OR5
OH
O
DESOSSISTREPTAMINA 4,6-DISOSTITUITA
Glicidi o aminoglicidi
R9
2'
R7
H
R2
R1
O
R3
O
R8
R10HN
3'' H
6
OH
HO
6'
R4
4
R5
O
O
•Kanamicina A,B,C
•Tobramicina
•Gentamicina C1, C2,B
•Arbekacina
R6HN
NH2
1
3
2-desossistreptamina (aglicone)
DESOSSISTREPTAMINA 4,6-DISOSTITUITA
R*= CHOHCH2NH2; R’= CHOH(CH2)NH2; R’’= CH2CH3
Meccanismo d’azione
Proteina matura
Allungamento catena
polipeptidica
Blocco complesso
d’inizio
Blocco traduzione e
terminaz. precoce
Direzione traduzione + aminoglicoside
Incorporazione aa.
errati
Meccanismo d’azione e SAR: studi
cristallografici
1493
Legame H tra guanina A 1408 e Paramomicina,
Tobramicina, Geneticina.
Meccanismo d’azione e SAR: modelling
Meccanismo d’azione e SAR: modelling
•
I gruppi funzionali essenziali sono l’ossidrile e l’aminogruppo;
•
L’anello I lega le coppie U 1406 U 1495 e C 1407 G 1494, essenziali
quindi per un’interazione efficace;
•
La tasca creata da A 1492 e dalla coppia A 1408 A 1493 si lega
all’anello II della Paramomicina, questo legame fa shiftare G 1491 al di
sopra della sua naturale posizione;
•
Gli anelli III e IV rafforzano le interazioni principali, legando il solco
maggiore dell’r-RNA tramite i propri gruppi –OH ed –NH2;
•
La coppia C 1409 G 1491 accomoda il legame dell’aminoglicoside nella
tasca, perciò la presenza di una base errata in questa posizione
impedisce la formazione del legame;
•
La conformazione assunta deve soddisfare le costrizioni steriche ed
elettrostatiche del sito di legame.
Spiazzamento ioni bivalenti e ruolo del solvente
Aminoglicosidi come metal mimics
Ponti H stabilizzano i complessi
Meccanismi di Resistenza
• Riduzione dell’ingresso e/o accumulo del farmaco
all’interno del batterio (fenomeni adattativi di
impermeabilizzazione della membrana);
• Espressione di enzimi batterici che modificano gli
aminoglicosidi e li rendono
inattivi(AAC,ANT,APH);
• Modificazione del sito di legame ribosomiale
(mutazione puntiforme).
Espressione di enzimi batterici
Strategie per superare l’inattivazione
enzimatica
• Studi
di
relazione
struttura
attività:
effettuati a partire da un lead compound sul
quale vengono apportate delle sostituzioni;
•
Studi di Drug Targeting: l’individuazione
dell’esatta struttura dei targets (RNA e/o
enzima), consente di ottenere composti
selettivi nei confronti del bersaglio biologico
(RNA).
Studi di relazione struttura attività
OH
*Idrossimetilazione in 1
*Fluorinazione in 2' ed in 5
*Alchilazione ed acetilazione del 2' amino
*Inversione chiralità in 5
*Fluorinazione in 3'
*Rimozione dell'OH in 3'
*Fluorinazione in 4'
APH (3')
AAC (2')
ANT (4')
OH
2'
O
HO
H2N
H2N
O
3''
HO
OH
O
6
NH2
4
O
NH2
H2N
1
ANT (2'')
AAC (6')
3
* Alchilazione in 6' amino
*Introduzione di aa e peptidi in 6'
*Idrossimetilazione in 1
APH (2'')
*Aminazione in 2''
*Acilazione in 2''
*Fluorinazione in 2'' e in 5
*Idrossimetilazione in 1
*Aminoacilazione in 1
*Inversione della chiralità in 5
*2''-oxo derivatio 5-fluoro derivati
6' OH
AAC (3)
*Fluorinazione in 5
*Idrossimetilazione in 1
*Aminoacilazione in 1
*Alchilazione in 1
*Inversione chiralità in 5
Studi di
relazione
struttura
attività
OH
2'
(H2N)HO
6'
O
OH
5A
5B
NH2
OH
2'
5C
OH
2'
ON2
HO
O-ADP
O-
NH2
P
O-
O
APH
H
5D
HO
6'
O
OH
NH2
O
P
-
O
HO
Analoghi deaminati della
Kanamicina A
B
O
2'
O
3
6'
O
-
OH
6' CH
O
OH
6'
O
OH
N
NH2
+
O-ADPO
O
P
-
O
O
2'
HO
6'
O
Enz-Nu
-
O
HO
O
OH
6'
O
P
NH2
-
O
O
2'
O
R
OH
NH2
H+
S
O
HO
6'
O
Inattivazione enzimatica
OH
NH2
+ ADP
Analoghi che mimano lo stato di transizione
Uso di solfonammidi
isochinoliniche come
inibitori di protein chinasi
SAR degli Aminoglicosidi di ultima
generazione: Piramnicina e TC005
•
•
•
•
L’aminogruppo è ancorato saldamente alla tasca e non è
riconosciuto dall’enzima
L’introduzione di sostituenti sull’anello III e IV, carichi come la
guanidina o neutri come il gruppo metilico o aromatico, hanno
portato ad un aumento dell’interazione carica-carica o
dell’interazione di van der Waals, con il risultato finale di
agevolare il legame aminoglicoside-RNA e ostruire quello
aminoglicoside-enzima
Il composto ottenuto è molto diverso dal lead originario ma
mantiene un’elevata potenza ed al tempo stesso evita
l’inattivazione enzimatica
Introducendo in N1 della Piramnicina un acido 4-amino-2idrossibutanoico, è stato ottenuto un composto TC005, che ha gli
stessi vantaggi del lead e ridotta tossica renale perché escreto in
minima parte tramite tale emuntorio.
SAR degli
Aminoglicosi
di ultima
generazione:
Piramnicina
e TC005
Studi di Drug Targeting: complesso
APH(3’)-IIIa-Kanamicina o Neomicina
APH(3’)-IIIa-aminoglicoside
t-RNA:Detossificazione di APH(3’)-IIIa
Studi di Drug Targeting
Neomicina-APH(3’)-IIIa
Kanamicina-APH(3’)-IIIa
Studi di Drug Targeting:SAR
sottositi di APH(3’)-IIIa
Studi di Drug Targeting: SAR
Neomicina B-Paramomicina I/APH
• Le conformazioni di Neomicina B e Paramomicina I
nel sito target sono identiche;
• I gruppi funzionali impiegati nel legame con
APH(3’)-IIIa sono identici a quelli utilizzati nel
legame col ribosoma;
• Esistono significative differenze per ciò che
concerne le interazioni di van der Waals.
Studi di Drug Targeting: interazioni di van der
Waals
APH(3’)-IIIa
Neomicina B-Paramomicina I
Kanamicina A-Gentamicina
Sito A ribosoma E.coli
Conclusioni e Prospettive Future
• Molecular mimicry ed effetto decoy: strategie
fondamentali per lo sviluppo (design) di nuovi
aminoglicosidi in grado di interagire con il sito A
ribosomiale ma incapaci di legare APH(3’)-IIIa, in
definitiva più efficaci perché non inattivati e meno
tossici.