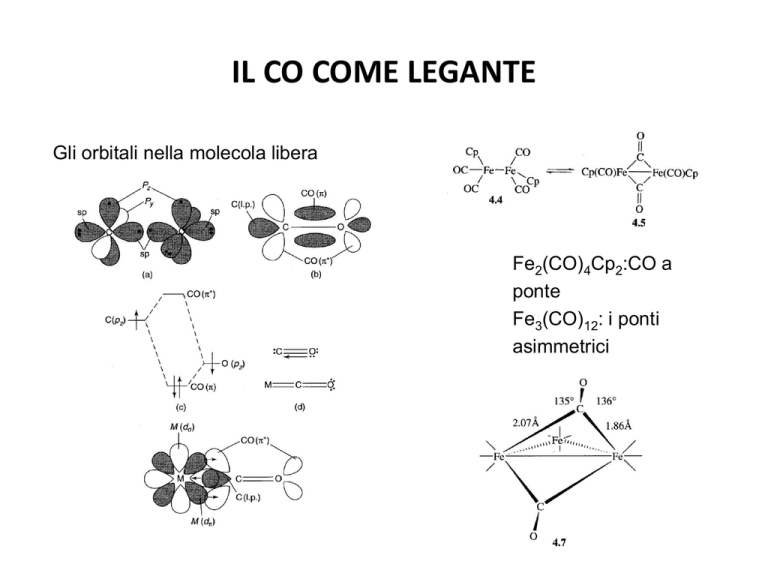
IL CO COME LEGANTE
Gli orbitali nella molecola libera
Fe2(CO)4Cp2:CO a
ponte
Fe3(CO)12: i ponti
asimmetrici
SINTESI DEI METALLO CARBONILI
• Per reazione diretta:
Ni + 4 CO
Ni(CO)4
Fe + 5 CO Fe(CO)5
• Riduzione di un sale in presenza di CO:
CoX2 + H2 +CO Co2(CO)8
CrCl3 + Al + 6 CO Cr(CO)6 + AlCl3
• Riduzione operata dal CO (carbonilazione riduttiva):
Re2O7 + 17 CO Re2(CO)10 + 7 CO2
6 RuCl3 + 33 CO + 27 OH- 2 Ru3(CO)12 + 9 HCO3- + 18 Cl- + 9 H2O
REAZIONI DEI METALLO CARBONILI
•
Cr(CO)6 + L Cr(CO)5L + CO
Sostituzione:
Mo(CO)6 + Me3C6H3 Mo(CO)3(Me3C6H3)
•
Fotosostituzione
Cr(CO)6 + thf (hn) Cr(CO)5thf + CO
•
Sostituzione catalizzata
Cr(CO)6 + L +Me3NO Cr(CO)5L + CO2
•
Attacco elettrofilo all’ossigeno:
•
Attacco nucleofilo al carbonio:
M-CO + AlCl3 M-CO-AlCl3
M-CO + Nu M=C(O-)-Nu (Nu = OH-, NR2-, RO-, R-)
•
Inserzione:
•
Riduzione:
MeMn(CO)5 + L Me-C(O)Mn(CO)4L
Co2(CO)8 + 2 Na 2 Na[Co(CO)4]
Fe(CO)5 + OH- [Fe(CO)4(COOH)]- [HFe(CO)4]-+ CO2
Fe2(CO)9 + 4 OH- [Fe2(CO)8]2- + CO32- + 2 H2O
ATTACCO NUCLEOFILO ED ELETTROFILO AL CO
Re2(CO)10 + MeO-
I CO a ponte sono più basici:
[Fe4(CO)13]2- + MeSO3F
WATER GAS SHIFT REACTION
NO COME LEGANTE
NO piegato: NO-, donatore di un elettrone,
M-N-O, M in alti stati di ossidazione
NO lineare: NO+, donatore di tre elettroni,
M-N-O, M in bassi stati di ossidazione
NO COME LEGANTE
Mn(NO)(CO)4
The Coordination Chemistry of Nitric Oxide and Its
Significance for Metabolism, Signaling, and Toxicity in
Biology
characterizing the exact
electronic structures of
transition metal nitrosyls has
been difficult, which led to the
establishment of the famous
Enemark- Feltham* notation
that allows for a general
classification of transition
metal nitrosyls without the
need to define an exact
electronic structure.
* {MNO}n
ISONITRILI (CN-R) COME LEGANTI
[Co(CNR)4]-, [Co2(CNR)8], [Ta(CNR)7]+
Isonitrili terminali e a ponte, l’angolo R-NC è 130-180°, per effetto della
retrodonazione
(R-N=C=M).
Danno facilmente reazioni di attacco
nucleofilo al C e reazioni di inserzione:
SINTESI DEI METALLO-ALCHILI
•
Attacco nucleofilo al metallo:
WCl6 + 6 LiMe WMe6 + 6 LiCl (transmetallazione)
•
Attacco elettrofilo al metallo:
[Mn(CO)5]- + CH3I MeMn(CO)5 + I-
•
Somma ossidativa:
Ir(CO)Cl(PPh3)2 + MeI Me-IrI(CO)Cl(PPh3)2
2 Cr2+ + MeI Me-Cr2+ + CrI2+
•
Inserzione:
PtHCl(PEt3)2 + C2H4 PtEtCl(PEt3)2
L’energia di legame M-C è
160-300 kJ/mol:
LA b ELIMINAZIONE
Un possibile intermedio
per l’eliminazione: il
legame agostico
Per la b-eliminazione occorrono:
•H in b
•Catena alchilica flessibile
•Sito di coordinazione vuoto
•Un orbitale pieno per retrodonazione
SINTESI E REAZIONI DEI METALLO-IDRURI
•
Sostituzione nucleofila con H-:
Cr(CO)6 + BH4- [HCr(CO)5]- [(m-H)Cr2(CO)10]-
•
Attacco elettrofilo al metallo:
[Mn(CO)5]- + H+ HMn(CO)5
•
Somma ossidativa:
Ir(CO)Cl(PPh3)2 + HX H-IrX(CO)Cl(PPh3)2
Ir(CO)Cl(PPh3)2 + H2 (H)2Ir(CO)Cl(PPh3)2
•
H-transfer da un legante preesistente (b-eliminazione)
GLI ALCHENI COME LEGANTI
Il modello Dewar-Chatt- Ducanson (1953) per
il legame tra metallo e doppio legame:
donazione s e retrodonazione p
Le due situazioni limite: legame
M-alchene e metallaciclopropano
Il sale di Zeiss: C-C 1.36 Å
diedro CH2/CH2 146°
A destra: angoli diedri
CH2/CH2: 138°
CF2/CF2: 106°
SINTESI DEI METALLO ALCHENI
• Per sostituzione diretta:
[PtCl4]2- + C2H4 [PtCl3(C2H4)] - + Cl• Riduzione di un sale in presenza di alchene:
Pt(PPh3)2Cl2 + C2H4 + BH4- Pt(PPh3)2(C2H4)
• Da un alchile per b-eliminazione:
MLn-CH2-CH2-R HMLn-1-CH2=CH-R + L
• Protonazione di un allile:
Mn(CO)5-(h1-CH2-CH=CH2) + H+ [Mn(CO)5-(h2-CH2=CH-CH3)]+
REAZIONI DEI METALLO ALCHENI
•
Inserzione in un legame M-H:
M-H + CH2=CH2 M-CH2-CH3
(PPh3)AuMe + CF2=CF2 Au(PPh3)-CF2-CF2-Me
•
Attacco nucleofilo:
(NHMe2)PtCl2(C2H4) + NHMe2 (NHMe2)Pt(-)Cl2-CH2-CH2-N(+)HMe2
[CpFe(CO)2(C2H4)]+ + Nu- CpFe(CO)2-CH2CH2-Nu
GLI ALCHINI COME LEGANTI
Due formule limite: metalla-ciclopropene e di-carbene
Ciclo-esino e benzino stabilizzati da coordinazione
l’alchino può donare 4 elettroni
ALLILI E DIENI CONIUGATI
ISOMERIA DEI METALLO-ALLILI
L’isomerizzazione syn-anti avviene
tramite intermedio h1-allile
Pd2Cl2(C3H5)2 E CATALISI
1983
1985
1987
1989
1991
1993
1995
1997
1999
2001
2003
2005
2007
2009
2011
2013
0
20
40
60
80
100
120
140
160
SINTESI E REAZIONI DEI METALLO-ALLILI
•
Attacco nucleofilo al metallo:
NiBr2 + 2 C3H5MgBr (h3-all)2Ni + 2
MgBr2
•
Attacco elettrofilo al metallo:
[Mn(CO)5]- + C3H5I (h1-all)Mn(CO)5 + I (h3-all)Mn(CO)4 + CO
•
Sale metallico, allil cloruro e riducente
•
Olefina e alogenuro metallico, con
eliminazione di HX
Gli allili reagiscono con nucleofili (più
spesso) e con elettrofili.
Isomerizzazione (catalitica) di olefine:
•
Somma ossidativa
REAZIONI STEREOSELETTIVE
•
•
•
Mo è centro stereogenico; il
neomentile genera due
diastereoisomeri
La sostituzione CO/NO genera un
complesso cationico, soggetto ad
attacco nucleofilo
Si forma un unico enantiomero
•
•
I due enantiomeri vengono separati
mediante sostituzione
Cl/canforsulfonato (diastereoisomeri)
Nel complesso neutro, l’allile è il
nucleofilo
LEGANTI DIENICI: PtLCl2 E FeL(CO)3
C3-C4 1.42 Å
C4-C5 1.43 Å
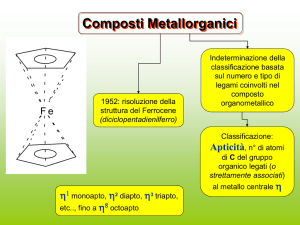
I METALLOCENI (MCp2)
I METALLOCICLOPENTADIENI
APPLICAZIONI DEI METALLOCICLOPENTADIENI
(1)
Composti a trasferimento
di carica, con allineamento
degli spin
Sequestro e rilascio di ioni regolato dalla
ossidazione del Fe
Terapia antitumorale
APPLICAZIONI DEI METALLOCICLOPENTADIENI
(2)
I METALLO-INDENILI E LA POLIMERIZZAZIONE
PROCESSI DINAMICI
Fe(CO)2(h5-C5H5)(s-C5H5)
Ti(h5-C5H5)2(s-C5H5)2
LEGANTI ANALOGHI AL Cp
Cp* = Me5C5; maggior ingombro
sterico, impossibilità di Interazione
coi legami C-H, campo più forte:
Es.: MnCp2 alto spin,
Mn(Cp*)2 basso spin
I METALLOARENI M(C6H6)2
•
3 CrCl3 + 2 Al + 2 C6H6 3 [Cr(C6H6)2]+
[Cr(C6H6)2]+ + S2O42- [Cr(C6H6)2]
Le distanze C-C sono tutte
uguali. I due anelli sono
“eclipsed”
La reattività è modificata, in
accordo con una minor densità
elettronica
LEGAME QUINTUPLO Ar-Cr-Cr-Ar
Cr-Cr 1.85 Å
POLIENI SUPERIORI (C>6)
C60 COME LEGANTE
Os3(CO)11(h2-C60)
Os3(CO)8(PPh3)(m3-h6-C60)
Os5C(CO)12(PPh3)(m2-h4-C60)
Fe(C5H5)(h5-C60Me5)
CARBENI =CR2 E CARBINI CR
Carbene di Fischer R = sostituenti elettronattrattori, C elettrofilo
Carbene di Schrock R = alchile o idrogeno, C nucleofilo
CARBENI: CARATTERISTICHE STRUTTURALI
I dati strutturali dipendono da quale
formula di risonanza è preponderante.
In genere:
Il C è planare (sp2)
M-C è corta (doppio legame)
C-X è corta
SINTESI DI CARBENI DI FISCHER
1- Un nucleofilo, seguito da un
elettrofilo; reazione più facile
sugli isonitrili (CN-R)
2- Addizione di H+
REAZIONI DEI CARBENI DI FISCHER
1 - Sostituzione nucleofila al
carbonio
2 – Scambio H/D (acidità)
3 – transfer di carbeni
SINTESI DEI CARBENI DI SCHROCK
1 - Alchilazione e a-eliminazione
2 - Astrazione di H+
3 - Astrazione di H-
REAZIONI DEI CARBENI DI SCHROCK
Con un alchene:
metallaciclobutano e
somma
Con un chetone: (cf. Wittig)
Con un estere (reag. di Tebbe)
Un carbene “a metà strada”
NHC : CARBENI ETEROCICLICI
The σ-withdrawing and π-donating effects of the nitrogen heteroatoms help to
stabilize the singlet carbene structure
CARBENI E CARBINI A PONTE
CH2I2 + [Fe2(CO)8]2- Fe2(CO)8(m-CH2)+ 2 ICo2(CO)8 + CHCl3 Co3(CO)9(m3-CH)
LA SOMMA OSSIDATIVA: LnM + A-B B-LnM-A
Di solito, lo stato di ossidazione e il numero di coordinazione del metallo
aumentano di due unità
Il “complesso di Vaska”: Ir(CO)Cl(PPh3)2
Si sommano i legami H-H, H-X, X-X, C-X, O-O, S-H, Si-H; Hg-Cl, S-S, Sn-X
Si sommano i legami C-C
tensionati:
Un complesso a 18 elettroni deve dissociare per lasciare posto ai due leganti entranti:
Pt(PPh3)4 + Ph3SnCl [(PPh3)2PtClSnPh3] + 2 PPh3
In un complesso a 17 elettroni, può avvenire una reazione binucleare:
MeI + 2 [Co(CN)5]3- Co(CN)5I]3- + [Co(CN)5Me]3-
IL MECCANISMO: 1 ADDIZIONE CONCERTATA
l’addizione avviene in cis, il
complesso sigma è
l’intermedio, il CO rimane
nel piano equatoriale
dell’intermedio TBP
Nell’addizione di diossigeno si forma uno ione
superossido. L’addizione è reversibile se X = Cl,
irreversibile se X = I
COMPLESSI s E SOMMA OSSIDATIVA
Un idruro «non classico» può
rappresentare stadi diversi nel
processo di somma
Il «profilo» della somma ossidativa del
legame C-H (posizioni calcolate)
IL MECCANISMO: 2 SOSTITUZIONE NUCLEOFILA
[Rh(CO)2I2]- + CH3I [trans MeRh(CO)2I3]-
Il metallo funge da base di Lewis. Se la reazione si ferma al primo
intermedio è più corretto definirla addizione elettrofila.
DS < 0 in un processo associativo
IL MECCANISMO: 2 SOSTITUZIONE NUCLEOFILA
RX + Ir(CO)Cl{P(p-C6H4Y)3}2
La velocità di reazione dipende dai sostituenti Y
delle fosfine
●MeI
○PhCH2Cl
LA STEROCHIMICA DELLA SOSTITUZIONE
NUCLEOFILA
R e X sommano in trans al metallo. Si ha inversione di configurazione al
carbonio
Si determina la configurazione al carbonio nel prodotto finale. L’inversione
avviene nello stadio di somma ossidativa
IL MECCANISMO: 3 PROCESSO RADICALICO
• Electron transfer (redox a sfera esterna):
NiL4 NiL3 + L
NiL3 + R-X {NiL3+, RX-}
{Ni(I)L3+, RX-} RNiL2X + L
• A gabbia (terminazione immediata)
PtL3 PtL2 + L
PtL2 + RX X-PtL2▪ + R▪ X-PtL2-R
• A catena:
Ir(I)(CO)ClL2 + RX R-Ir(II)(CO)ClL2
R-Ir(II)(CO)ClL2 + R-X RIr(III)(CO)ClL2X + R▪
SOMMA OSSIDATIVA DI LEGAMI C-H
A solution of (h-C5H5)Ir(CO)2 in
perfluorohexane under methane (ca. 10 atm)
was irradiated for 6 h. From IR and NMR the
only new compound in solution was
(h-C5H5)Ir(CO)(H)CH3 (3a). From NMR
intensities, the yield was ca. 20%
COMPLESSI CICLOMETALLATI PER GLI OLED
La ciclometallazione:
All cyclometalates are anionic, so that these ligands offer very strong M–C covalent interactions as well as highly stabilized
ligand-field. One important consequence regarding the photophysics is that the energy of the higher lying metal-centered d–d
excited states in these complexes, which generally serves as a major nonradiative deactivating channel, is raised substantially
Preparation of highly efficient, true-blue phosphorescent complexes has been long considered as a formidable challenge.
This task is far more difficult than those for preparing longer wavelength emission deriving from green, orange and red
phosphors
ELIMINAZIONE RIDUTTIVA.1
B-LnM-A LnM + A-B
È difficile isolare prodotti stabili:
2 cis-PtH(Me)L2 Pt + PtL4 + 2 CH4 (-25°)
L’eliminazione può essere indotta da dissociazione di un legante (l’intermedio
pentacoordinato è meno rigido):
ELIMINAZIONE RIDUTTIVA.2
Possono eliminare solo due gruppi in cis.
>
>
In trans-PdL2(Me)2 l’isomerizzazione precede l’eliminazione:
ELIMINAZIONE RIDUTTIVA.3
L’eliminazione può essere indotta dal CO, gli acili eliminano più facilmente degli
alchili:
CpCoMe2L + CO CpCo(COMe)MeL
CpCo(COMe)MeL + CO CpCo(CO)L + MeCO-Me
Eliminazione binucleare:
DOs(CD3)(CO)4 {DOs(COCD3)(CO)3}
DOs(COCD3)(CO)3-H-Os(Me)(CO)4 DOs(CO)4Os(Me)(CO)4 + CD3-H
Coupling ossidativo due alcheni ( o alchini) coordinati formano un legame C-C:
INSERZIONE
Inserzione 1,1 o 1,2.
In genere i leganti h1 danno inserzione 1,1 (Es. CO)
I leganti h2 danno inserzione 1,2 (Es. alcheni)
SO2 dà entrambi i tipi di inserzione.
Lo stato di ossidazione del metallo non cambia, il conteggio elettronico
diminuisce di due unità
CINETICA DELL’INSERZIONE
Stato stazionario: L’’intermedio non si accumula d[Int]/dt = 0
k1[Rgt]- k-1[Int]- k2[Int][L] = 0
[Int] = k1[Rgt]/{k-1+ k2[L]}
v = k2[Int][L] = k2 k1[L] [Rgt]/{k-1+ k2[L]}
Due casi limite (cfr. con meccanismo dissociativo):
k-1 >> k2[L] Cinetica del secondo ordine, lo stadio lento è l’attacco di L
k-1 << k2[L] Cinetica del primo ordine v = k1[Rgt]
Se L = 13CO, il nuovo legante entra in cis.
La retro-inserzione permette di determinare qual è il gruppo che migra:
Lo studio originale (1967)
è stato fatto per IR
Gruppi elettron-attrattori rallentano la reazione. Acidi di Lewis (AlCl3, Na+,
etc.) si coordinano al CO e la accelerano. La configurazione al carbonio
non si inverte.
Alchile > Benzile > Vinile, Arile
L’INSERZIONE SEGUITA VIA 13C-NMR
In seguito a migrazione, il *CO marcato va
in posizioni specifiche:
Lo spettro 13C-NMR dell’alchile (a) e dell
acile (b): senza arricchimento preferenziale,
il rapporto tra i segnali cis/trans = 4
[Mn(CO)5]- + Me*COCl
Mn(CO)5(*COMe)
cis-Mn(Me)*CO(CO)4 + CO
Il rapporto
sperimentale è
Cis/trans = 2 ± 0.1,
compatibile con la
migrazione del Me
INSERZIONE STEREOSPECIFICA
CO e R migrano, in funzione del solvente.
La reazione è catalizzata da acidi di Lewis
(BF3, ultime righe)
ALTRE INSERZIONI
Alcheni: H e alchene
devono essere in cis,
quasi coplanari
La rarità di inserzione degli alcheni nei legami M-C (oligomerizzazione)
è dovuta a fattori cinetici. kH/kEt = 106-108
ALTRE INSERZIONI
SO2: attacco elettrofilo di un acido di Lewis al carbonio. Non è necessario
un sito libero su M. Si formano due isomeri
Inserzione 1,2 di CO2: [MeW(CO)5]- + CO2 [(CO)5W-O-C(O)-Me]Gli isocianati danno facilmente poli-inserzione:
CATALISI E STUDI COMPUTAZIONALI
ISOMERIZZAZIONE DI ALCHENI
Tutti gli stadi sono reversibili: si
produce una miscela in cui
prevalgono i prodotti
termodinamicamente più stabili
(alcheni interni invece di terminali).
Occorrono un idruro ed un sito
vacante (meccanismo a)
oppure due siti vacanti (mecc. b)
IDROGENAZIONE DI ALCHENI
Il catalizzatore di
Wilkinson: RhCl(PPh3)3.
L’etilene forma un
complesso stabile e non
viene idrogenato. Alcheni
ingombrati non si
coordinano. Se la fosfina è
poco ingombrante, il
catalizzatore è meno attivo
IDROGENAZIONE DI ALCHENI
In questo schema, le sostanze all’interno della linea tratteggiata sono gli intermedi
proposti del ciclo catalitico. Tutti i composti che sono stati isolati o individuati in
soluzione stanno al di fuori del ciclo principale. Questo non è generale; in molti altri
casi sono stati osservate specie che appartengono direttamente al ciclo catalitico
principale. Comunque, questo studio dimostra che l’assenza di dati cinetici può
portare a interpretazioni scorrette. «Only when kinetic and thermodynamic
measurements define the role of complexes along the actual reaction path can the
mechanism be defined».
PROCESSI DINAMICI: RhCl(PPh3)3
A: il cat di Wilkinson.
B: dopo la somma ossidativa di H2
B’: come B, a bassa T
C: in atmosfera inerte (si torna ad A)
In nessun caso è presente PPh3 libera
IDROGENAZIONE ASIMMETRICA
Si usano fosfine chelanti chirali. La chiralità è di solito al carbonio:
In seguito a coordinazione
si formano più centri
stereogenici; tra i vari
diasteroisomeri, uno
reagisce più velocemente
BINAP
IDROGENAZIONE ASIMMETRICA
Per idrogenazione del doppio legame si
ottiene L-DOPA
In questo caso il complesso più stabile (più
abbondante) è il meno attivo:
DDG‡ = 3.7 Kcal/mol; e.e = 90 %
The Nobel Prize in Chemistry 2001
S. Knowles and Ryoji Noyori "for their work on chirally catalysed
hydrogenation reactions"
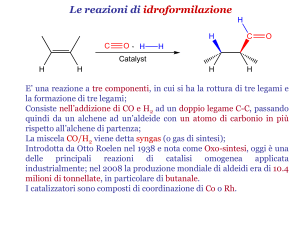
IDROFORMILAZIONE
R-CH=CH2 + CO + H2 R-CH2-CH2-CHO + CH3-CHR-CHO
Attualmente, si usano complessi di rodio e fosfiti P(OR)3, ottenendo aldeidi lineari
IL PARAIDROGENO p-H2
I segnali NMR dei protoni, subito dopo reazione con p-H2, hanno intensità
aumentata (fino a 30000 volte) e fase invertita. Es: idroformilazione con Ir
CARBONILAZIONE DEL METANOLO
CH3OH + CO CH3-COOH
Il catalizzatore è [Rh(CO)2I2]-, il co-catalizzatore HI
PROCESSO WACKER
CH2=CH2 + ½ O2 CH3-CHO
v = k[C2H4][PdCl42-]/[H+][Cl-]2
La marcatura isotopica ha dimostrato che
la configurazione al C si inverte, e che
non si scambiano H col solvente
Quattro processi redox, O2 ossidante
stechiometrico, Cu2+ catalitico
PROCESSO WACKER: CICLO COMPLETO
L’effetto trans dell’etilene è
maggiore dell’effetto trans
del Cl, si deve formare
trans-Pd(H2O)(C2H4)Cl2
The Nobel Prize in Chemistry 2010
R. F. Heck, E. Negishi, A. Suzuki
Richard F. Heck Ei-ichi Negishi, Purdue University, West Lafayette, Indiana, USA,
and Professor (emeritus) Akira Suzuki, Hokkaido University, Sapporo, Japan. The
Royal Swedish Academy of Sciences is rewarding the three chemists for:
“palladium-catalyzed cross couplings in organic synthesis”. The discoveries by the
three organic chemists have had a great impact on academic research, the
development of new drugs and materials, and are used in many industrial chemical
processes for the synthesis of pharmaceuticals and other biologically active
compounds.
24 riferimenti di letteratura Ni(PPh3)2Cl2 and Heck/Suzuki
LA METATESI DI ALCHENI
Scambio di sostituenti di due alcheni. È catalizzata da complessi dei metalli dei gruppi
5-6. Es MoCl6, WCl6; co-catalizzatori agenti alchilanti quali AlMe3; o da carbeni
preformati.
APPLICAZIONI DELLA METATESI
• Sintesi di olefine terminali:
R-CH=CH-R’ + CH2=CH2 CH2=CH-R’ + CH2=CH-R
• Sintesi di olefine di interesse commerciale:
IL MECCANISMO DELLA METATESI
Due meccanismi possibili: a) ciclobutano coordinato b) metallaciclobutano (di
Chauvin)
METATHESIS DANCES
http://www.hitteam.net/index.php?lang=en&page=
metathesis
IL MECCANISMO DELLA METATESI
Anche all’inizio si forma il
diene misto (C14):
EVOLUZIONE DEI CATALIZZATORI
Catalizzatori a base di Ru resistenti all’ossigeno e all’umidità, compatibili
con altri gruppi funzionali.
EVOLUZIONE DELLA METATESI
Catalisi enantioselettiva: (ROM, RCM):
Alkyne & Enyne metathesis:
Cross metathesis: