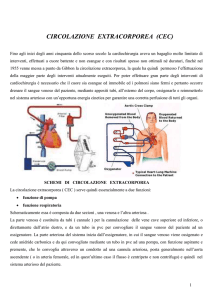
PRINCIPI DI PERFUSIONE CARDIOPOLMONARE
Augusta Pelosi, DVM, Diplomate ACVS
Dipartimento di Cardiologia – Sezione di Cardiochirurgia
Michigan State University, East Lansing, Michigan
Lo sviluppo attuale di questa tecnologia ha una storia lunga che comincia nel 1930 con il
Dott. Gibbon, ma dobbiamo aspettare fino al 6 maggio 1953 per avere la prima chirurgia
a cuore aperto compiuto dallo stesso Dott John Gibbon all'Università del Minnesota.
In ambiente ospedaliero e’ un tecnico di fisiopatologia cardiocircolatoria e perfusione
cardiovascolare a far funzionare la macchina.
Il sistema bypass come si evince dal termine stesso, ha la funzione di sostituire il cuore
come pompa e i polmoni per le funzioni di scambio di gas durante un intervento a cuore
aperto.
La macchina per il cardiopulmonary bypass puo’ essere accessoriata con molteplici parti
aggiuntive ma ci sono componenti di base, fondamentali per il suo funzionamento:
1. Pompe
2. Ossigenatori
3. Heater and cooler
4. Serbatoio artero-venoso
5. Tubatura
6. Cannule
Pompe
Esistono due tipi principali di pompe usate in percentuali diverse in America e Europa.
Rotatorie
Possono essere singole, doppie o multiple. La pompa ha all’interno un meccanismo
rotatorio che permette la compressione costante di una parte di tubo del circuito.
L’occlusione continua del tubo permette di generare sia pressione negativa che positiva,
rendendo pertanto possibile la propagazione del sangue in avanti ma anche il suo uso per
l’aspirazione di liquidi dall’area chirurgica. Gli svantaggi di questo sistema sono:
eccessiva o inappropriata occlusione, miscalibration, frattura del tubo, perdita di energia,
tromboembolismo.
Radiali o centrifughe
1
Consiste in un nido di coni lisci di plastica o una ventola localizzati in un contenitore di
plastica. Il principio di funzionamento si basa sulla capacita’ di creare un gradiente
pressorio tra l’entrata e l’uscita della pompa. La pressione differenziale provoca il
movimento di fluido. Questo gradiente e’ creato da un vortice generato dalla rotazione
della pompa ad alti rpm. Il vortice determina un’ area di bassa pressione nel centro e una
zona di alta pressione all’ esterno. E’ in genere associato a un rischio contenuto di
embolismo. I principali svantaggi sono il bisogno di un misuratore di flusso, la
possibilita’ di flusso retrogrado quando la pompa rallenta o si ferma. A causa del suo
principio di funzionamento, la pompa, fortemente dipendente dall’afterload, e’ pertanto
fortemente influenzata da cambi in resistenza sia nel paziente che nel circuito. I maggiori
vantaggi nell’uso di queta pompa risiede nell’essere non-occlusiva e pertanto non indurre
il fenomeno chiamato ”spallation”.
Ossigenatori
Rappresentano la parte del circuito responsabile dello scambio gassoso dando ossigeno e
una percentuale di gas anestetico e rimuovendo anidride carbonica. Gli ossigenatori usati
nelle normali chirurgie cardiache, dovrebbero essere limitate a 6 ore. Ossigenatori usati
per periodi piu’ lunghi sono chiamati extracorporeal life support (ECLS) o extracorporeal
membrane oxygenator (ECMO). Esistono delle differenze fondamentali rispetto al
processo di ossigenazione che avviene a livello polmonare a cui provvede l’ingegneria
nella costruzione di queste componenti.
Ossigenatori a “Bubble”.
L’ossigenatore e’ diviso in due parti. Il sangue privo di ossigeno entra passivamente in
una zona dove viene mescolato. L’ ossigeno viene immesso nel flusso ematico causando
la formazione di piccole bollicine. L’ossigeno si unisce al sangue spiazzando l’anidride
carbonica. A questo punto il sangue entra in una seconda area, un serbatoio arterioso,
dove le bollicine di gas che hanno assunto un aspetto di schiuma gassosa, vengono
rimosse dall’azione di una liquido a base di silicone che destabilizza le bolle facendole
implodere. In questo sistema lo scambio di calore avviene nello stesso momento in cui
avviene lo scambio gassoso.
Ossigenatori “a membrana”.
Rappresentano l’ unica forma attualmente usata di ossigenatori, in cui una barriera
semipermeabile produce una separazione tra il sangue e l’ossigeno. Questi ossigenatori
assomigliano a polmoni veri e propri ed offrono una barriera completa tra l’ ossigeno e le
2
fasi di sangue. Le membrane sono per lo piu’ formate con polivinilcloride (PVC) che
offre le migliori caratteristiche per lo scambio gassoso. Nei sistemi a lungo termine come
ECMO e il ECLS, il silicone e’ invece il materiale preferito. La membrana e’ costruita
con fibre vuote di PVC, precedentemente trattate per creare microcanali. La porosita’ di
questo materiale si perde quando la membrana entra a contatto con le proteine ematiche.
Lo scambio di calore avviene prima ed e’ seguito dallo scambio gassoso.
Heater and cooler
Aggiunge o rimuove calore dal sangue. Lo scambio avviene mediante acqua non - sterile
che circola attraverso un calorifero o unità refrigerante.
Serbatoio venoso
E’ un contenitore rigido, non collassabile dove viene accumulato il sangue di ritorno dalle
cannule venose. Da questo serbatoio si diparte il tubo che va alla pompa per poi ritornare
nell’ossigenatore e venir pompato attraverso la cannula arteriosa. Una prima eliminazione
di bolle di aria avviene a questo livello prima che il sangue venga pompato
nell’ossigenatore. Questo deposito rappresenta il centro di molte attivita’ durante il
bypass. Trasfusioni di sangue, farmaci e campioni di sangue per valutare ossigenazione
etc, avvengono in questo serbatoio.
Tubatura
Il diametro interno dei tubi e’ il fattore piu’ importante per la determinazione del
massimo flusso ematico ottenibile con un particolare circuito. La tubatura deve essere
costruita con materiale biocompatible: atossico, nonimmunogenico, nonallergico,
nonmutageno. Il materiale piu’ usato per i circuiti bypass e’ il silicone o il PVC. Da un
punto di vista meccanico il PVC sembra essere superiore per la sua durata nel tempo ma
da un punto di vista di biocampatibilita’ e resistenza a basse temperature, il silicone e’
superiore. La compressione costante puo’ produrre “fatigue” del materiale con rilascio di
microparticelle, questo processo di usura del materiale e’ chiamato “spallation”.
Cannulazione
Esistono diversi tipi di cannulazione fatti a livello vascolare per permettere un normale
flusso durante il bypass. Per comodita’ si possono dividere in questo modo:
Cannulazione arteriosa
Per questo tipo di cannulazione possono essere scelte diverse combinazioni dipendendo
dalle necessita’ e dal tipo di intervento. La piu’ comune e’ la cannulazione dell’aorta
ascendente. Delle altre forme di cannulazione, l’ arteria femorale e’ considerata come
3
prima scelta in pazienti umani che vanno incontro a interventi ripetuti e in pazienti
veterinari in cui si ha limitato spazio nella cavita’ toracica o se si sospetta che la parete
aortica non riuscirebbe a tollerare la presenza di una cannula.
La cannula viene mantenuta mediante una sutura a “purse string” nel muro aortico.
Attraverso un’ incisione nel vaso, la cannula e’ introdotta e diretta verso l’arco.
Cannulazione venosa
Queste cannule devono garantire il ritorno venoso al bypass. Le dimensioni devono
pertanto rispettare il normale ritorno venoso stimato per un paziente di un determinato
peso. La tipica cannulazione usata in pazienti umani e’ chiamata bicava, perche’ due
cannule sono inserite in ciascuna vena cava. In alcuni casi, la cannulazione singola dell’
atrio viene preferita. Altre forme di cannulazione prevedono l’uso di vene periferiche
come la giugulare e la femorale, raramente usate sia per un fattore estetico ma anche
perche’ necessitano l’uso di un sistema aspirante. In pazienti veterinari, la cannulazione
atriale singola sembra essere la piu’ semplice da un approccio laterale mentre una bicava
e’ probabilmente preferita nel caso di una sternotomia mediana.
Una “purse string” viene usata per fissare la cannula a livello della vena cava o dell’
atrio. La sutura viene poi chiusa intorno alla cannula a mo’ di laccio emostatico per
evitare che una parte del sangue passi intorno alla cannula e raggiunga la parte destra del
cuore.
LV vent
Normalmente la zona di entrata e’ nelle vene polmonari, ma puo’ anche essere inserita a
livello aortico o direttamente nel ventricolo sinistro. Mentre la parte destra del cuore e’
normalmente drenata dalla cannula venosa, la funzione di questa cannula nella parte
sinistra e’ di evitare un’ eccessiva dilatazione del cuore sinistro, un eccessivo aumento di
temperatura dovuto alla presenza di sangue, evitare l’espulsione di bolle d’aria e un
miglioramento della visualizzazione chirurgica. In condizioni normali, una quantita’ di
sangue dalle vene bronchiali e tebesiane e una piccola quantita’ di sangue dal cuore
destro si accumula nel ventricolo destro. Inoltre esistono condizioni patologiche che
possono rendere l’accumulo nel ventricolo sinistro ancora piu’ drammatico, le piu’
importanti sono un dotto arterioso pervio o uno shunt sistemico-arteria polmonare (come
un Blalock Taussig, Potts or Waterston), setti ventricolari o atriali, un drenaggio venoso
anormale nel cuore sinistro, rigurgitazione aortica.
4
Cannula per amministrazione della cardioplegia
La cardioplegia puo’ essere somministrata in maniera anterograda o retrograda con una
cannula nell’aorta ascendente o nel seno coronarico.
Cannula per aspirazione
Il sangue presente nel campo chirurgico e nelle cavita’ cardiache che, viene aspirato
durante la chirurgia, viene reintrodotto nel circuito mediante l’uso di cannule per la
suzione. Ne esistono di diversi modelli, vengono messi in funzione da una pompa che
permette l’aspirazione del sangue e il trasporto nel deposito venoso, dove si unisce al
resto del sangue.
Cardioplegia
L’infusione permette di ridurre al minimo il danno miocardico durante il clampaggio
aortico mediante infusione di una soluzione fredda nel letto vascolare coronarico.
In caso di mancata protezione, il danno miocardico irreversibile puo’ manifestarsi dopo
solo 20 minuti, anche se esiste un certo margine di protezione garantito dal livello di
ipotermia raggiunto. In questo modo i tempi di ischemia possono essere sensibilmente
prolungati al punto che periodi di arresto di tre-quattro ore vengono tranquillamente
tollerati dai tessuti senza che vi sia la minaccia di un danno irreversibile. Diverse
tipologie di soluzioni cardioplegiche sono attualmente usate. Per convenienza è possibile
distinguerle in due principali gruppi:
Cardioplegia cristalloide
Cardioplegia cristalloide-ematica
La cardioplegia cristalloide fredda è stata la prima ad essere sperimentata ed e’
caratterizzata da una componente completamente cristalloide e da una temperatura di
somministrazione di circa 4°C. Nella famiglia delle cristalloidi è possibile distinguere fra
soluzioni intracellulari ed extracellulari. Le soluzioni intracellulari, caratterizzate dalla
bassa concentrazione di sodio e procaina e dall'assenza dello ione calcio, inducono
l'arresto cardiaco riducendo i gradienti ionici transmembrana. L'osmolarità viene
mantenuta con l'aggiunta di mannitolo nella soluzione. Le soluzioni extracellulari
agiscono variando le concentrazioni ioniche extracellulari aumentando nello specifico le
concentrazioni extracellulari di potassio. In tal modo si produce un'iperpolarizzazione di
membrana che arresta il cuore in diastole mantenendo uno stato di quiescenza elettrica.
5
Questa soluzione è stata successivamente modificata a costituire una parte ematica ed una
cristalloide secondo un rapporto che tipicamente e’ di 4:1. La parte ematica è
rappresentata dal sangue autologo proveniente dall'ossigenatore che si combina
direttamente con la composizione cristalloide. Il raffreddamento della soluzione avviene
per passaggio in uno specifico scambiatore di calore, impostato a seconda del protocollo
ad una temperatura tra i 4-12°C. Ciò permette una somministrazione di tipo intermittente.
Attualmente questa soluzione e’ probabilmente la piu’ usata in ambiente clinico. I
vantaggi sono rappresentati dalle seguenti proprieta’ della soluzione:
Sangue: veicolo di ossigeno, sistema tampone, proprietà osmotiche, substrato metabolico;
Cristalloide: composizione elettrolitica e pH fisiologici, presenza di antiossidanti e
stabilizzatori di membrana;
Temperatura: il freddo induce riduzione del metabolismo, riduzione richiesta di O2,
miglioramento della protezione miocardica.
Bibliografia
Gravlee GP, Davis RF, Stammers AH, Ungerleider RM. Cardiopulmonary Bypass.
Principles and practice. 3rd edizione; Philadelphia PA: Lippincott Williams & Wilkins
2008
Orton EC, McCracken TO. Small Animal Thoracic Surgery. Malvern, PA: Williams and
Wilkins 1995
Mavoudis C, Backer CL Pediatric Cardiac Surgery. 3rd edizione Mosby 2003
6