Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
Appunti di Cardiochirurgia
Capitolo 2
Circolazione extracorporea (CEC) e
Protezione miocardica
1
pagina- 1 -
Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
pagina- 2 -
Circolazione extracorporea (CEC)
La cardiochirurgia ha potuto progredire grazie allo sviluppo della circolazione extracorporea eseguita con la
macchina cuore-polmone.
Questa ha il compito di fornire energia per l’avanzamento anterogrado del flusso ematico nell’albero
circolatorio e assolve il compito di ossigenare e decarbossilare il sangue sostituendo quindi sia la funzione
di pompa di tutti e due i ventricoli destro e sinistro che dei polmoni per ciò che riguarda gli scambi gassosi.
Il fine dell’utilizzo di questo dispositivo è di poter operare sul cuore fermo e poter accedere alle strutture
intracardiache o vascolari nel periodo di arresto della circolazione ematica a tale livello.
Componenti e funzionamento della circolazione extracorporea (CEC )
Componenti della circolazione extracorporea:
Cannule: sono strutture cilindriche cave utilizzate per connettere la macchina cuore-polmone,
attraverso l’apposito circuito di tubi, all’albero circolatorio del paziente. Hanno la funzione di drenare il
sangue venoso dal corpo del paziente e reimmettere quello arterioso.
Circuito: si compone di tubi di diverso calibro, il cui materiale può essere silicone o PVC. Per avere
una maggiore biocompatibilità possono inoltre essere rivestiti al loro interno con eparina.
Reservoir e sistema di aspirazione: è formato da tubi che provvedono al drenaggio del sangue dal
paziente alla macchina cuore- polmone. A tale sistema può essere collegato un vuoto spinto per aumentare
la quantità di sangue drenato. Il sangue così drenato viene convogliato in un reservoir e poi una volta
riossigenato e decarbossilato, è reimmesso nel sistema arterioso del paziente .
Ossigenatore: assolve il compito di ossigenare e decarbossilare il sangue venoso.
Pompa: come già detto uno dei compiti più importanti della macchina cuore polmone è fornire
energia per l’avanzamento anterogrado del sangue nell’albero circolatorio durante la fase di arresto
cardiaco negli interventi cardiochirurgici. Specificamente questo compito è assolto da una pompa il cui
funzionamento viene controllato dal tecnico perfusionista durante l’intervento.
Esistono essenzialmente due tipi di pompe, peristaltiche e a levitazione magnetica.
Le pompe peristaltiche hanno il difetto di determinare un danno meccanico sugli elementi figurati del
sangue e non vengono per ciò utilizzate per interventi che richiedono l’utilizzo della macchina cuorepolmone per periodi di tempo prolungati.
Le pompe a levitazione magnetica hanno flusso continuo, causano minor danno meccanico agli elementi
figurati del sangue e sono utilizzate in quelle situazioni dove si presume che la macchina cuore polmone
2
Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
pagina- 3 -
debba essere utilizzata per periodi di tempo prolungati, come in caso di assistenza circolatoria tipo
ECMO/ECLS (extra corporeal membrane oxigenator /extra corporeal life support; capitolo 10)
Funzionamento della circolazione extracorporea
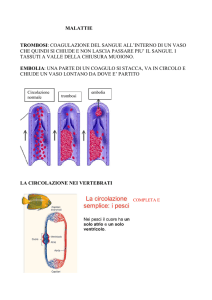
Durante la circolazione extracorporea (CEC) il sangue drena per gravità nel reservoir venoso della macchina
cuore-polmone attraverso le cannule posizionate nelle vene cave o una cannula in atrio destro. Dal
reservoir il sangue viene pompato, passando per un ossigenatore a membrana dove viene ossigenato e
decarbossilato, nel sistema arterioso solitamente attraverso una cannula posizionata in aorta ascendente.
Tale sistema può essere adattato a fornire un’assistenza circolatoria e respiratoria totale o parziale.
Completano il sistema le linee aspirative di campo (radice aortica, vent, aspiratore di campo), la linea di
infusione della cardioplegia, un filtro per emboli e bolle, ed uno scambiatore di calore.
Il drenaggio venoso: il sangue venoso entra nel circuito per gravità nel reservoir situato sotto al livello del
cuore di 40-70 cm. L’entità del drenaggio è determinata dalla pressione venosa centrale, la differenza di
altezza tra cuore e reservoir, la resistenza delle cannule e dei tubi e l’assenza di aria all’interno del sistema.
Per aumentare il ritorno venoso si può applicare un regolatore di vuoto nella chiusura rigida del reservoir:
questo si definisce drenaggio venoso vuoto-assistito. Cause di ridotto ritorno venoso possono essere: bassa
PVC (pressione venosa centrale), ipovolemia, venodilatazione farmaco indotta, altezza troppo ridotta tra
cuore e reservoir, calibro delle cannule venose troppo piccolo, ostruzione delle cannule per qualsiasi causa,
aria nella linea venosa, eccessiva resistenza al flusso nel sistema di drenaggio. Una parziale ostruzione della
linea di drenaggio venoso può causare distensione del ventricolo destro e danneggiarne la contrattilità.
Figura 2; 1: Schema della circolazione extracorporea
3
Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
pagina- 4 -
Siti di cannulazione
Per connettere la macchina cuore-polmone all’albero circolatorio del paziente devono essere inserite
apposite cannule allo scopo di drenare il sangue venoso e reimmettere quello arterioso.
I siti classici di introduzione delle cannule venose sono l’atrio destro e le vene cave superiori e inferiori (siti
di cannulazione centrale).
Di solito quando l’intervento chirurgico non prevede l’apertura delle cavità atriali e in particolare dell’atrio
destro, la cannulazione venosa è eseguita a livello dell’atrio destro. Quando invece deve essere eseguita
l’apertura delle cavità atriali è solitamente preferito il posizionamento di due cannuale di drenaggio venoso
a livello della vena cava superiore e inferiore ( cannulazione bicavale).
Può inoltre essere utilizzata una vena femorale (cannulazione periferica), di solito utilizzata quella destra.
Questo tipo di cannulazione è di abitualmente adottata negli interventi eseguiti con tecnica mini invasiva
sulla valvola mitrale.
I siti classici di introduzione delle cannule arteriose sono l’aorta ascendente (cannulazione centrale) e
l’arteria femorale o l’arteria ascellare/succlavia (siti di cannulazione periferica).
La maggior parte degli interventi cardochirurgici si esegue con la cannula arteriosa posizionata a livello
dell’aorta ascendente. L’utilizzo della cannulazione periferica è di solito riservato a situazioni particolari,
che non permettano il posizionamento della cannula arteriosa in aorta ascendente.
Nel caso di dissezione dell’aorta ascendente o di intervento di sostituzione dell’arco aortico si esegue di
solito la cannulazione arteriosa a livello dell’arteria succlavia o femorale.
Negli interventi di chirurgia mini invasiva si esegue generalmente la cannulazione dell’arteria femorale.
Eparinizzazione
Affinché non si attivi la coagulazione quando il sangue passa all’interno dei tubi che costituiscono il circuito
della circolazione extracorporea è necessario effettuare una scoagulazione totale del paziente. A tale scopo
si somministrano 3-4 mg di eparina per kg di peso corporeo del paziente per ottenere un ACT (activated
clotting time) maggiore di 400 “ in normotermia, e >480” in ipotermia ( al di sotto di 30°C).
Al termine della CEC l’eparina viene antagonizzata con la protamina con un dosaggio di 1-1,5 mg di
protamina per ogni mg di eparina.
4
Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
pagina- 5 -
Meccanismi dei danni d’organo causati dalla circolazione extracorporea
I principali meccanismi di danno d’organo secondario alla circolazione extracorporea sono l’ipoperfusione e
l’embolia causata da microemboli . Inoltre l’eccessiva emodiluizione con Hb sotto 8g/dl può causare
riduzione dell’apporto di ossigeno ai tessuti e conseguente disfunzione d’organo. Per ciò che riguarda la
perfusione regionale questa è difficilmente monitorizzabile: viene influenzata da diversi fattori quali la
risposta infiammatoria alla CEC che causa il rilascio di sostanze vasoattive, la variazione del pH in ipotermia
che comporta una riduzione della perfusione cerebrale, inoltre anche differenze di temperatura tra diversi
distretti anatomici possono causare ipoperfusione con acidosi dovuta ad un inadeguato apporto di
ossigeno.
Fattori predisponenti ad una ridotta perfusione locale sono diabete mellito, vasculopatia periferica, età
avanzata, intervento in emergenza, re-intervento, intervento chirurgico lungo e complesso con CEC
prolungata. A livello gastrico la CEC causa riduzione del pH, perciò prima dell’utilizzo degli antiacidi l’ulcera
peptica ed il sanguinamento gastrointestinale erano complicanze frequenti nel post-operatorio.
Sindrome da risposta infiammatoria sistemica secondaria alla circolazione extracorporea.
Rappresenta una condizione messa in atto dall’organismo come risposta all’intervento chirurgico e alla CEC.
Consiste in una reazione infiammatoria sistemica e aspecifica. Si manifesta in genere entro la quinta
giornata post-operatoria con almeno due tra i seguenti sintomi e segni: una temperatura corporea
maggiore di 38C°, frequenza cardiaca maggiore di 90 battiti al minuto, una frequenza respiratoria maggiore
di venti atti al minuto o una PCO2 inferiore a 32 mmHg, leucocitemia maggiore di 12000 o minore di
4000/mm3, presenza di neutrofili immaturi maggiore del 10%.
Il processo fisiopatologico che sta alla base di tale sindrome è costituito da varie componenti:
prima di tutto il trauma chirurgico, la venuta a contatto del self con le superfici non biologiche del circuito
della CEC, il meccanismo da ischemia- riperfusione, il danno endoteliale.
Tutti questi fattori determinano l’attivazione del complemento, causando il rilascio di citochine pro
infiammatorie, che concorrono dunque allo scatenarsi della sindrome da risposta infiammatoria sistemica.
Questi fenomeni possono inoltre causare un danno a livello endoteliale, con riduzione della produzione di
NO e aumento della permeabilità vasale.
Ciò comporta un rischio di trombosi del microcircolo che può determinare un danno d’organo.
In particolare questo può avere luogo nel processo fisiopatologico della sindrome da bassa portata cardiaca
post CEC secondario al fenomeno dell’ ischemia – riperfusione (stunning miocardico cap. 7)
5
Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
pagina- 6 -
Protezione miocardica
Le metodologie di protezione miocardica mirano a prevenire la disfunzione miocardica postischemica che
può avvenire durante e dopo la chirurgia cardiaca. La disfunzione miocardica postischemica è attribuibile al
fenomeno noto come danno da riperfusione che si manifesta clinicamente con lo stato di bassa portata
cardiaca che può essere reversibile o irreversibile.
Tra le metodologie di protezione miocardica distinguiamo fondamentalmente due tipi: protezione
miocardica senza l’uso di soluzioni cardioplegiche e protezione miocardica con l’utilizzo di soluzioni
cardioplegiche.
Protezione miocardica senza l’uso di soluzioni cardioplegica: ad oggi vengono utilizzate da una
minoranza di centri tuttavia con buoni risultati in letteratura per eseguire interventi di rivascolarizzazione
miocardica:
A) clampaggio aortico intermittente con fibrillazione ventricolare ad ipotermia moderata di 30C°-32C°
diverse serie di CABG riportate in letteratura mortalità in elezione 0,6%;
B) ipotermia sistemica 28 C° e induzione di fibrillazione ventricolare. Questa tecnica è limitata dalla
possibilità che il sangue oscuri il campo operatorio durante la rivascolarizzazione, l’aumento del tono
muscolare durante la fibrillazione ventricolare può limitare la lussazione cardiaca e quindi causare cattiva
esposizione dei vasi da trattare e generalmente non applicabile per le procedure intracardiache.
Protezione miocardica con l’utilizzo di soluzioni cardioplegiche: contengono una varietà di agenti
chimici in particolare potassio, concepite per determinare un rapido arresto cardiaco in diastole, ottenere
un campo operatorio con quiescenza meccanica, e proteggere il miocardio dal danno da riperfusione postischemica. Esistono fondamentalmente due tipi soluzioni cardioplegiche ematiche e cristalloidi.
A) tra le soluzioni cardioplegiche cristalloidi distinguiamo due tipi: soluzioni intracellulari e soluzioni
extracellulari (es. Celsior, St Thomas 2). Entrambe hanno una concentrazione di potassio tra i 10/20 mlEq/L.
Vengono riportati ottimi risultati in letteratura con una mortalità inferiore al 2%. Soluzioni intracellulari
come la custudiol vengono maggiormente utilizzate negli interventi in cui si prevede un lungo tempo di
clampaggio.
B) La soluzione cardioplegica ematica fredda è attualmente il metodo di protezione miocardica
maggiormente utilizzato.
Questa è preparata mischiando sangue autologo con una soluzione cristalloide ad alta concentrazione di
potassio e quindi somministrata ad una temperatura tra 12C° e i 4C°. I risultati sono buoni ma non migliori
rispetto alla cardioplegia cristalloide. Il razionale per cui la cardioplegia ematica è oggi cosi largamente
6
Appunti di Cardiochirurgia Capitolo 2 circolazione extracorporea
pagina- 7 -
impiegata sta in alcune caratteristiche quali: fornisce ossigeno al miocardio durante il tempo di clampaggio
aortico, riduce l’emodiluizione che altrimenti si avrebbe somministrando cardioplegia cristalloide, ha un
eccellente funzione tampone, ha un eccellente proprietà osmotica, il pH e la composizione degli elettroliti è
fisiologica (tranne il potassio), contiene antiossidanti endogeni ed è più facile da preparare.
C) Cardioplegia ematica calda (normotermica): vengono riportati in letteratura eccellenti risultati con
mortalità dello 0,9%. Rispetto alla ematica fredda si ha una più rapida ripresa della contrattilità miocardica
al termine del clampaggio aortico.
D) E’ inoltre riportata da alcuni autori l’utilizzo di cardioplegia ematica “tiepida”somministrata a 30C°. gli
studi effettuati sono stati finora di singoli centri con una corte relativamente piccola di pazienti,
dimostrando comunque risultati paragonabili con la cardioplegia ematica fredda e calda.
7