CIRCOLAZIONE EXTRACORPOREA (CEC)
Fino agli inizi degli anni cinquanta dello scorso secolo la cardiochirurgia aveva un bagaglio molto limitato di
interventi, effettuati a cuore battente e non esangue e con risultati spesso non ottimali né duraturi, finchè nel
1955 venne messa a punto da Gibbon la circolazione extracorporea, la quale ha quindi permesso l’effettuazione
della maggior parte degli interventi attualmente eseguiti. Per poter effettuare gran parte degli interventi di
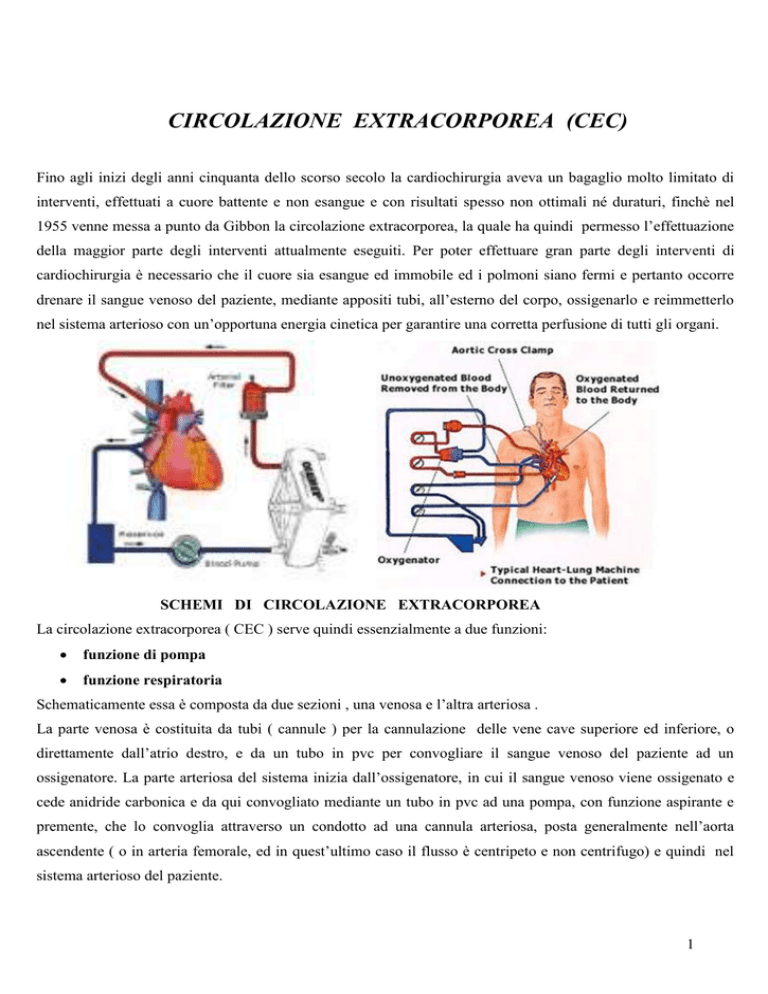
cardiochirurgia è necessario che il cuore sia esangue ed immobile ed i polmoni siano fermi e pertanto occorre
drenare il sangue venoso del paziente, mediante appositi tubi, all’esterno del corpo, ossigenarlo e reimmetterlo
nel sistema arterioso con un’opportuna energia cinetica per garantire una corretta perfusione di tutti gli organi.
SCHEMI DI CIRCOLAZIONE EXTRACORPOREA
La circolazione extracorporea ( CEC ) serve quindi essenzialmente a due funzioni:
funzione di pompa
funzione respiratoria
Schematicamente essa è composta da due sezioni , una venosa e l’altra arteriosa .
La parte venosa è costituita da tubi ( cannule ) per la cannulazione delle vene cave superiore ed inferiore, o
direttamente dall’atrio destro, e da un tubo in pvc per convogliare il sangue venoso del paziente ad un
ossigenatore. La parte arteriosa del sistema inizia dall’ossigenatore, in cui il sangue venoso viene ossigenato e
cede anidride carbonica e da qui convogliato mediante un tubo in pvc ad una pompa, con funzione aspirante e
premente, che lo convoglia attraverso un condotto ad una cannula arteriosa, posta generalmente nell’aorta
ascendente ( o in arteria femorale, ed in quest’ultimo caso il flusso è centripeto e non centrifugo) e quindi nel
sistema arterioso del paziente.
1
Le cannule aortiche possono essere rette o curve; le cannule venose possono essere una per la vena cava
superiore ed una per la cava inferiore, oppure un’unica cannula, detta “ two – stage “, posta in atrio destro e che
drena ambedue le cave: in genere negli interventi in cui si deve operare sulle valvole mitrale o tricuspide si
utilizzano due cannule venose, mentre negli interventi di rivascolarizzazione miocardica o in quelli sulla valvola
aortica si può utilizzare la cannula unica.
Le cannule vanno inserite previo confezionamento di borse di tabacco ( suture circolari a funzione emostatica ),
singole oppure doppie e concentriche come nel caso della cannulazione aortica.
CANNULE ARTERIOSE
Nella macchina cuore – polmoni ci sono 4 moduli uguali e interscambiabili, destinati a diverse funzioni: il 1°
modulo ha funzione di pompa; il 2° e 3° modulo svolgono la funzione di aspiratori ( uno detto “pericardico”,
che aspira il sangue che si raccoglie durante l’intervento nel sacco pericardico, e l’altro detto “vent o aspiratore
endoventricolare” che può essere inserito in aorta ascendente, in vena polmonare o in arteria polmonare); il 4°
modulo serve ad infondere la soluzione cardioplegica .
MACCHINA CUORE - POLMONI
2
I circuiti della CEC sono in PVC e tra il circuito arterioso e venoso esiste un filtro detto pre by-pass che presenta
una griglia a fori molto sottili ( < 5 micron ) che serve ad eliminare qualsiasi impurità e che viene rimosso prima
di collegare il paziente alla macchina.
Per evitare l’attivazione della coagulazione del sangue che passa attraverso i circuiti, si provvede
preventivamente ad anticoagulare il paziente iniettando nell’auricola destra 3 mg/Kg di eparina e controllando
dopo alcuni minuti che il tempo di coagulazione attivato ( TCA ) sia tra 480 e 560. A fine intervento l’eparina
viene poi neutralizzata con cloridrato di protamina, stando molto attenti ad eventuali reazioni allergiche ( essa
viene somministrata in arteria o in vena molto lentamente e si neutralizzano circa i 2/3 della quantità di eparina
somministrata ).
PRIMING
Allorchè si debba iniziare una CEC, è necessario che i circuiti siano riempiti di liquido ( priming ). Quando la
CEC fu messa a punto si utilizzavano solo sacche di sangue da donatore con conseguenti possibili reazioni
trasfusionali, complicanze infettive, carenza di fattori della coagulazione, carenza di ossigenazione per ridotto
quantitativo di 2,3 DPG, ma successivamente sono utilizzate varie soluzioni cristalloidi ( soluzioni fisiologiche,
soluzioni glucosate, soluzioni elettrolitiche, plasma – expanders, bicarbonato, eparina, mannitolo ) ottenendo
così un’emodiluizione normovolemica. che riduce il consumo di sacche di sangue durante l’intervento e nel
contempo la viscosità del sangue stesso.
I vantaggi di quest'emodiluizione sono quelli di eliminare i rischi dovuti all’utilizzo di sacche di sangue da
donatore, abbassando l’ematocrito fino anche al 20% ( con buon trasporto di O2 ), e di ridurre la viscosità del
sangue con conseguente miglioramento della perfusione periferica e del microcircolo, riduzione dell’emolisi e
minor rischio trombotico.
L’emodiluizione viene generalmente corretta da un'opportuna stimolazione della diuresi del paziente durante e
dopo la CEC e nel decorso post - operatorio.
POMPE
Nel 1955 Kirklin e coll. dimostrarono che un flusso di 2,4 l/min/m² ed una pressione arteriosa media di 50 – 60
mm hg durante la CEC erano sufficienti ad ottenere una adeguata perfusione.
Il modulo di pompa assicura un flusso di sangue tra 2,2-2,5 l/min./mq di superficie corporea in normotermia,
fino a 1,2 l/min/mq in ipotermia.
La pompa roller ha due cilindri, montati su un rotore, i quali tramite la compressione sul tubo determinano il
flusso all’interno dei circuiti, flusso che è continuo e non pulsatile come nella circolazione fisiologica, a
pressioni di 60 – 90 mm hg: questa azione meccanica può causare anche emolisi ( per cercare di ridurre
l’emolisi, si opera in maniera “non occlusiva” ).
Le pompe roller consentono portate superiori ai 6 l/min ed un flusso indipendente dalle resistenze vascolari del
paziente.
3
POMPA ROLLER
Esiste anche la pompa centrifuga, nella quale la rotazione di palette all’interno di una “campana” trasforma
l’energia elettromagnetica in energia meccanica determinando un flusso continuo,che è regolato sia dal pre- che
dal post - carico: un ostacolo a monte o a valle fa ridurre o arrestare il flusso ed il rischio di embolizzazione
gassosa è pertanto minore, così come il traumatismo sugli elementi ematici e l’attivazione del complemento.
POMPA CENTRIFUGA
OSSIGENATORI
I primi ossigenatori messi a punto furono gli ossigenatori a membrana in cui una membrana semipermeabile di
cellophan permetteva gli scambi gassosi tra sangue ed ossigeno ( tali ossigenatori, pur se con buone basi
fisiologiche, sono stati abbandonati in quanto andavano incontro facilmente a rottura ed altri problemi tecnici );
successivamente sono stati prodotti gli ossigenatori a bolle in cui l’ossigeno ed il sangue vengono direttamente
a contatto tra loro ( tali ossigenatori sono stati utilizzati a lungo per la loro maneggevolezza, anche se potevano
4
esporre al rischio di embolizzazione e di emolisi ); attualmente i più utilizzati sono gli ossigenatori a fibre
cave, in cui appunto innumerevoli fibre cave permettono gli scambi gassosi grazie al passaggio dell’ossigeno
all’interno delle fibre e del sangue all’esterno, che hanno buona maneggevolezza e possono essere utilizzati
anche per diverse ore. Le fibre cave esercitano però una certa resistenza al flusso e per tale motivo è necessario
che la tu posta prima dell’ossigenatore.
L’embolia gassosa è la più grave complicanza della CEC: essa può avvenire per rottura dell’ossigenatore o per
troppa aria nell’ossigenatore o per alterazioni della solubilità dell’ossigeno durante le fasi dell’intervento. Altri
tipi di emboli possono essere quelli solidi ( frammenti di cera ossea, di grasso, di particelle liberatesi dalle pareti
dei circuiti ).
La CEC
comprende anche uno scambiatore di calore per modificare la temperatura del sangue e,
conseguentemente, quella corporea del paziente: in esso circola acqua, di cui si può impostare la temperatura, la
quale poi circolando nell’ossigenatore, provvederà a riscaldare o raffreddare il sangue del paziente e di
conseguenza il paziente stesso.
La CEC può essere eseguita in:
- normotermia
( 33 – 36 °C )
- ipotermia lieve
( 30 – 32 °C )
- ipotermia moderata
( 25 – 28 °C )
- ipotermia profonda
( 15 – 18 °C )
L’ipotermia abbassa il metabolismo ( alla temperatura di 28 °C la richiesta di O2 da parte dei tessuti è ridotta al
50%, mentre a 25 °C è ulteriormente abbassata al 33% ) e quindi i tessuti sopportano meglio l’ischemia e le
condizioni di flusso continuo, non fisiologico ( ma al di sotto di 18° ci può essere un danno cerebrale per danno
alla barriera ematoencefalica ). L’ipotermia permette inoltre di superare meglio le condizioni di emergenza che
si possono occasionalmente verificare ( rottura ossigenatore ecc.) e che potrebbero richiedere l’arresto
temporaneo della macchina cuore - polmoni.
E’ importante che la temperatura dell’acqua non sia troppo alta ( >40 °C ) e che quella del sangue non sia
superiore a 39°, perché un’elevata temperatura può provocare danni ematici: nel riscaldare o raffreddare il
paziente si deve fare in modo che la differenza di temperatura tra l’acqua ed il paziente non sia superiore a
10°C. Il raffreddamento del paziente avviene di 1°C ogni minuto, mentre il riscaldamento avviene di 1 °C ogni
3-4 min.
FILTRI
Hanno una rete maggiore di 5 micron, da 20-40 a 120 micron ( cioè di dimensioni maggiori a quelle degli
elementi corpuscolati del sangue ) e vengono interposti nei circuiti tra la macchina ed il paziente per evitare
gravi complicanze emboliche.
5
CANNULA VENOSA
CANNULA ARTERIOSA
CANNULAZIONE ARTERIOSA E VENOSA
RIPERCUSSIONI DELLA CEC
La circolazione extracorporea, pur essendo particolarmente collaudata, può determinare emolisi, denaturazione
proteica (sia di albumine che di gamma globuline e quindi immunosoppressione), attivazione dei fattori del
complemento, dei leucociti, delle piastrine, rilascio di interleuchine IL-6 IL-8, bradichinina e callicreina
dovute al contatto con le superfici estranee.
Il grado di ossigenazione ( pO2 ) durante la CEC è molto elevato con valori di circa 90-100 mm hg ( in
ipotermia la curva di dissociazione dell’emoglobina è spostata verso sinistra con aumento dell’affinità per
l’ossigeno e minore rilascio di O2 ). Anche la pCO2 deve essere ben controllata ( tra 40 e 25mmHg ) perchè
essa influisce sul flusso cerebrale: valori superiori a 40 provocano vasodilatazione ed edema cerebrale, mentre
quelli inferiori a 25 provocano vasocostrizione ed ipoperfusione cerebrale.
Le resistenze vascolari all’inizio della CEC si riducono, ma successivamente, per stimolazione barorecettoriale e
produzione di adrenalina e noradrenalina, si determina vasocostrizione ed aumento delle resistenze, tanto da
richiedere l’uso di potenti vasodilatatori come il nitroprussiato.
SINDROME POST-CEC
L’attivazione della risposta infiammatoria può determinare la cosiddetta sindrome post - CEC , caratterizzata
da dissociazione temporo - spaziale ( dovuta ad ipoperfusione ed edema cerebrale ), edema interstiziale
polmonare ed insufficienza respiratoria ( per aumento della permeabilità vascolare ), insufficienza renale post operatoria ( per ipoperfusione renale ) reversibile in genere in qualche settimana, anemia ed ematuria ( per
emolisi ).
6
METODICHE PARTICOLARI:
IPOTERMIA
PROFONDA,
ARRESTO
DI
CIRCOLO,
PERFUSIONE
CEREBRALE
ANTEROGRADA E RETROGRADA.
Grazie all’impiego dell’ipotermia profonda ( 18 °C ) è possibile effettuare periodi di arresto di circolo con
buoni margini di sicurezza nei riguardi della protezione cerebrale, midollare e splancnica. Da un punto di vista
tecnico, una volta raggiunta la temperatura nasofaringea di 15 – 18 °C, la perfusione viene interrotta
continuando a drenare parzialmente il sangue venoso al fine di rendere esangui le cavità cardiache e l’aorta: a
questa temperatura è definito sicuro un arresto di circolo di circa 45 minuti.
Al fine di ridurre i rischi di danni cerebrali e/o di prolungare il periodo sicuro di arresto di circolo, sono stati
utilizzati sistemi isolati di perfusione cerebrale anterograda e retrograda. Il sistema anterogrado prevede
l’incannulazione selettiva dei vasi arteriosi cerebrali ( tronco anonimo e carotide comune sinistra ), non sempre
agevole in presenza di dissecazione di questi vasi, e comporta l’impiego di altre cannule ed un circuito più
complesso; la perfusione retrograda viene eseguita utilizzando la stessa cannula venosa posizionata in vena cava
superiore. Con questa metodica viene perfuso, a basso flusso e con bassa pressione, tutto il distretto venoso
superiore, compreso il distretto vertebrale. Nella perfusione cerebrale selettiva anterograda secondo Kazui
(Selective Cerebral perfusion - SCP), il paziente viene posto in ipotermia moderata ed, in arresto di circolo, si
procede alla cannulazione sia del tronco anonimo che della carotide comune di sinistra utilizzando delle
apposite cannule ed attuando una perfusione cerebrale selettiva alla velocità di 10ml/Kg/min usando una
apposita pompa roller indipendente dalla circolazione sistemica
Studi sperimentali eseguiti da Kazui e coll. suggeriscono che per un'adeguata protezione cerebrale la velocità
di perfusione cerebrale in ipotermia moderata deve essere almeno il 50% della perfusione fisiologica. Una
velocità di perfusione di 10ml/kg/min, quale si effettua durante la SCP, è considerata essere il 50% o più della
velocità di flusso fisiologica della circolazione cerebrale.
PROTEZIONE MIOCARDICA
Per poter operare a cuore fermo ed esangue occorre isolare il cuore dalla circolazione sistemica, utilizzando la
CEC che fornisce un’adeguata portata ematica a tutti gli organi eccetto al cuore ( l’ischemia miocardica
prolungata porta danni irreversibili ). L’abbassamento della temperatura miocardica, riducendo il metabolismo,
consente di aumentare il tempo di ischemia senza che si verifichino danni irreversibili ( portando la temperatura
miocardica a 15 °C si ha una riduzione del metabolismo pari al 75% ). Un’efficace protezione miocardica è
assicurata dalle soluzioni cardioplegiche le quali, inducendo un rapido arresto cardiaco, preservano l’energia
cellulare accumulata sotto forma di fosfati ( il consumo di O2 in normotermia è di 6-7 ml /100 gr/min e scende a
meno di 1 ml/100 gr/min in arresto cardiaco ), stabilizzano le membrane, combattono l’edema anossico e
prevengono i danni da riperfusione.
7
In aerobiosi il cuore consuma acidi grassi ( ciclo di Krebs ), mentre in anaerobiosi si ha l’attivazione della
glicolisi, con minore produzione di ATP.
Le soluzioni cardioplegiche
contengono: sodio, potassio ( responsabile dell’arresto cardiaco in quanto
determina un aumento della concentrazione di ioni potassio a livello extracellulare e conseguente riduzione del
potenziale di membrana fino alla depolarizzazione cellulare ), calcio e magnesio per stabilizzare le membrane
cellulari, sostanze che riducono l’edema dovuto all’ischemia come il mannitolo, sistemi tampone quali
bicarbonati e lattati, substrati come aspartato e glutammato ( presenti nelle soluzioni cardioplegiche ematiche
per favorire la produzione di energia tramite il ciclo di Krebs ).
L’infusione della soluzione cardioplegica può avvenire per via :
anterograda ( in aorta ascendente e da qui intracoronarica, o direttamente negli osti coronarici se
la valvola aortica è incontinente ); con tale tecnica se un ramo coronarico è ostruito si può
determinare una cattiva protezione del cuore a valle dell’occlusione durante la CEC.
retrograda attraverso il seno coronarico ( utilizzata nell’insufficienza aortica importante o nella
grave patologia aterosclerotica coronarica trivascolare ).
Durante l’ infusione negli osti coronarici bisogna fare attenzione alla pressione di perfusione perchè c’è il
rischio di dissezione coronarica e necrosi miocardica. La pressione di perfusione della cardioplegia anterograda
dovrebbe essere almeno 60 mm hg e non superiore a 100 mm hg,mentre per la cardioplegia retrograda la
pressione deve essere inferiore a 50 mm hg per non determinare un barotrauma nel seno coronarico e nel circolo
venoso.
CANNULE PER SOLUZIONE CARDIOPLEGICA
Il presupposto per ottenere una corretta protezione miocardica consiste nell’omogenea distribuzione della
soluzione cardioplegica a tutte le regioni miocardiche. In caso di grave arteriosclerosi coronarica con l’infusione
anterograda vi è una scarsa distribuzione oltre la stenosi, con la retrograda è scarsa la distribuzione al ventricolo
destro, mentre l’associazione della somministrazione anterograda e retrograda sarebbe la soluzione ideale.
8
La cardioplegia per via retrograda fuoriesce per 2/3 dalle vene di Tebesio ed in piccola parte dall’ostio
coronarico destro e quindi per questo si è ipotizzata con questa via di somministrazione una minore protezione
del ventricolo destro, un’infusione inadeguata nella porzione posteriore del setto e nella parete posteriore del
ventricolo sinistro ed adeguata invece per la parete anterolaterale del ventricolo sinistro e la porzione anteriore
del setto.
Le soluzioni cardioplegiche possono essere fredde ( 4 °C ), tiepide e calde ( 37 °C ). In genere si usano le
soluzioni fredde, ma in caso di infarto miocardico acuto si usa l’induzione calda a 37 °C ( 300 ml per 3 minuti
fino all’arresto, in modo da migliorare la condizione di irrorazione miocardica con infusione di sostanze
energetiche, poi si continua con la cardioplegia fredda ). La temperatura del cuore dovrebbe essere di 14-17 ° C.
CARDIOPLEGICA EMATICA
In questa metodica il sangue del paziente viene mescolato alla soluzione cardioplegica con un rapporto 4:1.
Essa contiene:
ossigeno ( in ipotermia la curva di dissociazione dell’emoglobina è spostata verso sinistra con aumento
dell’affinità e minore rilascio di ossigeno ),
PH alcalino, sistemi tampone e bicarbonati,
Potassio, Ca - antagonisti e beta bloccanti,
Glucosio, aspartato e glutammato ( essenziali per il ciclo di Krebs ) per migliorare la velocità di ripresa
del metabolismo cardiaco.
La cardioplegia ematica comprende tre diversi tipi di dosi:
1. induzione (ricca di potassio)
2. mantenimento
3. riperfusione ( ricca di substrati energetici )
La dose di induzione è di 300 ml per 3 minuti a 4 °C, quella di mantenimento è di 200 ml per 2 minuti, mentre
quella di riperfusione, prima del declampaggio aortico, è di 150 ml per 3 minuti a 37 °C. La soluzione
cardioplegica ematica viene infusa ogni 20 minuti, perché si è dimostrato che il cuore non deve essere in arresto
per più di 30 minuti per evitare importanti danni. Per raffreddare il cuore si può inoltre porre su di esso del
ghiaccio sterile per un ulteriore raffreddamento topico, ma ciò può però causare paralisi del nervo frenico con
relaxatio del diaframma e problemi respiratori ( in alternativa per raffreddare il cuore può essere utilizzata la
soluzione di Shumway costituita da soluzione fisiologica fredda somministrata in continuo nel sacco pericardio
).
CARDIOPLEGIA CRISTALLOIDE
E’ costituita da:
9
1. potassio ( fondamentale per l’arresto cardiaco ), calcio (per mantenere l’integrità di membrana),
magnesio e procaina ( stabilizzanti di membrana ), glucosio che è il substrato energetico della cellula in
ipotermia.
2. PH lievemente alcalino e sistemi tampone ( per compensare l’acidosi correlata all’ischemia )
3
mannitolo ( per ridurre l’edema miocardico ).
La cardioplegia cristalloide viene infusa ad una temperatura di 4 °C alla dose di 15ml/Kg e viene ripetuta
ogni ora o ad intervalli più brevi
ULTRAFILTRAZIONE
Scopo dell’ultrafiltrazione è di ridurre la quota idrica nel sangue circolante. Essa si è dimostrata efficace nel
concentrare i globuli rossi, le proteine plasmatiche e le piastrine, e nel controllare l’eccessiva emodiluizione che
può verificarsi durante la CEC, soprattutto in pazienti con sovraccarico idrico pre – operatorio ( pazienti in
edema polmonare ad esempio ).
Non esistono particolari controindicazioni all’uso dell’ultrafiltrazione in CEC, mentre le indicazioni sono :
- pazienti con IRC rilevante o in dialisi
- pazienti scompensati e/o con IRA
- eccessiva emodiluizione durante la CEC.
ECMO ( EXTRACORPOREAL MEMBRANE OXIGENATION )
E’ un sistema di assistenza cardiopolmonare utilizzato come presidio terapeutico temporaneo in pazienti con
insufficienza cardiorespiratoria grave. Il sistema consiste in un by-pass artero-venoso femoro-femorale; il
circuito comprende 2 cannule, una di drenaggio venoso ed una arteriosa, una pompa centrifuga ed un
ossigenatore a fibre cave. Al circuito standard possono essere interposte linee per la nutrizione parenterale e
l’ultrafiltrazione. I flussi sono mantenuti in genere tra i 2 e i 3,5 l/min e la durata massima di assistenza
cardiorespiratoria dovrebbe essere compresa tra 48 e 72 ore.
RECUPERATORE CELLULARE
Il sangue aspirato dal campo operatorio, se non eparinizzato, andrebbe perduto se non venisse convogliato in un
circuito dove viene mescolato con soluzione fisiologica eparinata, centrifugato e successivamente reinfusa al
paziente la parte corpuscolata ( mentre viene eliminato il liquido di lavaggio ). Questa metodica è controindicata
nei pazienti neoplastici e nei processi infettivi sistemici in atto, per il rischio di disseminazione sistemica.
EMOFILTRAZIONE
Gli emofiltri sono filtri semipermeabili che lasciano passare molecole fino a 50.000 dalton (acqua, glucosio ,
urea, emoglobina libera, sodio ecc.) utilizzati nei pazienti con sovraccarico idrico e nelle CEC prolungate ( al
contrario del recuperatore cellulare non c’è perdita di proteine plasmatiche e fattori della coagulazione ).
10