- La Diarrea Acuta
- La Diarrea cronica
- Ipertransaminasemia in età pediatrica
- Il vomito
- Sanguinamento gastrointestinale
La Diarrea Acuta
C Romano, D Comito, A Famiani, E Moschella, I Loddo, S Malvaso, S Meduri, V Ferraù
La Diarrea Acuta (DA) è una condizione clinica caratterizzata da una riduzione della
consistenza delle feci o di aumento del numero di evacuazioni (> 3 nelle 24 h) della durata non
superiore a 3 giorni. È di frequente riscontro in età pediatrica con una maggiore prevalenza in
bambini < 3 anni di età. La riduzione della consistenza delle feci viene considerata il carattere più
suggestivo rispetto al numero di evacuazioni che talvolta possono aumentare anche in condizioni di
normalità come nei disordini di tipo funzionale (colon irritabile), in epoche diverse della vita (età
del lattante) o in base al tipo di alimentazione.
La famiglia dei Rotavirus (RTV) è responsabile della maggior parte dei casi di diarrea acuta
infettiva (DAI) con un’incidenza più alta (del 56-74%) nella fascia di età tra 6-23 mesi e in inverno
ed inizio della primavera. Nel 30% dei casi può essere riconosciuta una eziologia da Norovirus o
Adenovirus. Batteri patogeni (Campylobacter jejuni, Yersinia e Salmonella) sono responsabili di
meno del 15% delle ospedalizzazioni, mentre parassiti come la Giardia Lamblia vengono
riconosciuti in meno del 5% dei casi. Altri agenti batterici patogeni e il C. difficile sono più
frequenti in soggetti con comorbilità o immunodeficit.
Gli agenti patogeni agiscono determinando una alterazione del bilancio tra acqua ed
elettroliti e quindi la modifica della consistenza delle feci, mentre la pompa Na-glucosio, localizzata
a livello della superficie del villo intestinale con la funzione di favorirne la capacità assorbitiva di
acqua, elettroliti e nutrienti, rimane attiva, giustificando l’efficacia dell’utilizzo delle soluzioni
reidratanti orali nella diarrea acuta.
Si possono differenziare 3 forme di DA in base ai meccanismi patogenetici:
Diarrea secretiva: l’azione di tossine prodotte da alcuni microrganismi determina un
aumento della secrezione attiva di ioni, in genere cloro, e di acqua nel lume intestinale.
Diarrea osmotica: il danno cellulare dovuto sia alla citolisi indotta dalla penetrazione di
microrganismi nella mucosa sia all’azione di citotossine prodotte dal microrganismo stesso
determina una riduzione della superficie assorbitiva con aumento dei soluti e richiamo di
acqua nel lume intestinale.
Diarrea mista: tipica del RTV, è determinata da a.) danneggiamento delle cellule digestivoassorbitive, b.) iperproliferazione di cellule con funzione secretiva, c.) produzione di una
enterotossina.
Il calcolo del gap ionico fecale valutato sulla determinazione degli elettroliti fecali:
[(Na + K) x 2] [(Na + K) x 2] inferiore a 70 potrebbe essere suggestiva per il sospetto di “diarrea
secretiva” mentre un gap ionico superiore a 70 potrebbe orientare verso il sospetto di “diarrea di
tipo osmotico”. Tale differenziazione consente la definizione di una diversa diagnostica
differenziale.
Aspetti clinici
La DA è espressione nella maggior parte dei casi di una infezione gastroenterica e ad essa si
può associare vomito e febbre. La presenza di sintomi sistemici (rialzo febbrile) o d’organo (sangue
nelle feci e dolori addominali) sono segni clinici suggestivi per una origine batterica, mentre la
presenza di sintomi respiratori e vomito potrebbero indicare una eziologia virale. Di solito il vomito
si arresta in poche ore e la diarrea in pochi giorni, ma una temuta complicanza della diarrea acuta
infettiva (DAI) è la disidratazione acuta.
L’iter diagnostico di un bambino con DA è caratterizzato da:
1. Accurata anamnesi: per valutare l’età del paziente, il numero di episodi di diarrea e vomito,
la presenza di febbre e dolore addominale, l’intake di liquidi, il volume urinario, eventuali
patologie pregresse o preesistenti, l’eventuale contatto con fonti di infezioni
2. Esame obiettivo: per valutare il grado di disidratazione (perdita di elasticità cutanea,
secchezza delle mucose, tempo di riempimento (refilling) capillare >2 sec, frequenza
respiratoria), l’eventuale calo ponderale.
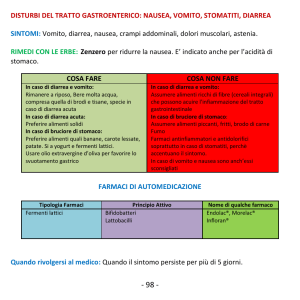
SEGNI
Condizioni generali
Occhi
Lacrimazione
Mucose/lingua
Sete
DISIDRATAZIONE
NO/LIEVE
Buone vigile
Normali
Presente
Umide
Assente
Cute
Respiro
%perdita di peso
Rosea, refill <2”
Normale
<3%
DISIDRATAZIONE
MODERATA
Irritabile
Alonati
Assente
Secche
Presente, ridotta
assunzione di liquidi
Rosea, refill >2”
Normale o profondo
3-9%
DISIDRATAZIONE
GRAVE
Letargia o incoscienza
Alonati e Secchi
Assente
Secche/impaniata
Presente, non
assunzione di liquidi
Rosea, refill >2”
Profondo, da acidosi
>9%
3. Indagini di laboratorio: la coltura fecale ( coprocultura ed esame parassitologico) sembrano
avere un ruolo minore nella DAI in relazione alla relativa breve durata della sintomatologia
acuta senza necessità di specifico approccio terapeutico. La determinazione della conta dei
globuli bianchi, degli elettroliti sierici, della creatinina e della proteina C reattiva è riservata
ai casi di disidratazione moderata-severa con compromissione del circolo, sospetta
ipernatriemia, prolungata contrazione della diuresi o con comorbilità.
Il riscontro di leucocitosi (>100/mmc3) è altamente predittiva di una infezione batterica.
La DAI è una patologia a risoluzione spontanea e nella maggior parte dei casi può essere
gestita con una consulenza telefonica o con una visita ambulatoriale/domiciliare.
Costituiscono dei criteri predittivi di alto rischio di disidratazione:
a. età < 6 mesi,
b. >8 episodi di diarrea nelle ultime 24 h
c. >4 episodi di vomito associati a DA nelle ultime 24 h
d. condizioni di comorbilità
e. rifiuto dei liquidi per via orale
Il ricovero in ambiente ospedaliero è consigliato in caso sia necessaria una reidratazione
endovena ed è indicato in caso di:
a. shock;
b. disidratazione severa (> 9%)
c. compromissione neurologica (letargia, convulsioni)
d. vomito incoercibile o biliare
e. fallimento della reidratazione per os
f. ridotta compliance familiare
g. sospetto di causa chirurgica
Terapia
I STEP. Il primo step terapeutico è la correzione della disidratazione per via orale (ORT) attraverso
l’utilizzo di soluzioni reidratanti orali (ORS) che agiscono sulle pompe Na/Glu determinando il
ripristino dell’equilibrio idroelettrolitico.
L’ESPGHAN ha raccomandato l’utilizzo di ORS a ridotta osmolarità la cui composizione ideale è
costituita da :
Glu: 70-110 mmol/L
Na: 60 mEq/l
K: 20 mEq/l
Cl: 25-60 mEq/l
Osmolarità: 200-250 mOsm.
Le ORS sono più efficaci dell’acqua. Non è indicata l’assunzione di altre bevande (succhi di frutta,
coca cola) in quanto quest’ultime sono caratterizzate da un’alta osmolarità e concentrazione di
glucosio, con scarsa presenza di ioni Na e K.
In caso di scarsa compliance del bambino si dovrà procedere offrendo la ORS con un cucchiaino a
piccoli e frequenti sorsi (circa 5-10 ml ogni 10 minuti). In caso di fallimento della via orale è
preferibile un tentativo di reidratazione attraverso l’utilizzo di sondino naso-gastrico riservando la
via endovenosa (ev) in casi più gravi o in caso di fallimento delle precedenti opzioni per scarsa
compliance o vomito incoercibile. Il calcolo del fabbisogno idrico da infondere sarà calcolato in
base al grado di disidratazione secondo i protocolli di correzione della disidratazione ( capitolo
13), con una rivalutazione clinica ogni 6-12 ore per il ripristino delle perdite subentranti (1020ml/Kg per evacuazione).
II STEP. Il secondo step è la rialimentazione o refeeding. L’allattamento materno non va sospeso
nel lattante con DA. Un rapido refeeding entro 4-6 ore dall’avvio del programma di reidratazione è
ben tollerato e migliora il recupero ponderale. Non ci sono indicazioni ad una rialimentazione
graduale (latte diluito) né all’uso di diete speciali (formula di soia o idrolisati, né alimenti quali riso,
mela e cereali).
III STEP. Non esiste una terapia farmacologica per la DAI, ma la gestione clinica prevede solo una
attenta sorveglianza del rischio di disidratazione o di altre complicanze. Talvolta nelle fasi acute ed
iniziali potrebbe essere utile l’utilizzo di farmaci antisecretori (Racecadotril) che agiscono sulle
encefalinasi intestinali e riducono la secrezione di acqua ed elettroliti nel lume intestinale. Il
Racecadotril (al dosaggio di <9Kg:10mg; 10-15Kg: 20mg; 16-29Kg: 30mg) assunto entro 24 ore
dalla comparsa dei primi sintomi riduce la frequenza, la durata e l’entità della diarrea di qualche
giorno ma con un rapporto costo/efficacia da dimostrare. La terapia antibiotica non è indicata nella
maggior parte dei casi di DAI, ad eccezione delle infezioni da Shighella (gli antibiotici di I scelta
per via orale sono: azitromicina, acido nalidixico o cefalosporine di III generazione, per via
parenterale il ceftriaxone), Giardia Lamblia e C. difficile. In caso di infezione da E. Coli
enteropatogeni o enteroemorragici (Shiga-tossina, STEC),
Yersinia o Salmonella l’uso degli
antibiotici è indicato solo in caso di andamento clinico severo e in pazienti con comorbilità
(patologie croniche, immunodeficit, prematurità, età <6 mesi). Gli antiemetici e gli antiperistaltici
non andrebbero utilizzati, gli adsorbenti (diosmectide) in atto non sono raccomandati.
La batterioterapia orale per quanto concerne l’utilizzo di alcuni ceppi come il LCT GG e il
Saccharomyces boulardii, se avviata nelle prime 24 h in corso di DAI sembra ridurre la durata della
fase acuta di 24-48 ore.
Letture consigliate
1. Nelson. Trattato di pediatria. Textbook XVIII edizione 2009.
2. Guarino A, Albano F, Ashkenazi S et al. ESPGHAN/ESPID. Evidence-based Guidelines for
the Management of Acute gastroenteritis in Children in Europe. JPGN 2008;46:S81-S84.
La Diarrea Cronica
C Romano, D Comito, A Randazzo, A Talenti, R Mallamace, C Grosso, A Deak, V Ferraù
La Diarrea Cronica (DC) è una condizione clinica caratterizzata da una ridotta consistenza delle feci
e/o da un aumento della frequenza delle evacuazioni per > 3-4 settimane. L’eziologia è varia e
l’approccio diagnostico dipende dall’età e da eventuali sintomi e/o segni associati.
I quadri di più frequente riscontro comprendono:
-
Diarrea funzionale
-
Sindrome della contaminazione del tenue o post-enteritica
-
Celiachia
-
Malattie Infiammatorie intestinali
-
Errori congeniti del metabolismo
-
Fibrosi Cistica
Work-up Diagnostico
L’anamnesi e l’esame obiettivo permettono di individuare eventuali segnali d’allarme che si
associano alla diarrea cronica (sintomi notturni, calo ponderale, febbricola, sangue nelle feci,
limitazione delle attività quotidiane). La valutazione del carattere delle feci e il calcolo del gap
anionico fecale permette inoltre di distinguere una diarrea osmotica, la cui causa è spesso un
malassorbimento, da una diarrea secretiva, spesso di origine infettiva. Gli esami di I livello, in
presenza di segnali d’allarme, che possono essere eseguiti possono prevedere: la conta dei globuli
bianchi, VES, proteina C reattiva, elettroliti sierici, proteine totali, albumina ed esami su feci
(calprotectina fecale, coprocolture, esame parassitologico, grassi fecali). diagnostici saranno
indirizzati in base al sospetto clinico.
DIARREA OSMOTICA
DIARREA SECRETIVA
<200ml/24h
>200ml/24h
Risposta al digiuno
riduzione
invariata
Na+ nelle feci
<70mEq/L
>70mEq/L
Sostanze riducenti
+
-
pH feci
<5
>6
Volume fecale
DIARREA FUNZIONALE (e sindrome del colon irritabile)
È inquadrata nell’ambito dei Disordini Funzionali Gastrointestinali o nel contesto della
Sindrome del Colon Irritabile con variabile diarrea (IBS-D). Non è associata a segni di
malassorbimento né a malnutrizione, in assenza di altri segnali d’allarme. Si verifica spesso in
bambini in età scolare e necessita solo di un approccio conservativo ed eventuale terapia
sintomatica. Talvolta le modifiche dello stile di vita (ridurre l’assunzione eccessiva di liquidi
carbonati o succhi di frutta) e la correzione del sovrappeso possono essere sufficienti per un buon
controllo della sintomatologia.
SINDROME DELLA CONTAMINAZIONE DEL TENUE O POST-ENTERICA
Si verifica dopo un episodio di diarrea acuta infettiva, con il persistere di evacuazioni frequenti e/o
di feci a consistenza ridotta Talvolta è indice di contaminazione infettiva a livello dell’intestino
tenue. In età pediatrica è stata dimostrata una scarsa specificità del breath test all’idrogeno (BH2T),
pertanto la diagnosi è clinica. La terapia è antimicrobica (Metronidazolo) o di decontaminazione
intestinale (Colestiramina e Gentamicina).
CELIACHIA
La celiachia è una enteropatia da disregolazione immunologica determinata da un’intolleranza
alimentare permanente al glutine (gliadine di frumento e prolamine di orzo e segale) che si
determina in individui geneticamente predisposti. Ha un’incidenza di 1:80 individui con un trend in
aumento negli ultimi anni e una lieve prevalenza nel sesso femminile (M:F=1:2) e nei Paesi
Sviluppati. Studi epidemiologici hanno dimostrato che per 1 diagnosi di celiachia ci sono 5-6 casi
non diagnosticati (“celiac iceberg”). La prevalenza è del 10% nei familiari di I grado di un soggetto
affetto e aumenta in soggetti a rischio (Sindrome di Down, Sindrome di Turner).
Meccanismi patogenetici
La celiachia è un modello unico di malattia, in quanto coinvolge l’assetto genetico del soggetto,
fattori di rischio ambientale, fattori immunologici e un fattore scatenante, rappresentato dal glutine.
Fattori genetici
La predisposizione genetica allo sviluppo della celiachia è determinata dall’associazione con alcuni
aplotipi del Complesso Maggiore di Istocompatibilità di classe II (HLA II). In particolare alcuni
studi hanno evidenziato
che circa il 90% dei pazienti celiaci esprimono
il DQ2
(DQA1*05/DQB1*02) o in minor misura il DQ8 (DQA1*0301/DQB1*0302). Soggetti DQ2
positivi possono presentare diversi livelli di rischio per sviluppare la celiachia in relazione al
linkage tra DQ e DR. Per cui possiamo distinguere i seguenti livelli in pazienti DQ2 positivi:
G1
G2
G3
G4
G5
DR3/3 o DR3/7
DR5/7 o
DR3/X
DR4/7 o DR4/4 o DR 7/7
ALTRI DR
RISCHIO: 1
RISCHIO: 0,68
RISCHIO: 0,23
RISCHIO: 0,10
RISCHIO: 0.02
Per i parenti di I° grado DQ2 positivi, il rischio genetico puo’ essere così quantizzato:
P1
DR3/3, DR3/7,DR5/7
20-40%
P2
DR3/X
10%
P3
DQ8
5-25%
Altri geni non ancora identificati potrebbero invece essere responsabili dei casi DQ2 DQ8 negativi.
Fattori ambientali
-
L’ESPGHAN (Società Europea di Gastroenterologia, Epatologia e Nutrizione Pediatrica) ha
raccomandato di introdurre gradualmente il glutine tra 6-8 mesi di vita durante
l’allattamento materno (finestra di tolleranza).
-
Si è ipotizzato che infezioni da rotavirus, Campilobacter jejeni, Giardia lambia e HCVcorrelata possano favorire lo sviluppo della celiachia
-
Un’alterazione del microbiota intestinale favorisce una alterazione della permeabilità
intestinale e quindi la penetrazione dei peptidi del glutine nella lamina propria, scatenando il
processo patogenetico della malattia.
Fattori immunologici e glutine
I peptidi del glutine, altamente resistenti alle proteasi intestinali, raggiungono la lamina propria
della mucosa duodenale attraverso una transcitosi epiteliale o un aumento della permeabilità delle
tight junctional epiteliali. Stimolano il sistema immune innato nelle cellule dendritiche ed epiteliali,
in particolare la deamidazione dei peptidi di glutine (TG2) crea potenti epitopi immunostimolanti
che sono presentati attraverso HLA-DQ2 o HLA-DQ8 sulle cellule presentanti l'antigene. Si
determina una attivazione della risposta immune umorale e le cellule T CD4 attivate secernono
principalmente citochine Th1, quali IFN-, che induce il rilascio e l'attivazione di metallo-proteasi
(MMP) da miofibroblasti. Da ciò ne consegue una degradazione della matrice extracellulare e un
rimodellamento della mucosa con atrofia dei villi. Inoltre, la produzione di citochine Th2
determinano la produzione di autoanticorpi diretti contro il glutine e la transglutaminasi TG2. Altre
citochine quali IL-18, IFN-, o IL-21 sembrano svolgere un ruolo nella polarizzazione e il
mantenimento della risposta Th1. L’IL-15 collega invece il sistema immunitario adattativo e le
risposte immunitarie innate.
Fig. 1 GJ Tack et al. The spectrum of celiac disease : epidemiology, clinical aspects and treatment. Nature reviews.
Gastroenterology & Hepatology 2010; 7,204-213.
Spettro clinico
Si riconoscono 4 diversi tipi:
-
MAIOR o CLASSICA: caratterizzata da atrofia dei villi e sintomi tipici di malassorbimento
intestinale (diarrea, steatorrea, perdita di peso), di solito in bambini di 6-18 mesi.
-
MINOR o ATIPICA: caratterizzata da anomalie della mucosa duodenale e sintomi intestinali
minori (anemia, osteoporosi, astenia) o sintomi extraintestinali (artrite, infertilità, dermatite
erpetiforme, alopecia, ipoplasia dello smalto dentale, ipertransaminasemia, neuropatia
periferica)
-
LATENTE o POTENZIALE: caratterizzata dalla presenza di HLA-DQ2 e/o DQ8 positivo,
architettura mucosale normale, sierologia positiva
-
SILENTE: caratterizzata da atrofia dei villi e sierologia positiva in pazienti asintomatici.
La celiachia, più frequentemente nella sua forma classica, si può associare inoltre ad altre patologie
autoimmuni: Diabete tipo 1, Tiroidite linfocitaria cronica, LES
Recenti studi sperimentali hanno dimostrato che per ogni paziente con celiachia vi sono 6-7 casi di
sensibilità al glutine o intolleranza al glutine non-celiaca. E’ una nuova entità clinica
caratterizzata da sintomi gastrointestinali associati all’assunzione di glutine e che migliorano a dieta
priva, con sierologia negativa e istologia mucosale nella norma.
Iter diagnostico
Il Gold standard per la diagnosi di celiachia è rappresentato dall’istologia duodenale, attraverso
l’esecuzione di 3 prelievi bioptici a livello duodenale in corso di esofagogastroduodenoscopia
(EGDS). Markers endoscopici macroscopici suggestivi sono: a. l’aspetto micronodulare, b. il
pattern a mosaico della mucosa, c. l’aspetto a scalloping delle pliche duodenali, d. la riduzione o
perdita delle pliche. L’esame istologico evidenzia alterazioni del’architettura mucosale: atrofia dei
villi duodenali, iperplasia delle cripte e infiltrato linfocitario >40x100 enterociti.
Nel corso degli anni sono stati sviluppati dei tests sierologici di screening (autoanticorpi altamente
specifici) per individuare i casi di sospetta celiachia da sottoporre a biopsia duodenale e nei casi di
celiachia minor o atipica. Gli anticorpi antiendomisio del tessuto connettivo di classe Ig A (EMA) e
gli anticorpi antitransglutaminasi (tTG) sono altamente sensibili e specifici, mentre gli anticorpi
antigliadina (AGA) risultano essere aumentati anche in corso di enteropatia non-celiaca. La recente
identificazione della regione peptidica della gliadina riconosciuta dai linfociti T ha portato alla
determinazione con tecnica ELISA di un nuovo markers sierologico: anticorpi antigliadiana
deamidati (DPG) di classe IgA e IgG, più sensibili dei tTG nei bambini < 2 anni di età e nei soggetti
con deficit di IgA. La determinazione combinata di anti-tTG IgA e anti-DPG IgG andrebbe adottata
per lo screening della malattia celiaca e in corso di follow-up a dieta priva di glutine.
Terapia e Follow-up
Una rigorosa alimentazione senza glutine (DPG) è l’unica terapia efficace. La mancata risposta
clinica alla DPG dopo 1 anno identifica una forma di celiachia refrattaria, che necessita di una
rivalutazione diagnostica. Nuovi modelli terapeutici sono stati sperimentati sulla base della
comprensione dei meccanismi patogenetici. In particolare è stato proposto l’uso di anti-IL15 per
bloccare l’attivazione immunologica contro i peptidi del glutine. Ulteriori studi sono tuttavia
necessari.
MALATTIE INFIAMMATORIE CRONICHE INTESTINALI
Le Malattie Infiammatorie Croniche Intestinali (IBD, Inflammatory Bowel Disease) rappresentano
un disordine cronico ad andamento recidivante, con periodi di remissione e periodi di esacerbazione
della malattia. Il termine IBD è un termine “umbrella”, che comprende entità distinte: Malattia di
Crohn (CD), Rettocolite Ulcerosa (CU) e Colite Non classificata (IBD-U), determinate da una
disregolazione immunitaria in senso pro-infiammatorio del tratto gastrointestinale.
L’incidenza di IBD nella popolazione generale ha un andamento bimodale con un picco maggiore
intorno ai 20 anni ed è aumentata nel corso degli ultimi anni (da 4 a 7 casi/100.000 bambini). Nel
15-20% dei casi l’età di esordio è <16 anni, nel 4% dei casi è al di sotto dei 5 anni d’età: “earlyonset”. Le forme di IBD ad insorgenza in età pediatrica presentano caratteristiche patogenetiche e
fenotipiche differenti dalle forme ad insorgenza in età adulta, che consentono di distinguere
probabilmente due entità cliniche diverse.
Le Malattie infiammatorie croniche intestinali (MICI) sono malattie genetiche complesse ad
eziologia multifattoriale, attualmente le ipotesi patogenetiche più accreditate valorizzano la
presenza di tre fattori principali:
- suscettibilità genetica: Studi di linkage su pazienti con MC e RCU hanno individuato loci
cromosomici di suscettibilità e geni candidati. per posizione e per funzione (IBD1, IBD2, IBD3,
IBD4, IBD5, IBD6). La delimitazione ed il restringimento progressivo di uno di questi loci di
suscettibilità (IBD1), nella regione pericentromerica del cromosoma 16, ha recentemente portato
all’identificazione di specifiche varianti del gene NOD2/CARD15 associate alla MC.
- fattori ambientali: lo stress fisico ed emotivo, le infezioni, una disbiosi intestinale potrebbero
giocare un importante ruolo nella patogenesi delle IBD
- eventi scatenanti che determinano un’alterazione della immunoregolazione intestinale e della sua
permeabilità con conseguente danno flogistico e aumento di citochine pro-infiammatorie (TNF-).
La Rettocolite Ulcerosa (RCU) è una flogosi che interessa esclusivamente il colon, coinvolge la
mucosa e la sottomucosa e si diffonde per continuità a partenza dal retto. La RCU ad esordio in età
pediatrica risulta essere una forma più aggressiva e più estesa di malattia (in circa il 90% dei casi).
Presenta un coinvolgimento pancolitico, con riaccensioni di malattia più frequenti e che rispondono
meno alle terapie mediche convenzionali. La gravità della patologia è valutata secondo uno score
clinico internazionale (PUCAI-score: 0-85 punti), che tiene conto dei seguenti parametri: frequenza
delle evacuazioni, sanguinamento rettale, dolore addominale, carattere delle feci, sintomi notturni e
limitazione delle attività quotidiane. Sintomi generali, quali anoressia, perdita di peso, segni di
anemizzazione e alterazione degli indici di flogosi si verificano generalmente solo in corso di fase
attiva di grado severo.
Nella Malattia di Crohn (MC) la flogosi può interessare in maniera discontinua qualsiasi tratto del
tubo digerente, coinvolgendo a tutto spessore la parete del viscere.
La presentazione clinica è pertanto varia secondo che vi sia un coinvolgimento solo del colon
(diarrea cronica talvolta muco ematica, dolore addominale e tenesmo) o a livello ileale (diarrea e
dolore addominale associati a febbre, calo ponderale e malassorbimento) e delle vie digestive
superiori (aftosi del cavo orale, epigastralgia, nausea e vomito). La malattia paranali nella MC in età
pediatrica è frequente e comprende diversi tipi di lesione: skin tag, ragadi, ulcere, stenosi, fistole e
ascessi perianali e fistole retto-vaginali. Alcuni pazienti con MC presentano inoltre manifestazioni
extraintestinali della malattia prevalentemente a livello oculare (uveite), articolare (sacroileite),
cutanea (eritema nodoso), epatobiliare (colangite sclerosante primitiva), urologiche (fistole enterovescicali). La gravità della patologia è valutata secondo uno score clinico internazionale (PCDAIscore modificato), che tiene conto dei sintomi gastrointestinali, dei sintomi sistemici, della presenza
di manifestazioni extraintestinali e del ritardo di crescita.
In caso di sospetto di IBD, gli esami di laboratorio che andranno richiesti sono:
Esami ematochimici (emocromo, VES, PCR, proteine totali e foresi, albumina)
Esame delle feci (parassitologico, colturale allargato, calprotectina fecale)
Autoanticorpi P-ANCA (positivi nel 75% dei pz con RCU e nel 15-20% dei pz con MC)
Autoanticorpi ASCA (positivi nel 60-80% dei pz con MC)
Gli esami strumentali sono importanti nella fase diagnostica per definire anche l’estensione di
malattia e in corso di follow-up:
endoscopia con biopsie multiple ( sensibilità > 90%; specificità 100%)
rx diretta addome
ecografia addome con valutazione ultima ansa ileale
clisma del tenue/clisma opaco a doppio contrasto
studio videocapsulare del tenue
entero-RMN ed RMN-perianale
La diagnosi è comunque clinica, endoscopica ed istologica con caratteri differenti nelle 2 forme.
REPERTI
ENDOSCOPICI
REPERTI
ISTOLOGICI
MALATTIA DI CROHN
Lesioni segmentali discontinue della mucosa
Ulcerazioni della mucosa a carattere aftoide
Edema e iperplasia con
aspetto a
“ciottolato” della mucosa
Lesioni fissuranti, penetranti e stenosanti
Tramiti fistolosi
RETTOCOLITE ULCEROSA
Flogosi continua della mucosa rettale
diffusa in senso ascendente
Distorsione e/o perdita del reticolo
vascolare
Granulosità,
eritema,
friabilità
mucosale
Ulcerazioni singole o multiple
Lesioni infiammatorie oltre la valvola
ileocecale (backwash ileitis)
Flogosi transmurale
Flogosi limitata alla mucosa e alla
Infiltrati neutrofili focali
sottomucosa
Granulomi epiteliali non necrotizzanti a Ascessi criptici con distorsione
cellule giganti
dell’architettura delle cripte
Fenomeni di displasia e/o metaplasia
Distruzione ghiandolare
Congestione vascolare
Terapia
La terapia delle IBD è complessa e in continua evoluzione grazie all’impiego di nuove categorie di
farmaci.
Le opzioni terapeutiche sono determinate da.
-
fenotipo di malattia (stenosante, fistolizzante, infiammatorio)
-
localizzazione di malattia (ileale, colica, proctite, perianale)
-
severità di malattie (lieve, moderata, severa)
-
complicanze extraintestinali
L’obiettivo è quello di determinare non solo una remissione della malattia ma una guarigione a
livello mucosale (mucosal healing).
Le classi di farmaci da utilizzare nella RCU sono:
-
Acido 5-aminosalicilico (5-ASA) mesalazina è una frazione attiva antiflogistica della
sulfasalazina. Si utilizza nella fase di mantenimento nella MC di grado lieve e nella RCU anche
in formulazione topica in clismi combinati con corticosteroidi.
-
Corticosteroidi (per via orale, endovenosa) nelle forme lievi-moderate di RCU che non
rispondono al I step o nelle forme severe e/o a localizzazione pancolitica e nelle forme di MC
di grado
lieve o nelle
forme
moderato-severe
in associazione ad un farmaco
immunomodulatore
-
Terapia nutrizionale con assunzione esclusiva di formula polimerica, che agisce stimolando
l’azione del TGF-, citochina antinfiammatoria. E’ indicata prevalentemente nelle forme di MC
ad interessamento ileale ed è molto efficace in età pediatrica.
-
I farmaci immunomodulatori agiscono sulla regolazione del sistema immunitario: gli
antimetaboliti analoghi della purina (Azatioprina e 6-Mercaptopurina) che inibiscono la
funzione delle cellule T citotossiche e il metotrexate che blocca la replicazione dei linfociti con
effetto immunosoppressore. Sono indicati come seconda linea di trattamento nelle forme
moderato-severe di RCU e lievi di MC non-responder alla terapia con cortisone o nella terapia
di mantenimento nelle forme di MC moderato-severe.
-
Gli antibiotici (Metronidazolo e Ciprofloxacina) sono utili in alternativa o in associazione ai
corticosteroidi nel trattamento delle fasi attive di MC e RCU, in quanto agirebbero ripristinando
il microbiota intestinale
-
ciclosporina e tacrolimus, macrolidi dotati di azione immunosoppressiva , sono utilizzati nella
fase attiva severa di RCU nel prevenire la colectomia d’urgenza (rescue therapy)
-
i farmaci biologici (Infliximab) sono anticorpi monoclonari anti-tumor necrosis factor-alpha
(anti-TNF potente mediatore dell’infiammazione. L’Infliximab è utilizzato in età pediatrica
nelle forme di MC moderato-severe a carattere stenosante non responsiva ad altri farmaci
immunosoppressori per indurre e mantenere la remissione clinica; recenti studi tuttavia hanno
proposto il suo utilizzo come I linea di trattamento (approccio step-down). Nelle forme di RCU
refrattaria alla terapia convenzionale è efficace nell’induzione della remissione (rescue therapy)
Il ruolo della chirurgia è importante nelle forme severe di IBD non responsive al trattamento
medico e nella cura delle complicanze (stenosi, fistole, ascessi, malattia perianale).
Letture consigliate
1. Nelson. Trattato di pediatria. textbook XVIII edizione 2009.
2. North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition; Colitis
Foundation of America et al. Differentiating ulcerative colitis from Crohn disease in
children and young adults: report of a working group of the North American Society for
Pediatric Gastroenterology, Hepatology, and Nutrition and the Crohn's and Colitis
Foundation of America. J Pediatr Gastroenterol Nutr. 2007 May;44(5):653-74.
Il Vomito
C Romano, E Moschella, D Comito, A Talenti, A Deak, S Malvaso, V Ferraù, C Salpietro
Definizione
Il vomito è un atto parzialmente volontario di emissione dalla bocca del contenuto gastrico o
intestinale, spesso preceduto da nausea e scialorrea. È un complesso processo motorio che richiede
un coordinamento neurologico centrale (Centro del Vomito) e l’attivazione del riflesso emetico, a
cui segue una contrazione della muscolatura liscia del tratto digestivo superiore, di quella striata del
diaframma, della parete addominale e del torace. Differisce dal rigurgito, che è caratterizzato da un
reflusso del contenuto gastrico nell’esofago, per rilasciamento dello sfintere esofageo inferiore
(LES), talvolta con emissione non forzata del contenuto gastrico dalla bocca.
Classificazione in base alla durata
-
Vomito Acuto
-
Vomito Persistente (>1 episodio isolato/settimana per > un periodo di 4 settimane)
-
Vomito Cronico ( > 4 episodi/mese per un periodo di almeno 4-6 mesi)
-
Vomito Ciclico ( crisi acute di vomito spesso a carattere incoercibile e ricorrenza
periodica e con carattere stereotipato)
Classificazione in base al contenuto del vomito
-
Vomito alimentare
-
Vomito ematico (ematemesi), emissione di sangue rosso vivo o nero (a “posa di caffè”)
-
Vomito fecaloide, emissione di materiale simile a feci, di colore brunastro e maleodorante
-
Vomito biliare, emissione di contenuto gastrico e bile, di colore verde smeraldo
Sospetto Diagnostico
Il vomito secondario a cause organiche può riconoscere:
-
CAUSE INFETTIVE
L’infezione gastroenterica di origine virale o meno frequentemente batterica è la causa più
frequente di vomito acuto, che di solito si associa a nausea e diarrea acuta. Talvolta nei bambini più
piccoli il vomito è espressione di un’infezione sistemica (sepsi) o localizzata in altra sede (infezione
delle vie urinarie, meningite, polmonite) e in tal caso si associa spesso a sintomi specifici della
patologia di base.
-
CAUSE ANATOMICHE
Alterazioni anatomiche dell’addome, congenite o acquisite, causano vomito acuto o cronicorecidivante attraverso un meccanismo di ostruzione meccanica. In queste condizioni il vomito si
può distinguere in NON BILIARE e BILIARE, rispetto alla sede dell’ostruzione (al di sopra/al di
sotto del legamento di Treitz). Talvolta condizioni di infiammazione intraperitoneale e
retroperitoneale di pertinenza chirurgica (appendicite acuta, torsione ovarica) causano vomito
BILIARE, per via reflessogena.
Tipo di vomito
Malattie
Non biliare
Biliare
-
corpo estraneo
-
atresia/stenosi dell'esofago o dello stomaco
-
duplicazione, diverticolo, cisti del coledoco
-
stenosi ipertrofica del piloro
-
pancreas anulare
-
sepimenti, bande fibrose
-
Atresie e stenosi intestinali
-
Malrotazioni con o senza volvolo
-
Duplicazione intestinale
-
Invaginazione
-
Appendicite
-
Aderenze peritoneali
Tab.1 Cause anatomiche di vomito
-
CAUSE METABOLICHE
Sono cause più rare di vomito le malattie endocrine (Addison, tireotossicosi) e i disturbi
metabolico-endocrini (uremia, chetoacidosi diabetica, malattie da accumulo ed errori congeniti del
metabolismo). Gli errori congeniti del metabolismo, nella maggior parte dei casi, si manifestano nel
lattante con vomito e sintomi associati (failure to thrive, letargia, alterazioni del tono muscolare,
convulsioni o coma). Si tratta di malattie autosomiche recessive, per cui la consanguineità
genitoriale rappresenta un fattore di rischio. Il riscontro di acidosi metabolica, ipoglicemia,
iperammoniemia o di chetosi può indirizzare verso la diagnosi di malattia metabolica.
-
CAUSE CENTRALI
L’ipertensione endocranica determina una attivazione diretta del centro del vomito, situato nel
medulla, o attraverso l’attivazione dei chemocettori della zona trigger, nel pavimento del IV
ventricolo. Essa si può instaurare per cause strutturali, quali idrocefalo, malformazioni, emorragia o
masse intracraniche (tumori cerebrali),
infettive (infezioni congenite, encefalite, meningite) o
tossiche (ittero nucleare, acidosi o altre sofferenze cerebrali da disordini metabolici). Il vomito in
questi casi è di solito isolato, mattutino, non preceduto da nausea né correlato ai pasti.
Possono anche essere riconosciute cause di tipo funzionale come quelle descritte nell’ambito del
Vomito Cronico Funzionale inquadrato nel contesto dei Disordini Funzionali Gastrointestinali ed
in cui, in assenza di segnali d’allarme (perdita di peso, febbricola etc), può essere assicurato un
approccio conservativo, una terapia sintomatica (procinetici) senza indicazione ad indagini di II
livello o approfondimenti diagnostici
Approccio Diagnostico
Un approccio diagnostico iniziale si basa inizialmente su:
-
valutazione anamnestica
-
età di insorgenza (lattante/bambino),
-
durata (acuto, cronico, ciclico),
-
caratteri (alimentare, biliare)
-
modalità di presentazione (a getto, isolato, incoercibile, mattutino, notturno)
-
sintomi associati (febbre, epigastralgia, nausea, cefalea, fotofobia etc)
-
Esame obiettivo per escludere in I istanza cause di natura chirurgica (appendicopatia,
ostruzione intestinale, volvolo, invaginazione)
Diagnostica differenziale ed approccio in base al contenuto:
VOMITO ALIMENTARE: può essere causato da infezioni, ostruzioni meccaniche al di sopra del
legamento di Treitz (es. stenosi ipertrofica del piloro), tumori cerebrali o altre cause centrali,
malattie metaboliche.
-
Indagini di I livello: emocromo, indici di flogosi, elettroliti sierici, amilasi, lipasi, esame
urine, emogasanalisi (pH ematico e bicarbonati), gap anionico sierico [(Na - (Cl + HCO3)
con valori normali tra 7-16 mmol/L], pH urinario, glicemia, ammoniemia, tTG.
-
Indagini di II livello: urinocoltura, emocoltura, esame del liquor cefalo-rachidiano, ecografia
della regione pilorica, studio radiologico del transito gastrointestinale con mezzo di
contrasto baritato, RMN-encefalo con particolare riguardo per la fossa cranica posteriore,
EEG e fundus oculi.
VOMITO BILIARE: può essere causato da ostruzioni anatomiche al di sotto del legamento di
Treitz o altre cause chirurgiche (appendicite).
-
Indagini di I livello: emocromo, PCR, elettroliti sierici, ecografia addome completo, Rx
diretta addome
-
Indagini di II livello: studio radiologico del transito gastrointestinale con mezzo di contrasto
baritato
VOMITO EMATICO: ( vedi “Sanguinamento gastrointestinale”)
VOMITO FECALOIDE: può essere causato da ostruzioni meccanica bassa.
-
Indagini di I livello: emocromo, PCR, elettroliti sierici, Rx diretta addome
-
Indagini di II livello: clisma opaco
Cenni di terapia
La terapia più efficace per il vomito dipende strettamente dalla risoluzione della causa che ne ha
determinato l'insorgenza e quindi di terapie mediche o chirurgiche specifiche. Nelle forme più gravi
è comunque importante intervenire con un programma di reidratazione dei liquidi per prevenire la
disidratazione.
Gli antiemetici sono farmaci in grado di bloccare l’atto del vomito con diversi meccanismi:
- azione antistaminica (dimenidrinato, prometazina) con effetto sedativo e anticolinergico,
efficace nel controllo dei sintomi da cinetosi o labirintite
- azione antidopaminergica periferica e colinergica (metoclopramide), questa classe di
farmaci causa reazioni extrapiramidali dose-dipendente in quanto sono in grado di attraversare
la barriera emato-encefalica
- azione antidopaminergica periferica (domperidone) con effetto pro cinetico, senza gli effetti
collaterali a carico del sistema nervoso centrale, tipici della metoclopramide, ma il loro uso
andrebbe evitato o limitato < 1 anno di età
- antagonista selettivo dei recettori serotoninergici 5HT3 dei neuroni centrali e periferici in
quanto si legano ai chemiocettori della zona trigger e bloccano il centro del vomito
(ondansetron). Questa classe di farmaci è particolarmente utile nella gestione del vomito da
chemioterapici e del vomito ciclico. Sebbene le principali Società Scientifiche Pediatriche non
raccomandino il suo uso in corso di gastroenterite infettiva, recenti studi di metanalisi in età
pediatrica hanno confermato la sua efficacia clinica nel ridurre il vomito e prevenire una
disidratazione grave e un buon profilo di sicurezza.
Letture consigliate
1. Sleisenger And Fordtran’s. Gastrointestinal And Liver Disease. IX edition Saunders.
2. Zschocke/Hoffmann. Vademecum Metabolicum. a cura di Alberto Burlina.
3. Maglietta V. Diagnosi e terapia pediatrica pratica. 8^ edizione. 2006 Casa Amb
Ipertransaminasemia in età pediatrica
Romano C, Chiaro A, Comito D, Moschella E, Randazzo A, Famiani A, Vicchio P, Ferraù V
Il fegato svolge molteplici funzioni metaboliche, sintetiche, escretorie pertanto sono molti gli esami
di laboratorio abitualmente utilizzati per la diagnosi delle malattie epatobiliari.
Tra le anomalie di laboratorio più comunemente riscontrate durante l’attività clinica è l’incremento
degli “enzimi epatici” ed in particolare delle transaminasi (aminotransferasi).
L’alanina aminotransferasi (ALT), o transaminasi glutamico-piruvica (GPT), e l’aspartato
aminotransferasi (AST), o transaminasi glutamico-ossalacetica (GOT), sono enzimi endocellulari
presenti in differenti tessuti. L’ALT è localizzata principalmente nel fegato ed in minor misura nel
rene e nel muscolo. Un aumento della sua attività nel siero è suggestiva di una lesione
dell’epatocita, anche se un moderato incremento potrebbe essere osservato anche in caso di danno
muscolare.
L’AST è presente in vari organi e tessuti tra cui cuore, fegato, muscolo scheletrico, rene, pancreas,
polmone e globulo rosso. L’ALT è localizzata quasi esclusivamente nel citosol dell’epatocita,
mentre l’AST è localizzata sia nel citosol che nei mitocondri ma la sua attività sierica è quasi
esclusivamente di origine citosolica. Sia le ALT che le AST sono normalmente presenti nel siero a
basse concentrazioni, di solito inferiore a 40 U/L, subendo scarse variazioni con l’età a parte nel
neonato e nel prematuro in cui l’attività è più elevata.
Gli intervalli di normalità dell’attività aminotransferasica variano da laboratorio a laboratorio,
pertanto lo loro attività si esprime sotto forma di multipli dei valori massimi della norma. Così, ad
esempio, un valore di 500 U/L verrà indicato come 10 x N, dove N rappresenta il limite superiore
della norma, corrispondente in quel laboratorio a 50 U/L.
L’aumento delle aminotransferasi può essere lieve (per aumenti < 2 x N), moderato (da 2 a 10 x N)
e severo (per aumenti ≥10 x N).
Un altro enzima da tenere in considerazione durante il “bilancio epatico” è la gamma glutamil
transpeptidasi (γGT) che svolge la propria attività essenzialmente sulla membrana dei colangiociti.
La sua sintesi è indotta dall’etanolo, da farmaci, e in particolare dagli steroidi. Nel siero, l’attività
γGT è compresa generalmente entro 40 U/L.
Le alterazioni degli enzimi sopra menzionati, anche se non sempre esprimono obbligatoriamente
una malattia epatobiliare, possono associarsi ad uno spettro di scenari clinici particolarmente ampio
che varia dal paziente con evidenti segni e sintomi di malattia epatobiliare, al riscontro occasionale
in un individuo asintomatico.
L’aumento marcato (≥ 10 volte il valore massimo della norma) di entrambe le aminotrasferasi, con
incrementi equivalenti per AST e ALT, associato a valori di γGT normali o assai moderatamente
elevati e comunque compresi entro il doppio dei valori massimi della norma (≤ 2 x N) è espressione
della cosiddetta Sindrome citolitica acuta “pura”, condizione determinata da un danno acuto e
isolato dell’epatocita che risparmia il colangiocita.
Tra le cause da tenere in considerazione vi sono quelle infettive determinate da virus epatotropi
maggiori (HAV, HBV, HCV, HEV) e minori (EBV, CMV) (vedi Tabella 1). E’ importante
ricordare che oggi, grazie alle migliorate condizioni socio-economiche ed all’attuazione di
programmi di offerta vaccinale su tutto il territorio nazionale, la probabilità di contrarre
un’infezione da virus epatotropi maggiori in Italia è molto bassa. Altri virus, quali gli adenovirus,
gli enterovirus, il Parvovirus B19, gli herpes virus (soprattutto herpes virus 6), che non sono
specificatamente epatotropi, possono essere responsabili di un’epatite acuta talvolta sintomatica.
Infine, anche il protozoo Toxoplasma gondii può essere eccezionalmente responsabile di un’epatite
acuta, anche in bambini immunocompetenti.
Tra le altre cause che determinano una sindrome citolitica acuta “pura” non bisogna dimenticare le
epatiti autoimmuni che generalmente esordiscono come un’epatite acuta sintomatica che può essere
anche severa ed evolvere verso il quadro dell’epatite fulminante. Nel sospetto di un’epatite
autoimmune bisogna indagare su eventuali precedenti di autoimmunità in famiglia e ricercare sia
un’iper-γglobulinemia policlonale di tipo IgG sia la presenza di autoanticorpi che identificano i
principali sottotipi della malattia (ANA e SMA per il tipo 1 e LKM1 e LC1 per il tipo 2). Nei casi
in cui non c’è evidenza di iper-γglobulinemia o di autoanticorpi noti, la biopsia epatica riveste un
ruolo diagnostico particolarmente rilevante.
Una sindrome citolitica “pura” può essere espressione di epatopatie metaboliche. Un difetto del
ciclo dell’urea, e in particolare di ornitina transcarbamilasi (OCT), può presentarsi nel lattante (di
sesso femminile) con epatomegalia, epatocitolisi, prolungamento del tempo di protrombina e turbe
della coscienza. Sempre nel lattante, un’intolleranza ereditaria al fruttosio può esordire con
epatomegalia, vomito, ascite, marcata epatocitolisi. Una glicogenosi di tipo I da difetto di glucosio6-fosfatasi o
di tipo III da difetto di amilo-1-6-glucosidasi possono presentarsi con marcata epatomegalia e
epatocitolisi, anche marcata. Nel bambino più grande, a partire dai 5 anni, la malattia di Wilson può
esordire con il grave quadro clinico dell’epatite acuta wilsoniana, eventualmente associata a emolisi
massiva. Infine, un’insufficienza epatocellulare acuta con marcata citolisi può rappresentare un
esordio possibile dei disordini ereditari del metabolismo energetico mitocondriale.
Numerosi farmaci utilizzati in età pediatrica possono determinare un aumento delle
aminotransferasi.
Il danno può essere di tipo tossico (paracetamolo) o idiosincratico (isoniazide, specie se associata a
rifampicina, e valproato di sodio, specie sotto i 2 anni). Negli ultimi anni, soprattutto in età
adolescenziale, le amfetamine (ecstasy) rappresentano una causa non trascurabile di danno epatico
acuto. Numerose altre sostanze tossiche possono poi produrre un danno epatico acuto con
meccanismi diversi, come l’intossicazione da funghi (Amanita).
Alcune malattie proliferative del sistema emopoietico (leucemie e linfomi) possono esordire con un
danno epatico acuto.
Potremmo, inoltre, trovarci di fronte ad un bambino che presenta un’improvvisa e marcata
elevazione sia degli enzimi di epatocitolisi (valori ≥ 10 x N per almeno una delle due
aminotransferasi) che di quelli di colangiolisi (valori ≥ 5 x N per la γGT).
Questa condizione viene definita come Sindrome citolitica acuta “mista”.
Bisogna escludere innanzitutto una patologia litiasica della colecisti e/o della via biliare principale
mediante esame ecografico. Anche alcuni virus possono determinare un danno acuto di tipo misto
(epato- e colangiocellulare) come il virus EBV, il virus HAV e l’adenovirus.
Successivamente l’ipotesi di una malattia infiammatoria immunomediata delle vie biliari (colangite
autoimmune eventualmente sclerosante) potrebbe essere presa in considerazione.
La persistente, anche se moderata, elevazione di entrambe le aminotransferasi con valori tra 2 e 10 x
N, associata a valori persistentemente normali delle γGT è inquadrabile nella Sindrome citolitica
cronica pura. E’ importante all’inizio sempre escludere una miopatia asintomatica mediante il
contemporaneo dosaggio della CPK: in caso di miopatia, infatti, l’aumento delle aminotransferasi
può riguardare entrambe le aminotransferasi. Una volta esclusa una miopatia, andrà verificato se
l’aumento delle aminotransferasi interessi entrambi gli enzimi o solo la AST. Nel caso riguardasse
la sola AST, è verosimile che si tratti di una macro-aminotransferasemia (macro-AST). Questa
condizione
è caratterizzata da un aumento isolato, moderato e persistente della AST, in assenza di elementi
clinici suggestivi di una malattia epatica cronica.
Ciò si verifica poichè alcuni enzimi che presentano un peso molecolare più elevato rispetto alla
norma (macroenzimi) vengono complessati con altre molecole (immunoglobuline di classe IgG e
IgA). Queste macromolecole, non potendo essere filtrate dal glomerulo renale a causa del loro
elevato peso
molecolare, rimangono in circolo, con conseguente aumento della loro attività sierica.
La macro-AST è, nel bambino, una condizione benigna.
La causa più frequente di elevazione moderata e persistente delle aminotransferasi è l’epatopatia
steatosica, condizione generalmente secondaria all’eccesso ponderale. La statosi isolata sembra
avere un decorso benigno, mentre la steatoepatite non alcolica può invece evolvere anche verso la
cirrosi, e la sua diagnosi può richiedere quindi una valutazione bioptica. Il cardine del trattamento di
questa condizione nei pazienti obesi è la perdita di peso attraverso un’educazione alla corretta
alimentazione
e all’attività fisica.
Tra le altre cause da prendere in considerazione nella diagnostica differenziale in bambini con
persistenza di elevati valori di aminotransferasi sono le infezioni croniche da virus epatotropi
(HBV, HDV e HCV), che dovrebbero essere ricercati,se presenti fattori di rischio (precedente
contatto con emoderivati, infezione in un convivente), mediante l’identificazione diretta nel siero,
tramite reazione a catena di polimerasi, del rispettivo acido nucleico (HBV-DNA, HCV-RNA).
Deve anche essere valutata l’ipotesi di una malattia autoimmune del fegato. Una malattia celiaca
dovrebbe essere esclusa (mediante ricerca di EMA e anti-tTG) poiché è stato documentato come il
25% dei bambini celiaci alla diagnosi presentano un moderato aumento delle aminotransferasi, con
successiva normalizzazione dopo avvio della dieta senza glutine (epatite celiaca).
Infine, epatopatie metaboliche e genetiche quali le glicogenosi o la malattia di Wilson, epatopatie da
farmaci, malattie endocrine (Addison) dovrebbero anche essere escluse.
Tab.1 – Cause di ipertransaminasemia in età pediatrica
Flow-chart 1 (da Maggiore G. - Medico e Bambino 2010)
Flow-chart 2 (da Maggiore G. - Medico e Bambino 2010)
Bibliografia
1. Squires RH, Shneider BL, Bucuvalas J, et al. Acute liver failure in children, the first 348
patients in the pediatric acute liver failure study group. J Pediatr 2006;148:652-8.
2. Murray KF, Hadzic N, Wirth S, Basset M, Kelly D. Drug-related hepatotoxicity and acute
liver failure. J Pediatr Gastroenterol Nutr 2008;47:395-405.
3. Maggiore G. Approccio clinico al bambino con enzimi epatici elevate, “quasi” vent’anni
dopo. Medico e Bambino 2010;29:1.
4. Whitehead MW, Hawkes ND, Hainsworth I, Kingham JG. A prospective study of the causes
of notably raised aspartate aminotransferase of liver origin. Gut 1999;45:129-33.
5. Caropreso M, Fortunato G, Lenta S, et al. Prevalence and long-term course of
macroaspartate aminotransferase in children. J Pediatr 2009;154:744-8.
6. Craxì A, Almasio P. Diagnostic approach to liver enzyme elevation. J Hepatol 1996;25:4751.
Sanguinamento Gastrointestinale
Ferraù V, Vicchio P, Loddo I, Comito D, Grosso Randazzo A, Romano C
Il Sanguinamento Gastrointestinale (SG) è un evento relativamente frequente in età pediatrica.
Nell’80% dei casi esso si autolimita spontaneamente ma il monitoraggio della fase acuta ed un
corretto approccio clinico rappresentano i fattori prognostici più importanti.
In base alla sede di origine possiamo distinguere:
- SG superiore: se il punto di origine è localizzato al di sopra del legamento del Treitz
- SG inferiore: se il punto di origine è localizzato distalmente al legamento del Treitz
- SG medio: se il punto di origine è localizzato tra il legamento del Treitz e la valvola ileocecale
Indipendentemente dalla natura delle lesioni emorragiche, a seconda delle modalità di
presentazione clinica, i sintomi suggestivi di SG possono essere distinti in:
- Ematemesi: emissione di sangue dalla bocca, può presentarsi come emissione di sangue fresco
se l’emorragia è in atto o a posa di caffè se l’emorragia non è recente
- Melena: emissione di sangue digerito dall’ano sottoforma di feci picee, in seguito a digestione
dell’Hb da parte degli enzimi intestinali e della flora batterica
- Ematochezia: emissione di sangue rosso vivo mescolato alle feci e/o muco, può essere presente
solo su una parte della superficie del cilindro fecale se di origine rettale o anale
- Rettorragia: emissione di sangue rosso vivo e, se sono presenti feci, esse non sono commiste al
sangue ma da questo nettamente distinguibili (proveniente dal colon six, retto e canale anale)
In base ai caratteri distinguiamo invece:
- SG acuto: se clinicamente evidente con carattere di acuzie, sia come esordio che come
risoluzione e spesso a risoluzione spontanea
- SG acuto-ricorrente: ricorrenza dell’episodio di sanguinamento acuto nello stesso paziente
- SG occulto: se clinicamente non evidente, ma individuato tramite positività del sangue occulto
nelle feci
- SG oscuro: se persistente o ricorrente ma di origine non identificata anche dopo opportune
valutazioni endoscopiche del tratto digestivo superiore ed inferiore
Eziopatogenesi
IL SG può essere secondario a lesioni mucosali (erosioni, ulcere), lesioni vascolari (varici,
malformazioni arterovenose, vasculiti, invaginazioni, volvolo) e difetti dell’emostasi primaria o
secondaria.
È possibile identificare cause comuni e rare di SG meglio classificabili in base all’età del paziente.
NEONATO
SGS
CAUSE COMUNI
SGI
ESOFAGO/GASTRITE
STRESS
MALATTIA
(VIT.K)
DA
EMORRAGICA
RAGADI ANALI
ENTEROCOLITE
NECROTIZZANTE
COLITE ALLERGICA
INGESTIONE
MATERNO
CAUSE RARE
ULCERA GASTRICA
DI
LATTE
M.di HIRSCHSPRUNG
MALROTAZIONE
DUPLICAZIONE INTESTINALE
DIVERTICOLO DI MECKEL
MALFORMAZIONI VASCOLARI
INFEZIONI
INVAGINAZIONE
LATTANTE
SGS
CAUSE COMUNI
ESOFAGITE
SGI
RAGADI ANALI
ENTEROCOLITE
NECROTIZZANTE
COLITE ALLERGICA
INGESTIONE DI
LATTE MATERNO
GASTROENTERITE ACUTA
CAUSE RARE
ULCERA GASTRICA
M.di HIRSCHSPRUNG
MALROTAZIONE
DUPLICAZIONE INTESTINALE
DIVERTICOLO DI MECKEL
MALFORMAZIONI VASCOLARI
INFEZIONI
INVAGINAZIONE
BAMBINO e ADOLESCENTE
SGS
SGI
CAUSE COMUNI
ESOFAGO
ESOFAGITE (RGE)
RAGADE ANALE
S. di MALLORY-WEISS
INVAGINAZIONE
STOMACO
DUODENO
ALTRO
GASTRITE (da aspirina e FANS e da
STRESS)
DUODENITE
DIVERTICOLO DI MECKEL
DUPLICAZIONE INTESTINALE
INGESTIONE DI SANGUE (oro/nasale
faringeo)
INFEZIONI
ACUTA)
(GASTROENTERITE
POLIPI
COLITE ULCEROSA
M. di CROHN
ESOFAGO
ESOFAGITE (virale, allergica, micotica,
caustica)
VARICI
PORPORA di SCHONLEIN-HENOCH
EMORROIDI
LESIONE DI DIEULAFOY
CORPO ESTRANEO
VARICI COLICHE
CISTI DA DUPLICAZIONE
IPERPLASIA NODULARE
STOMACO
GASTRITE (M. di Crohn, ipertensione
portale, H. pilori)
ULCERA (S. di Zollinger-Ellison, Ulcera
di Cushing)
LINFATICA
S.UREMICO-EMOLITICA
ABUSO
LEIOMIOMA
VARICI
MALFORMAZIONI
(Lesione di Dieulafoy)
DUODENO
TRAUMA RETTALE
VASCOLARI
ULCERA (H.pylori)
M. di CROHN
CORPO ESTRANEO
IPERPLASIA LINFOIDE
VARICI
CISTI DA DUPLICAZIONE
ULCERA SOLITARIA RETTALE
MALFORMAZIONI VASCOLARI
La patologia infettiva gastrointestinale, sia essa batterica o parassitaria, rappresenta in ogni fascia di
età la principale causa di diatesi emorragica nel bambino e dovrebbe essere esclusa prima di fare
ricorso ad esami più invasivi. Nell’ambito delle emorragie digestive basse, una delle cause più
comuni soprattutto nel bambino in età scolare è rappresentata dalla ragade anale che va inquadrata
nel contesto di un alvo tendenzialmente stitico e si presenta con bruciore/dolore all’atto defecatorio
per cui il bambino trattiene le feci perpetuando un circolo vizioso. Nel neonato, soprattutto nel
prematuro SGA, l’enterocolite necrotizzante è una tipica causa di emorragia digestiva bassa che si
presenta con distensione addominale e vomito biliare. Ancora, nel bambino tra i 3 mesi e i 3 anni è
frequente l’invaginazione intestinale idiopatica che ha la sua manifestazione patognomonica
nell’emissione di feci a gelatina di ribes con associato vomito biliare, dolore addominale, pianto
lamentoso. Anche il volvolo intestinale è una fonte emorragica caratteristica del neonato con
sintomatologia analoga a quella dell’invaginazione e presenza di melena. Nel bambino più grande
va esclusa come causa di invaginazione o di sanguinamento primitivo il diverticolo di Meckel,
residuo del dotto onfalo-mesenterico, situato a livello della porzione distale dell’ileo e contenente
spesso tessuto eterotopico (isole di mucosa gastrica o duodenale) che tende a ulcerarsi e a
sanguinare. Nel contesto di un malassorbimento e/o di un’enteropatia protidodisperdente, un
sanguinamento deve sempre far pensare ad un’allergia alle proteine del latte vaccino. Le Malattie
Infiammatorie Croniche Intestinali sono un’altra importante causa di emissione di sangue con le
feci frammisto a muco piuttosto che di melena o sangue occulto fecale e anemizzazione. Polipi
isolati o nel contesto di una poliposi familiare possono associarsi a sanguinamento occulto o a
rettorragia evidente in ogni fascia di età. Altre cause rare di sanguinamento digestivo basso sono le
angiodisplasie, responsabili spesso di stillicidio cronico con rinvenimento di sangue occulto nelle
feci e progressiva anemizzazione.
Inquadramento diagnostico
L’approccio al bambino con SG è mirato in una prima fase a distinguere condizioni cliniche con
modesto interessamento generale da quelle con shock emorragico o con shock imminente.
La seconda fase, dopo l’eventuale stabilizzazione emodinamica, è quella di individuare gli elementi
anamnestici e clinici che possono indirizzare verso una diagnosi di sede e di causa, e di scegliere
l’approccio terapeutico più appropriato. Il primo passo diagnostico nel riconoscimento
dell’etiologia di un’emorragia digestiva è rappresentato da un’accurata anamnesi: a tal proposito,
una storia di malattia con diatesi emorragica (epatopatia, cirrosi epatica, gastrite, ulcera, MICI,
coagulopatie, poliposi familiare, collagenopatie), l’assunzione di farmaci predisponenti (FANS,
anticoagulanti, cortisonici) e la presenza di sintomatologia suggestiva di ipovolemia o anemia
(vertigini, astenia, dispnea, sopore) guideranno nell’inquadramento nosologico. L’esame clinico è di
fondamentale importanza per orientare il pediatra, consentendogli in molti casi di distinguere tra un
sanguinamento prossimale o distale in base ai segni e sintomi di presentazione. Si procederà quindi
con una dettagliata visita generale, riservando particolare attenzione all’ ispezione del cavo orale e
delle fosse nasali, della cute (petecchie, porpora…), si valuterà l’eventuale presenza di
epatosplenomegalia (ittero, spider naevi, ascite..) o la presenza di obiettività addominale ( segni di
difesa, distensione e/o dolorabilità addominale in sedi elettive, masse palpabili..), si concluderà con
l’ispezione della regione perianale e l’esplorazione rettale. Gli esami di laboratorio (emocromo
completo con formula leucocitaria, elettroliti sierici, glicemia, creatinina, azoto ureico, prove di
coagulazione, enzimi epatici, sideremia, ferritina, indici di flogosi), oltre a fornire un’indicazione
sulla sede del sanguinamento e restringere il campo della diagnostica strumentale, possono anche
rivelare un sanguinamento occulto e fornire i parametri per un intervento in urgenza. Molto utili,
nella diagnostica differenziale dei SG distali, risultano essere anche gli esami su campio ni di feci
quali ad esempio la coprocoltura allargata (ricerca Salmonella, Shigella, E. Coli patogeno,
Clostridium difficile), l’esame parassitologico delle feci e la calprotectina fecale.
La pietra miliare per la diagnosi e l’eventuale terapia di un’emorragia gastrointestinale è a tutt’oggi
rappresentata dall’esame endoscopico (colonscopia e/o EGDS). L’EGDS se eseguita fra le 12 e le
24 ore dalla comparsa dell’emorragia alta identifica la fonte del sanguinamento nel 90% dei casi.
Utile può risultare il posizionamento di un sondino naso gastrico che oltre a fornire i criteri di
positività per un sanguinamento ancora in atto può aiutare anche nella migliore visualizzazione
della mucosa all’esame endoscopico, consentendo di effettuare un lavaggio dello stomaco.
La rettoscopia e l’esame colonscopico sono fondamentali nel sanguinamento distale. Qualora
entrambi gli esami non siano riusciti a smascherare la fonte del sanguinamento sarà opportuno,
procedere all’enteroscopia con video capsula, esame poco invasivo, esaustivo, ben tollerato dal
paziente pediatrico e privo di complicanze gravi. Esami di secondo e terzo livello nel
sanguinamento occulto/oscuro sono rappresentati dalla radiologia convenzionale (RX transito
intestinale, TC spirale, RM addominale), dall’ecotomografia, dalla scintigrafia con TC 99m (gold
standard per la diagnosi di Diverticolo di Meckel), dall’angio-TC, dall’enteroscopia intraoperatoria
e dalla laparotomia/laparoscopia esplorativa.
Terapia medica
Il trattamento farmacologico nel SG acuto e cronico è basato essenzialmente sull’utilizzo di due
classi di farmaci:
Farmaci che sopprimono l’acidità gastrica (anti-H2 ed Inibitori di pompa protonica, IPP)
Ranitidina 2.5-5 mg/Kg/dose e.v ogni 12 ore
Ranitidina 0.75-1.5 mg/Kg/dose e.v. ogni 8 ore (max 400 mg/die)
IPP 0.7- 3.3 mg/Kg/die per os o per via e.v
Farmaci vasoattivi
Somatostatina 1-2 mcg/Kg in bolo o in infusione e.v.
Octreotide > 8 anni: 50 mcg in bolo (in 5 min) o 50 mcg/ora in infusione e.v.
Octreotide < 8 anni: 1-2 mcg/Kg in bolo (in 5 min) o 1-2 mcg/Kg/ora in infusione e.v.
Bibliografia
1. Cadranel S, Scaillon M. Approach to gastrointestinal bleeding. Textbook of pediatric and
gastroenterology and nutrition. London, Guandalini S Editor 2004: 639-54
2. Molleston JP. Variceal bleeding in children. J Pediatr Gastroenterol Nutr 2003;37:538-45
3. Consensus Statement sul sanguinamento gastrointestinale in età pediatrica Progetto Archimede
(SIGENP 2005)
4. Yachha SK, Khanduri A, Sharma BC, Kumar M. Gastrointestinal bleeding in children. J
Gastroenterol Hepatol 2006;11:903-7
5. Jensen DM. Current diagnosis and treatment of severe obscure GI hemorrhage. Gastrointest
Endoscop 2007;58:256-66
6. Kalyonas D, Urgancy N. et al Etiology of upper gastrointestinal bleeding in young children
Indian J Pediatr 2009;76(9):899-901
7. Erough Y, Emerick KM, Whitingon PF, Alonso EM. Octeotride therapy for control of acute
gastrointestinal bleedingin children. J Pediatr Gastroenterol Nutr 2004;38:41-7
8. CoxK, AmentME. Upper gastrointestinal bleeding in children and adolescent. Pediatrics
2007;63:408
9. Fox VL Gastrointestinal bleeding in infancy and childhood. Gastro Clinics of North America
2009;29(1):37-66
10. Jensen DM. Current diagnosis and treatment of severe obscure GI hemorrhage. Gastrointest
11. Endoscop 2003;58:256-66