LE REAZIONI CHIMICHE
PAG. 32
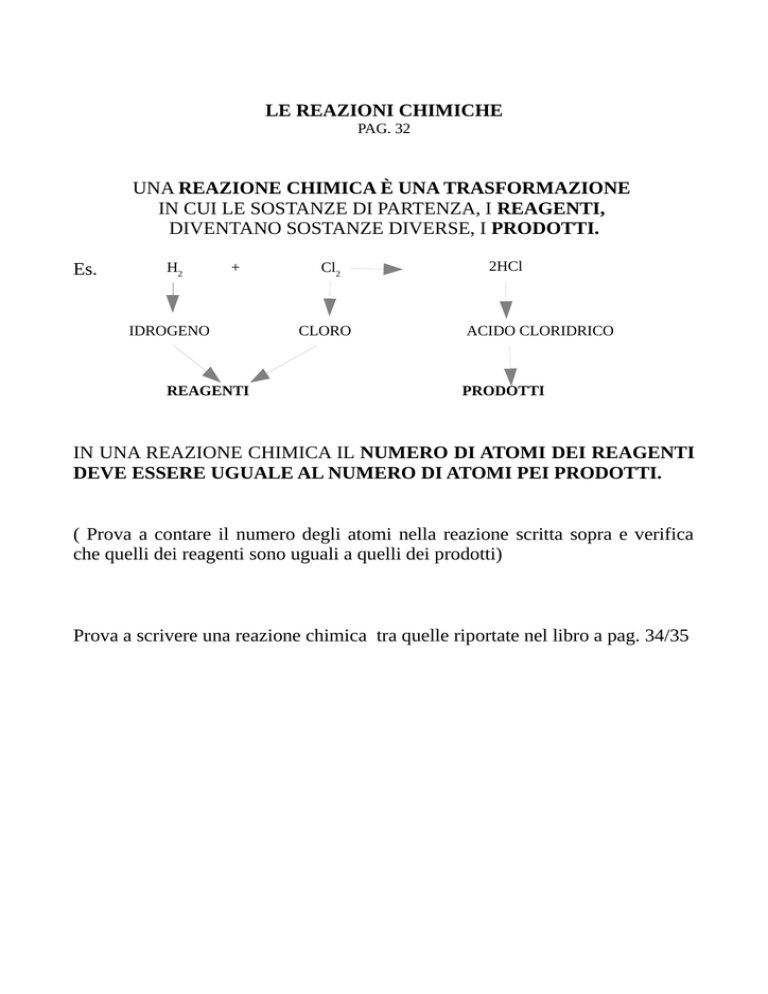
UNA REAZIONE CHIMICA È UNA TRASFORMAZIONE
IN CUI LE SOSTANZE DI PARTENZA, I REAGENTI,
DIVENTANO SOSTANZE DIVERSE, I PRODOTTI.
Es.
H2
+
IDROGENO
REAGENTI
Cl2
CLORO
2HCl
ACIDO CLORIDRICO
PRODOTTI
IN UNA REAZIONE CHIMICA IL NUMERO DI ATOMI DEI REAGENTI
DEVE ESSERE UGUALE AL NUMERO DI ATOMI PEI PRODOTTI.
( Prova a contare il numero degli atomi nella reazione scritta sopra e verifica
che quelli dei reagenti sono uguali a quelli dei prodotti)
Prova a scrivere una reazione chimica tra quelle riportate nel libro a pag. 34/35
LA TAVOLA PERIODICA DEGLI ELEMENTI
pag. 36
È UNA TABELLA IN CUI SONO CONTENUTI TUTTI GLI ELEMENTI CHIMICI
CONOSCIUTI, ORDINATI SECONDO IL LORO NUMERO ATOMICO ( NUMERO DI
PROTONI CONTENUTI NEL NUCLEO) IN GRUPPI ( 8 COLONNE) E PERIODI (7 RIGHE).
GLI ELEMENTI DI TRANSIZIONE SI TROVANO TRA IL II E IL III GRUPPO.
GLI ELEMENTI APPARTENENTI A UNO STESSO GRUPPO HANNO
LO STESSO NUMERO DI VALENZA ( NUMERO DI ELETTRONI CHE
PARTECIPANO ALLA FORMAZIONE DEI LEGAMI CHIMICI ). Es.
idrogeno e sodio hanno valenza 1; ossigeno e zolfo hanno valenza 2)
( osserva la tavola periodica e riconosci, in base ai colori, le principali categorie
di elementi: METALLI, NON METALLI, ELEMENTI OTTENUTI
ARTIFICIALMENTE, GAS NOBILI )
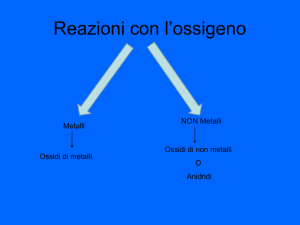
NON METALLI
METALLI
Sono:
* RESISTENTI, PESANTI, LUCENTI
*BUONI CONDUTTORI DI CALORE E
ELETTRICITÀ
*SOLIDI A TEMPERATURA AMBIENTE
( tranne il mercurio e il gallio )
* MALLEABILI ( si lasciano ridurre in
lamine) DUTTILI ( possono essere
trasformati in fili sottili )
* NON SONO BUONI CONDUTTORI NÈ
DI CALORE NÈ DI ELETTRICITÀ
* NON SONO NÈ MALLEABILI NÈ
DUTTILI
* SONO
SOLIDO
FRAGILI,
ALLO
STATO
* PIÙ DELLA METÀ, A TEMPERATURA
AMBIENTE, SONO ALLO STATO
GASSOSO ( es. azoto, ossigeno, cloro)
ALTRI ( carbonio, zolfo, iodio) SONO
SOLIDI
OSSIDAZIONE
pag. 40
SONO LE REAZIONI CHIMICHE IN CUI L'OSSIGENO SI COMBINA
CON GLI ALTRI ELEMENTI DELLA TAVOLA PERIODICA
METALLO + OSSIGENO = OSSIDO BASICO
Cu
+
O2
=
2CuO
Il rame, scaldato alla fiamma, reagisce con
l'ossigeno presente nell'aria formando l'ossido di
rame
BASI
=
=
C
Carbonio
+
O2
+ ossigeno
=
CO2
= diossido di carbonio
( anidride carbonica)
ACIDI
OSSIDO BASICO + ACQUA = BASE (idrossido)
Na2O +
H2O
Ossido di sodio+ acqua
NON METALLO + OSSIGENO = OSSIDO ACIDO
O ANIDRIDE
2NaOH
idrossido di sodio
Esempi di basi:
Bicarbonato di sodio ( nei farmaci contro
l'acidità di stomaco)
Idrossido di sodio ( usato nella preparazione di
saponi, carta, coloranti...)
OSSIDO ACIDO + ACQUA = ACIDO (ossiacido)
SO3
+
H2O
= H2SO4
Triossido di zolfo+acqua
= acido solforico
NON METALLO + IDROGENO = ACIDO (idracido)
H
+
Cl
=
HCl
Idrogeno +
cloro
= acido cloridrico
Esempi di acidi:
Acido citrico ( nel succo di limone)
Acido acetico ( aceto)
Acido lattico ( yogurt)