SCLEROSI MULTIPLA OK DAL CHMP PER
DACLIZUMAB
Il Comitato per i Medicinali per Uso Umano (CHMP) dell'Agenzia europea del farmaco (EMA)
ha dato parere positivo in merito all'autorizzazione all'immissione in commercio di daclizumab, un
trattamento sperimentale autosomministrabile per via sottocutanea una volta al mese per la
sclerosi multipla recidivante (SMR).
29 aprile 2016
Il Comitato per i Medicinali per Uso Umano (CHMP) dell'Agenzia europea del farmaco (EMA)
ha dato parere positivo in merito all'autorizzazione all'immissione in commercio di daclizumab, un
trattamento sperimentale autosomministrabile per via sottocutanea una volta al mese per la
sclerosi multipla recidivante (SMR).
Il parere favorevole del CHMP è stato trasmesso alla Commissione europea (CE), l’autorità che
concede l’autorizzazione all'immissione in commercio per i medicinali nell'Unione Europea. La
decisione della CE è prevista nei prossimi mesi.
Secondo il parere del CHMP, i benefici di daclizumab sono associati alla riduzione del tasso di
recidiva annualizzato (ARR) e del rischio alla progressione della disabilità confermata dopo 24
settimane. Il parere si basa sui risultati di due studi clinici, DECIDE e SELECT, che sono stati
presentati da Biogen e AbbVie in occasione del 68° congresso annuale dell’American Academy of
Neurology (AAN), tenutosi dal 15 al 21 aprile a Vancouver, in Canada.
I nuovi dati hanno mostrato che la terapia sperimentale daclizumab da 150 mg, somministrato per
via sottocutanea una volta al mese, ha prodotto miglioramenti nelle misure di outcome cognitivi
nei soggetti che convivono con sclerosi multipla recidivante- (SMR) rispetto all’interferone beta1a da 30 mcg, somministrato una volta la settimana per iniezione intramuscolare e al placebo. I
dati aggiuntivi offrono informazioni sul meccanismo d’azione (MOA) mirato di daclizumab, a
dimostrazione che il farmaco non ha causato una deplezione generale delle cellule immunitarie e
che i suoi effetti sulle conte linfocitarie totali erano reversibili entro 8-12 settimane dalla
sospensione del trattamento.
Nello studio DECIDE, l'incidenza complessiva degli eventi avversi è risultata simile nei gruppi
trattati con daclizumab e interferone beta-1a. Nei pazienti trattati con daclizumab vi è stato un
aumento dell'incidenza di infezioni gravi (4% contro 2%), reazioni cutanee gravi (2% contro
<1%), aumenti delle transaminasi epatiche superiori a cinque volte il limite superiore delle norma
(6% rispetto al 3%), disturbi gastrointestinali (31% contro 24%), e depressione (8% contro 6%)
rispetto ad interferone beta-1a.
Le nuove analisi evidenziano l’impatto di daclizumab sugli outcome cognitivi fino a un massimo
di tre anni.
Un’analisi post-hoc degli endpoint esploratori di efficacia dello studio di Fase III DECIDE, che ha
messo a confronto daclizumab e interferone beta-1a con iniezione intramuscolare, mostra che il
trattamento con daclizumab ha portato miglioramenti significativi nelle misure di outcome
cognitivi. I nuovi dati relativi a 144 settimane indicano che i miglioramenti medi rispetto al basale
del Symbol Digit Modalities Test (una misura della velocità di elaborazione delle informazioni
visive e dell’attenzione) erano pari a +6,30 per i pazienti trattati con daclizumab e a +3,09 per i
pazienti trattati con interferone beta-1a; p=0,0024.
I dati provenienti dagli studi SELECT e SELECTION forniscono informazioni sul MOA mirato e
reversibile di daclizumab.
Un’analisi post-hoc dei risultati dello studio SELECT e dello studio di estensione SELECTION ha
valutato gli effetti di daclizumab sulla conta linfocitaria totale e differenziale nei pazienti che
avevano ricevuto daclizumab in modo continuativo per due anni e nei pazienti che erano stati
randomizzati a un periodo di washout di 24 settimane prima di completare il trattamento con
daclizumab nello studio SELECTION.
I risultati dimostrano che gli effetti di daclizumab sulle cellule immunitarie sono reversibili e che
il farmaco non ha causato una deplezione generale delle cellule immunitarie:
• Le riduzioni delle conte linfocitarie totali sono tornate ai livelli basali entro 8-12 settimane circa
dalla sospensione del trattamento.
• Nell’arco di sei mesi dalla sospensione del trattamento, tutte le conte cellulari misurate
nell’ambito dello studio SELECT sono tornate ai valori basali.
• Daclizumab determina un aumento delle cellule natural killer (NK) CD56bright , che
contribuiscono a regolare il sistema immunitario:
o Al termine dello studio SELECT, della durata di un anno, le conte medie delle cellule NK
CD56bright erano aumentate di circa cinque volte.
• Il MOA immunomodulatorio mirato di daclizumab era ulteriormente supportato dall’assenza di
un’estesa deplezione dei linfociti totali, delle cellule T CD4+ e CD8+ durante il trattamento.
Le analisi supportano il profilo di sicurezza di daclizumab.
Un’analisi post-hoc dei dati di sicurezza provenienti dallo studio DECIDE ha dimostrato che il
94% degli eventi avversi (EA) cutanei associati al trattamento con daclizumab nell’ambito dello
studio erano di gravità da lieve a moderata. Gli AE cutanei gravi, verificatisi nel 2% dei pazienti
trattati con daclizumab, si sono risolti in seguito all’assunzione di steroidi per via topica e/o
sistemica, di antistaminici o di altre terapie o dopo l’interruzione del trattamento. Biogen e
AbbVie continuano a esaminare gli AE cutanei più comunemente associati al trattamento con
daclizumab.
DECIDE
DECIDE era uno studio globale multicentrico di Fase III, randomizzato e in doppio cieco, della
durata di due-tre anni, ideato per stabilire se daclizumab avrebbe potuto fornire outcome superiori
per determinati endpoint clinici rispetto al trattamento con interferone beta-1° alla dose di 30 µg
somministrati per iniezione intramuscolare. DECIDE era uno studio con comparatore attivo a due
gruppi: 150 mg di daclizumab somministrati per via sottocutanea una volta al mese sono stati
confrontati con 130 µg di interferone beta-1a somministrati con iniezione intramuscolare una volta
alla settimana.
Nello studio DECIDE la significatività statistica è stata raggiunta per l’endpoint primario di
riduzione del tasso di recidiva annualizzato (ARR), oltre che per il primo endpoint secondario,
ossia il numero di lesioni iperintense in T2 di nuova insorgenza o in espansione. Tuttavia, in base
all’analisi primaria prespecificata, la significatività statistica non è stata raggiunta per l’endpoint
secondario che valutava la percentuale di pazienti con progressione della disabilità sostenuta,
misurata con la scala Expanded Disability Status Scale (EDSS) a 12 settimane. Endpoint
secondari aggiuntivi includevano la percentuale di pazienti liberi da recidiva e la percentuale di
pazienti che avevano sperimentato un peggioramento del punteggio di impatto clinico della scala
Multiple Sclerosis Impact Scale (MSIS-29).
L’incidenza complessiva degli EA era simile nei gruppi di daclizumab e di interferone beta-1a.
Rispetto a quest’ultimo, nei pazienti trattati con daclizumab è stata rilevata una maggiore
incidenza di infezioni gravi (4% vs 2%), reazioni cutanee gravi (2% vs <1%) e innalzamenti delle
transaminasi epatiche superiore a cinque volte il limite superiore della norma (6% vs 3%).
Trilogia di studi SELECT
La trilogia di studi clinici SELECT (SELECT, SELECTION e SELECTED) è stata ideata per
valutare l’efficacia e la sicurezza di daclizumab nei pazienti affetti da sclerosi multipla
recidivante-remittente (SMRR). SELECT era uno studio di Fase II multicentrico, randomizzato, in
doppio cieco, volto a valutare l’efficacia e la sicurezza di daclizumab 150 e 300 mg somministrati
per via sottocutanea (SC) ogni quattro settimane per un anno rispetto al placebo. Nello studio
SELECTION, un’estensione di SELECT in doppio cieco della durata di un anno, i pazienti trattati
con il placebo sono stati randomizzati a ricevere daclizumab 150 o 300 mg SC, mentre i pazienti
trattati con daclizumab hanno continuato a ricevere la precedente dose del farmaco oppure sono
stati sottoposti a un periodo di washout di 24 settimane seguito dalla ripresa di daclizumab alla
dose precedente. SELECTED è uno studio di estensione in aperto di SELECTION, attualmente in
corso, condotto per valutare l’efficacia e la sicurezza a lungo termine della monoterapia a base di
daclizumab (150 mg SC ogni quattro settimane).
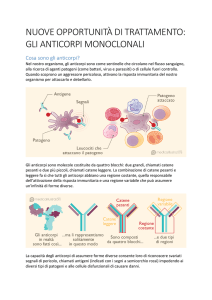
Daclizumab
Daclizumab è un composto sperimentale in sviluppo per il trattamento della sclerosi multipla
recidivante (SMR). Daclizumab è una nuova forma di un anticorpo monoclonale umanizzato
capace di legarsi selettivamente alla subunità del recettore (CD25) dell'interleuchina-2 (IL-2) ad
alta affinità, che si esprime a livelli elevati sulle cellule T che si attivano nei soggetti affetti da
SM. Daclizumab modula la via di segnalazione di IL-2 senza provocare la deplezione
generalizzata delle cellule immunitarie.