ANTIARITMICI
CLASSE II
ESMOLOLO, ACEBUTOLO, METOPROLOLO, PROPRANOLOLO
Università degli studi di Cagliari
Facoltà di Medicina e Chirurgia
Dipartimento di Neuroscienze”B. B. Brodie
Sezione Farmacologia Clinica
Prof.ssa Maria Del Zompo
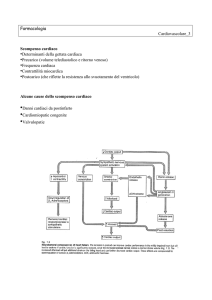
Sulla base della classificazione di Vaughan Williams appartengono alla
classe II degli antiaritmici i seguenti farmaci: Esmololo, Acebutolo,
Metoprololo, Propranololo
1
CLASSE II
ESMOLOLO, ACEBUTOLO, METOPROLOLO,
PROPRANOLOLO
•
ANTAGONISTI β ADRENERGICI COMPETITIVI
EFFETTI ELETTROFISIOLOGICI
•
RALLENTAMENTO FREQUENZA DI SCARICA NSA E AV E DEI
PACEMAKERS LATENTI
•
PREVENZIONE AUTOMATISMO INDOTTO E
REFRATTARIETÀ
SA E AV
La stimolazione beta-adrenergica aumenta l’ampiezza delle correnti di
calcio e rallenta la loro inattivazione, aumenta l’ampiezza delle correnti di
ripolarizzazione di cloro e potassio, aumenta le correnti che creano il
ritmo cardiaco e in particolari condizioni fisiopatologiche può aumentare le
aritmie sia DAD sia EAD. Inoltre, l’aumento di adrenalina circolante
associata a condizioni di stress severo, come l’infarto del miocardio e la
rianimazione dopo blocco cardiaco, abbassa i livelli sierici di potassio. In
questi casi i beta-bloccanti, che inibiscono questi effetti, possono risultare
antiaritmici riducendo la frequenza cardiaca, diminuendo il carico
intracellulare di calcio e inibendo l’automatismo indotto dalle
postdepolarizzazioni.
2
EFFETTI TERAPEUTICI
•
ELEVAZIONE SOGLIA FIBRILLANTE CELLULE ISCHEMICHE
•
GESTIONE
TACHIARITMIE
SOPRAVENTRICOLARI
O
VENTRICOLARI
•
TACHICARDIE E TACHIARITMIE DA STRESS
(IPERTIROIDISMO)
•
RIDUZIONE MORTALITA’ DA ARITMIE O REINFARTO
• VASOCOSTRIZIONE PERIFERICA O SPASMO CORONARICO
PER α STIMOLO NON EQUILIBRATO
3
PROPANOLOLO
OH
OCH2
C
CH3
CH2NHCH
H
CH3
Propanololo
•
ALTAMENTE LIPOFILICO
•
BETA ANTAGONISTA NON SELETTIVO
•
COMPLETAMENTE
ORALE
•
UTILIZZATO PER TRATTARE LE TACHICARDIE
SOPRAVENTRICOLARI, LE TACHIARITMIE INDOTTE DA
DIGITALE, L’INFARTO DEL MIOCARDIO
•
METABOLISMO EPATICO
•
90% SI LEGA ALLE PROTEINE PLASMATICHE
ASSORBITO
DOPO
SOMMINISTRAZIONE
Il propanololo è altamente lipofilico ed è quasi completamente assorbito in
seguito a somministrazione orale. Una notevole quantità di farmaco risulta
tuttavia metabolizzata dal fegato durante il suo primo passaggio
attraverso il circolo portale; in media solo il 25% della dose somministrata
raggiunge la circolazione sistemica. Inoltre, si osservano notevoli
variazioni individuali per quel che riguarda la clearance epatica
presistemica del propanolo; questo fenomeno è alla base della grande
variabilità delle concentrazioni ematiche che si osservano dopo la
somministrazione del farmaco (circa 20 volte) e contribuisce all’ampio
spettro di dosi da utilizzare al fine di ottenere un’efficacia clinica.
Lo svantaggio clinico del propanololo è dato dal fatto che può rivelarsi
necessario aumentare progressivamente e ripetutamente il dosaggio nel
corso del tempo.
4
CLASSE III
AMIODARONE, BRETILIO, SOTALOLO, IBUTILIDE,
DOFETILIDE
•
BLOCCO RIPOLARIZZAZIONE K+
•
BLOCCO CANALI Na+ ( influenza canali Ca2+)
EFFETTI ELETTROFISIOLOGICI
•
AUMENTO DURATA POTENZIALE D’AZIONE
•
QT ALLUNGATO
Sulla base della classificazione di Vaughan Williams appartengono alla
classe III degli antiaritmici i seguenti farmaci: Amiodarone, Bretilio,
Sotalolo, Ibutilide, Dofetilide
5
AMIODARONE
O
(CH2)3CH3
O(CH2)2N(C2H5)2
CO
Amiodarone
•
ANALOGO ORMONE TIROIDEO
•
ALTAMENTE LIPOFILICO, SI CONCENTRA IN MOLTI TESSUTI
•
ELIMINATO LENTAMENTE
•
UTILIZZATO PER TRATTARE LA FIBRILLAZIONE ATRIALE
•
BLOCCA I CANALI AL Na+ INATTIVATI, DIMINUISCE LA
CORRENTE AL Ca2+ E LE CORRENTI AL K+, BLOCCO NON
COMPETITIVO ADRENERGICO
L’amiodarone è un analogo strutturale dell’ormone tiroideo, alcune delle
sua azioni antiaritmiche e la sua tossicità potrebbero essere attribuibili
all’interazione con il recettore nucleare dell’ormone tiroideo.
L’amiodarone è altamente lipofilo, si concentrai in molti tessuti ed è
eliminato molto lentamente; di conseguenza gli effetti collaterali sono
molto difficili da risolvere.
Studi clinici controllati indicano che l’amiodarone per via orale è efficace
nel mantenere il ritmo sinusale in pazienti con fibrillazione atriale.
L’amiodarone blocca i canali per il sodio inattivati e ha una velocità di
recupero dal blocco relativamente rapida. Riduce anche la corrente del
calcio e le correnti transitorie del potassio outward delayed rectifier e
inward rectifier e svolge un effetto di blocco non competitivo del recettore
adrenergico. Inibisce nettamente l’automatismo anormale e, in molti
tessuti, prolunga la durata del potenziale d’azione.
L’amiodarone diminuisce la velocità di conduzione bloccando i canali per
il sodio grazie a un effetto non ancora chiarito sull’accoppiamento cellulacellula che potrebbe essere di particolare importanza nei tessuti
patologici.
6
AMIODARONE
•
PROLUNGAMENTO DEL PR, QRS E QT e BRADICARDIA
SINUSALE (CRONICO)
•
PROLUNGA LA REFRATTARIETA’
EFFETTI AVVERSI
•
IPOTENSIONE E BRADICARDIA (IV)
•
FOTOSENSIBILIZZAZONE
•
DISCROMIE CUTANEE
•
NAUSEA, VOMITO
•
FIBROSI POLMONARE
•
SQUILIBRI ORMONALI TIROIDEI E ENZIMATICI EPATICI
•
DEPOSITI CORNEALI (TEMPORANEI)
•
DISRITMIE ( MONITORAGGIO QT)
Il prolungamento degli intervalli PR, QRS e QT e la bradicardia sinusale
sono frequenti durante la terapia cronica.
L’amiodarone prolunga i tempi di refrattarietà in tutti i tessuti cardiaci; il
blocco dei canali per il sodio, la ripolarizzazione ritardata dovuta al
blocco dei canali per il potassio e l’inibizione dell’accoppiamento cellulacellula potrebbero contribuire a questo effetto dell’amiodarone.
Con la somministrazione della forma endovenosa dell’amiodarone si
verificano frequentemente ipotensione dovuta a vasodilatazione e ridotta
performance cardiaca e questi effetti potrebbero essere dovuti, almeno
in parte, al solvente. Nonostante la somministrazione di alte dosi, che
dovrebbero causare grave tossicità se continuate per lungo tempo, gli
effetti collaterali non sono comuni durante i regimi di carico del farmaco
per via orale, che richiedono necessariamente diverse settimane. I
pazienti possono occasionalmente avere nausea durante la fase di
carico, situazione che migliora con la riduzione della dose giornaliera.
L’effetto tossico più grave durante la somministrazione cronica di
amiodarone è la fibrosi polmonare, che può essere rapidamente
progressiva e fatale.
Altri effetti avversi durante la terapia a lungo termine sono costituiti da
microdepositi corneali (spesso asintomatici), disfunzioni epatiche,
sintomi neuromuscolari
7
AMIODARONE – FARMACOCINETICA E
INTERAZIONI
•
SCARSO ASSORBIMENTO ORALE
•
SI DEPOSITA NEI TESSUTI E VIENE ELIMINATO LENTAMENTE
•
METABOLISMO EPATICO (CYP3A4)
•
EMIVITA: 26-60 GIORNI
•
LE CONCENTRAZIONI DI AMIODARONE AUMENTANO
SOMMINISTRATO CON:
• ANTIARITMICI I A, ATC E FENOTIAZINE
• WARFARIN, DIGOSSINA, ANTIARITMICI, FENITOINA
SE
•
L’AMIODARONE AUMENTA LA CONCENTRAZIONE DI:
• FENTANYL, LIDOCAINA, CICLOSPORINA, CIMETIDINA,
Ca2+ ANTAGONISTI
La biodisponibilità orale dell’amiodarone è approssimativamente del 30%,
probabilmente a causa dello scarso assorbimento. Il farmaco si
distribuisce nei lipidi.
Dopo l’inizio della terapia con amiodarone l’aumento della refrattarietà, un
marker dell’effetto farmacologico, richiede diverse settimane di tempo
prima di svilupparsi.
L’amiodarone va incontro a metabolismo epatico a opera di CYP3A4, per
formare un metabolita con effetti farmacologici simili a quelli del farmaco
progenitore. Quando un paziente in trattamento da diversi anni sospende
la terapia con amiodarone, la concentrazione plasmatica declina con
un’emivita di settimane o mesi. Il meccanismo di eliminazione
dell’amiodarone e del suo metabolita non è stato ben stabilito.
L’amiodarone inibisce nettamente il metabolismo epatico o l’eliminazione
renale di molti composti. I meccanismi identificati fino ad oggi includono
l’inibizione dei citocromi CYP3A4 e CYP2C9 e della glicoproteina-P. Di
solito durante la terapia con amiodarone è necessaria una riduzione dei
dosaggi del warfarin, di altri antiaritmici (flecainide, procainamide e
chinidina) o della digossina.
8
SOTALOLO
OH
CH3SO2NH
CHCH2NHCH(CH3)2
Sotalolo
•
BETA ANTAGONISTA ADRENERGICO NON SELETTIVO
•
L-SOTALOLO
E’
PIU’
POTENTE
COME
ANTAGONISTA
ADRENERGICO
•
L- e D-SOTALOLO SONO EQUIPOTENTI NEL BLOCCARE I
CANALI AL POTASSIO
•
PROLUNGA
IL
POTENZIALE
D’AZIONE:
DIMINUISCE
AUTOMATICITA’, ABBASSA LA CONDUZIONE AV e PROLUNGA
LA REFRATTARIETA’ (BLOCCO K+)
Il sotalolo è un antagonista non selettivo del recettore beta-adrenergico
che prolunga i potenziali d’azione cardiaci inibendo i canali inward rectifier
e probabilmente altre correnti del potassio. Il sotalolo è prescritto come
miscela racemica; l’enantiomero L è un antagonista dei recettori betaadrenergici molto più potente rispetto all’enantiomero D, ma entrambi
sono equipotenti come bloccanti del canale per il potassio.
Il sotalolo allunga la durata del potenziale di azione in tutto il cuore e
dell’intervallo QT sull’ECG, diminuisce l’automatismo, rallenta la
conduzione attraverso il nodo AV e allunga la refrattarietà del nodo AV
bloccando sia i canali per il potassio sia i recettori beta-adrenergici, ma
non ha effetto sulla velocità di conduzione dei tessuti a risposta rapida.
9
IBUTILIDE
OH
C
CH3SO2NH
C2H5
(CH2)3
N
C7H15
H
Ibutilide
•
BLOCCANTE DELLA CORRENTE IN ENTRATA AL K+
•
PROLUNGA IL POTENZIALE D’AZIONE
•
INFUSIONE RAPIDA
•
METABOLISMO EPATICO
•
EMIVITA: DA 2 A 12 ORE
•
TORSIONI DI PUNTA
L’ibutilide è un bloccante delle correnti in entrata del potassio ed è anche
in grado di attivare la corrente inward del sodio. L’effetto del
prolungamento del potenziale d’azione deriva da entrambi i meccanismi.
L’ibutilide viene somministrata in infusione veloce per l’immediata
conversione della fibrillazione atriale o per il flutter a ritmo sinusale.
Il farmaco va incontro a un ampio metabolismo di primo passaggio che ne
preclude la somministrazione per via orale. Presenta un’emivita di 2-12
ore (con una media di 6 ore) e viene eliminato attraverso il metabolismo
epatico.
L’effetto tossico più frequente con l’ibutilide sono le torsioni di punta, che
si verificano in più del 6% dei pazienti e richiedono cardioversione
immediata in più di un terzo di questi.
10
10
CLASSE IV
DILTIAZEM, VERAPAMIL
• BLOCCO CANALI Ca2+ DI TIPO L
• RITARDO RIATTIVAZIONE CANALI INATTIVATI, RALLENTANDO
FREQUENZA SA E
REFRATTARIETÀ AV
• DIDROPIRIDINE (NIFEDIPINA, NICARDIPINA, ETC) MAGGIORE
AZIONE VASCOLARE (INIBIZIONE FOSFODIESTERASI?)
• ATTIVITÀ RIFLESSA ANNULLA OGNI EFFETTO DEPRESSORE
DIRETTO NEL NSA E NAV
Sulla base della classificazione di Vaughan Williams appartengono alla
classe IV degli antiaritmici i seguenti farmaci: Diltiazem, Verapamil.
Il maggior effetto elettrofisiologico risultante dal blocco dei canali per il
calcio si verifica nei tessuti a risposta lenta: il nodo del seno e il nodo AV.
Le diidropiridine, comunemente usate nell’angina e nell’ipertensione,
bloccano preferenzialmente i canali per il calcio nella muscolatura liscia
vascolare, i loro effetti elettrofisiologici a livello cardiaco, come l’aumento
della frequenza cardiaca, sono principalmente il risultato dell’attivazione
di riflessi simpatici secondari alla vasodilatazione periferica. Soltanto il
verapamil e il diltiazem sono in grado di bloccare i canali per il calcio (di
tipo L) nelle cellule cardiache alle dosi in uso clinico.
11
11
DILTIAZEM, VERAPAMIL
CH3
H3C
H3C
O
H3C O
CH3
CH
CH3
C CH2CH2CH2N CH2CH2
C
N
S
N
O
Verapamil
CH3
O
O
CH3
O
CH3
CH2CH2N
O
C
CH3
CH3
O
Diltiazem
• CONTROLLO FREQUENZA VENTRICOLARE IN TACHIARITMIE
SOPRAVENTRICOLARI
• TERMINARE O SOPPRIMERE TPSV DOVUTE A RIENTRO NSA O
AV
• EFFICACI ANCHE NELLA TACHICARDIA ATRIALE MULTIFOCALE
• INDICATI ANCHE NELLA PATOLOGIA CORONARICA
• INOTROPISMO NEGATIVO
12
12
DILTIAZEM, VERAPAMIL – FARMACOCINETICA E
CONTROINDICAZIONI
•
LEGAME AMPIO CON PROTEINE PLASMATICHE
•
METABOLISMO EPATICO CON METABOLITI ATTIVI
•
EMIVITA E CONCENTRAZIONE PLASMATICA AUMENTATI NEGLI
ANZIANI E IN CASO DI INSUFFICIENZA EPATICA
•
TERAPIA CONCOMITANTE CON DIGITALE
•
TERAPIA CON AMIODARONE (RISCHIO BAV e BRADICARDIA)
•
IPOTENSIONE GRAVE, DEFICIT GRAVE DI POMPA
EFFETTI AVVERSI
IPOTENSIONE, BRADICARDIA, SCOMPENSO CARDIACO, EDEMI,
VERTIGINI, GASTROINTESTINALI
Una delle interazioni rilevanti è quella con la digossina, sia dal punto di
vista farmacocinetico che farmacodinamico. Il verapamil aumenta le
concentrazioni plasmatiche della digossina inibendone il trasporto e la
distribuzione nei tessuti periferici mediato dalla glicoproteina-P,
diminuendo quindi il volume di distribuzione del farmaco. D’altra parte, sia
il verapamil e il diltiazem sia la digossina hanno effetti deprimenti sulla
conduzione Ave sulla frequenza cardiaca, e la combinazione di questi
farmaci può portare al blocco AV con la comparsa di un ritmo giunzionale
che sfugge al controllo sopraventricolare.
Il principale effetto collaterale dopo somministrazione endovenosa di
diltiazem e verapamil, soprattutto in bolo, è l’ipotensione.
Si può inoltre verificare una severa bradicardia sinusale o un blocco AV,
specialmente in pazienti suscettibili come quelli che ricevono
contemporaneamente beta-bloccanti. Con la terapia orale questi effetti
sembrano essere meno gravi. Il verapamil per via orale può causare
stipsi.
13
13
DIGOSSINA
•
EMIVITA DIGOSSINA: 36 ORE
•
ELIMINAZIONE RENALE 80%
•
PAZIENTI CON INSUFFICIENZA
RENALE E ANZIANI
•
INDICE TERAPEUTICO
RISTRETTO
•
O
O
OH
CH3
EFFETTI TOSSICI:
• MONITORAGGIO DEI
LIVELLI SIERICI
• INTERAZIONI
FARMACOLOGICHE
H
H
CH3 O
O
H
H
OH
H
O
H
CH3
Digossina
OH
3
L’emivita di eliminazione della digossina nei pazienti con funzione renale
normale o vicina alla norma è di 36-48 ore. Da ciò deriva la possibilità di
un’unica somministrazione al giorno, si raggiungono livelli ematici
prossimi allo stato stazionario una settimana dopo l’inizio della terapia di
mantenimento. L’eliminazione renale del farmaco non metabolizzato è
inferiore all’80% dell’eliminazione totale della digossina. La digossina
viene escreta attraverso il rene.
L’emivita del farmaco è aumentata nei pazienti con grave insufficienza
renale (circa 3,5-5 giorni); nei soggetti anziani diminuiscono sia il volume
di distribuzione sia la velocità di clearance della digossina. La tossicità
della digossina è dovuta al suo basso indice terapeutico. Aritmie, nausea
e disturbi della funzione cognitiva sono i sintomi più comuni. Elevate
concentrazioni plasmatiche di digitale, ipossia (per esempio in caso di
patologia polmonare cronica) e alterazioni elettrolitiche (per esempio
ipokaliemia, ipomagnesia e ipercalcemia) predispongono il paziente ad
aritmie indotte da digitale.
L’incidenza e la gravità degli effetti tossici della digossina hanno subito
una notevole flessione, dovuta ai nuovi farmaci per il trattamento delle
aritmie sopraventricolari e dello scompenso cardiaco, alla migliore
conoscenza delle proprietà farmacocinetiche della digossina, al
monitoraggio dei livelli di digossina nel siero e alla scoperta di importanti
interazioni tra la digossina e molti dei farmaci comunemente utilizzati.
14
14
DIGOSSINA – MECCANISMO D’AZIONE
SCAMBIO DI NA+ E CA2+ NEL SARCOLEMMA DURANTE LE FASI
DI DEPOLARIZZAZIONE E RIPOLARIZZAZIONE
[Na+]o= 140mM, [K+]o= 4mM
SARCOLEMMA
Ca2+
PKA
Ca2+
[Na+]i= 10mM, [K+]i= 150mM
Ca2+
ATPasi
PKA
Tipo L
RS
FL
Ca2+
2H+
RyR2
PKA
Ca2+
SERCA2
PKA
Ca2+
2H+
Ca2+
NCX
(polarizzato)
NCX
(depolarizzato)
3Na+
3Na+
Canale
Na+
Na+
3Na+
Na+, K+
ATPasi
2K+
Sito di legame della
digossina
I glicosidi della digitale esercitano effetti inotropi positivi e sono ampiamente
utilizzati nell’insufficienza cardiaca. Le loro azioni inotrope sono il risultato
dell’aumento del calcio intracellulare, che costituisce anche la base delle aritmie
correlate all’intossicazione da glicosidi cardiaci.
La digossina possiede anche un’azione vagotonica importante, che determina
l’inibizione delle correnti di calcio nel nodo AV e l’attivazione nell’atrio delle
correnti del potassio mediate dall’acetilcolina.
I principali effetti elettrofisiologici indiretti dei glicosidi cardiaci sono pertanto
l’iperpolarizzazione, l’accorciamento del potenziale d’azione e l’aumento della
refrattarietà a livello del nodo AV. Quest’ultima azione spiega l’utilità della
digitale nel porre fine alle aritmie da rientro che coinvolgono il nodo AV e nel
controllare la risposta ventricolare nei pazienti con fibrillazione atriale.
Didascalia della figura:
Gli ioni sodio e calcio entrano nei miociti cardiaci durante ogni ciclo di
depolarizzazione della membrana attraverso i canali del sodio e i canali del
calcio di tipo L e inducono il rilascio, attraverso i recettori della rianodina (RyR),
di notevoli quantità di calcio dai depositi intracellulari del cel reticolo
sarcoplasmatico (RS). Ne consegue un aumento del calcio intracellulare, che
interagisce con la troponina C e attiva le interazioni tra actina e miosina che
comportano l’accorciamento del sarcomero. Il gradiente elettrochimico per il
passaggio del sodio attraverso il sarcolemma viene mantenuto dal trasporto
attivo di sodio fuori dalla cellula mediato dalla pompa sodio potassio ATPasi
presente nel sarcolemma. LA maggior parte del calcio presente nel citoplasma
viene ripompato nel RS attraverso una pompa calcio ATPasi, la SERCA2.
La parte restante viene rimossa dalla cellula per mezzo di una calcio ATPasi
presente nel sarcolemma o attraverso uno scambiatore sodio calcio ad alta
capacità, l’NCX. La proteina NCX scambia 3 ioni sodio per ciascun ione calcio,
utilizzando il potenziale elettrochimico del sodio per estrudere il calcio. La
direzione dello scambio sodio calcio può essere invertita brevemente durante la
fase di depolarizzazione, quando si inverte temporaneamente il gradiente
elettrolitico lungo il sarcolemma.
Gli antagonisti beta-adrenergici e gli inibitori della fosfodiesterasi, attraverso
l’aumento del livello di AMP ciclico intracellulare, attivano la PKA, la quale
fosforila alcune proteine bersaglio tra cui il fosfolambano (FL), la subunità alfa
dei canali del calcio di tipo L e alcuni componenti regolatori del RyR, così come
la TnI, la subunità regolatrice della troponina (non riportata in figura). Il risultato
finale di tutte queste fosforilazioni è un effetto inotropo positivo: la tensione si
sviluppa più velocemente ed è seguita da un rilassamento più rapido.
15
15
ADENOSINA
•
NUCLEOSIDE NATURALE
•
AZIONE MEDIATA DALL’INTERAZIONE CON
NH2
N
N
LE PROTEINE G
•
ATTIVA LA CORRENTE AL K+ ACETILCOLINO
SENSIBILE
•
DIMINUZIONE DEL POTENZIALE D’AZIONE,
IPERPOLARIZZAZIONE E DIMINUZIONE
DELL’AUTOMATICITA’
•
HOCH2
H H
OH
N
N
O
H H
OH
Adenosina
AUMENTA LA REFRATTARIETA’ DEL NODO
AV
L’adenosina è un nucleoside esistente in natura ed è somministrato
rapidamente con un bolo endovena per bloccare in acuto l’aritmia
sopraventricolare da rientro.
Gli effetti dell’adenosina sono mediati dalla sua interazione specifica con i
recettori dell’adenosina accoppiati a proteine G.
L’adenosina attiva le correnti del potassio sensibili all’acetilcolina
nell’atrio, nel nodo del seno e nel nodo AV, col risultato di ridurre la durata
del potenziale d’azione, di produrre iperpolarizzazione e rallentamento
dell’automatismo. L’adenosina inoltre inibisce gli effetti elettrofisiologici
dell’aumento di AMP ciclico che avviene durante la stimolazione
simpatica. Poiché l’adenosina riduce le correnti del calcio, può svolgere
azione antiaritmica aumentando la refrattarietà del nodo AV e inibendo le
DAD indotte da stimolazione simpatica.
16
16
ADENOSINA - FARMACOCINETICA
ED EFFETTI AVVERSI
•
EMIVITA BREVISSIMA
•
ATTIVA LA CORRENTE AL K+ ACETILCOLINO SENSIBILE
•
RICHIEDE SOMMINISTRAZIONE RAPIDA IN BOLO PER AVERE
EFFETTO
•
EFFETTI COLLATERALI DI BREVE DURATA
•
OSTRUZIONE VIE AEREE E DISPNEA
•
RARO IL BRONCOSPASMO
L’adenosina è eliminata con un’emivita di pochi secondi tramite
captazione mediata da carrier, evento che avviene nella maggioranza
delle cellule incluso l’endotelio, con susseguente metabolismo a opera
dell’adenosina deaminasi.
L’adenosina probabilmente è l’unico farmaco che per essere efficace
richiede una rapida dose in bolo, la somministrazione lenta risulta
nell’eliminazione del farmaco prima che questo raggiunga il cuore.
Uno dei principali vantaggi della terapia con adenosina è il fatto che gli
effetti collaterali sono di breve durata, poiché il farmaco viene trasportato
all’interno delle cellule e deaminato rapidamente. La maggioranza dei
pazienti avverte come un senso di ostruzione delle vie aeree e di dispnea
quando sono somministrate dosi terapeutiche di adenosina.
È raro che una dose singola di adenosina possa precipitare il
broncospasmo o la fibrillazione atriale presumibilmente in seguito a un
abbreviamento eterogeneo del potenziale d’azione atriale.
17
17