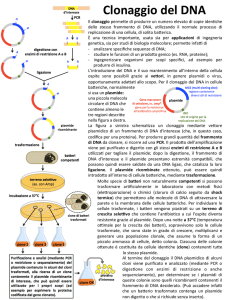
Metodologie di microbiologia e genetica
Modulo Metodologie di Genetica
Prof.ssa Antonella Furini
ESERCITAZIONE N° 3
PREPARAZIONE DEL FRAMMENTO E DEL PLASMIDE RICEVENTE
taglio con enzimi di restrizione
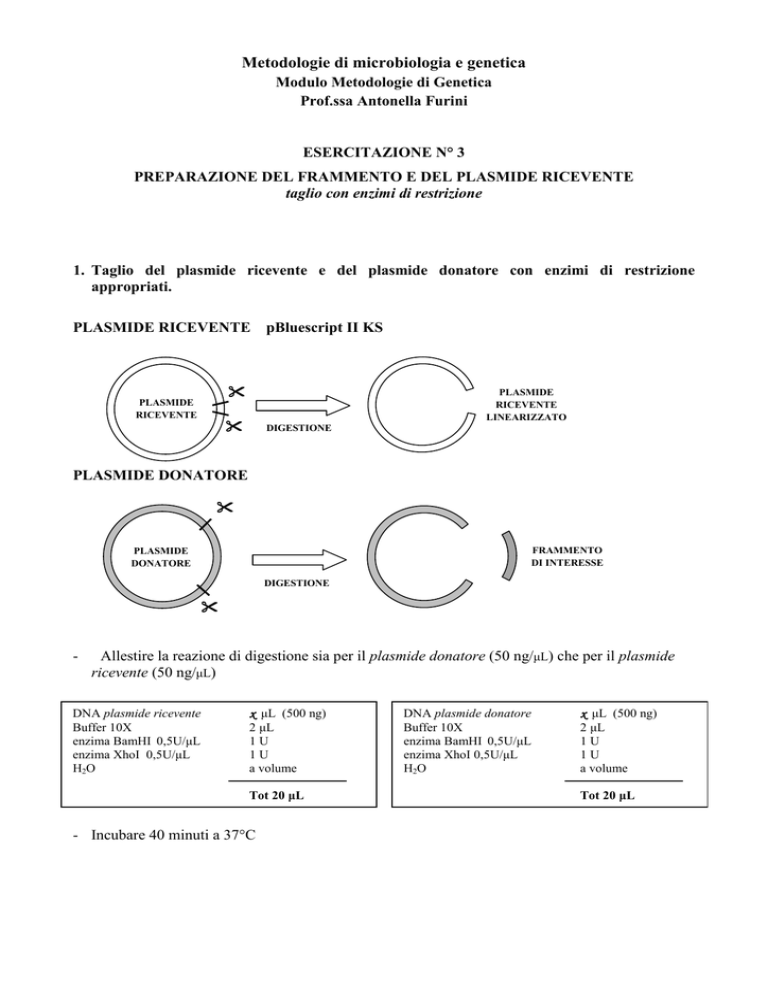
1. Taglio del plasmide ricevente e del plasmide donatore con enzimi di restrizione
appropriati.
PLASMIDE RICEVENTE
pBluescript II KS
PLASMIDE
RICEVENTE
PLASMIDE
RICEVENTE
LINEARIZZATO
DIGESTIONE
PLASMIDE DONATORE
FRAMMENTO
DI INTERESSE
PLASMIDE
DONATORE
DIGESTIONE
-
Allestire la reazione di digestione sia per il plasmide donatore (50 ng/µL) che per il plasmide
ricevente (50 ng/µL)
DNA plasmide ricevente
Buffer 10X
enzima BamHI 0,5U/µL
enzima XhoI 0,5U/µL
H 2O
x µL (500 ng)
2 µL
1U
1U
a volume
Tot 20 µL
- Incubare 40 minuti a 37°C
DNA plasmide donatore
Buffer 10X
enzima BamHI 0,5U/µL
enzima XhoI 0,5U/µL
H 2O
x µL (500 ng)
2 µL
1U
1U
a volume
Tot 20 µL
- Verificare il successo della reazione di restrizione su gel di agarosio all’1% caricando:
a. il marker (5 µL di marcatore di peso molecolare chiamato 1Kb);
b. il plasmide donatore non tagliato;
Solo 1 gruppo per bancone!!!
c. il plasmide ricevente non tagliato;
d. il plasmide donatore tagliato;
e. il plasmide ricevente tagliato.
Preparazione dei campioni b. e c. per il caricamento su gel:
1 µL di plasmide non tagliato;
4 µL di Loading Buffer 6X (blu);
19 µL di H2O.
Preparazione dei campioni d. e e. per il caricamento su gel:
20 µL di campione;
4 µL di Loading Buffer 6X (blu);
Schema di caricamento del gel (1 gel ogni due gruppi):
a
b
c
d
e
Gruppo A
d
e
Gruppo B
- Far correre a 90 V fino a quando il fronte colorato supera i 4 cm dal margine superiore del gel (±
30min).
- Con un bisturi pulito tagliare al transilluminatore (→ attenzione, UV) le bande corrispondenti al
frammento (exciso dal plasmide donatore) ed al plasmide ricevente tagliato (lanes d ed e) e porle
in due tubi da 1.5 mL (scrivere sul tubo il contenuto ed il numero del gruppo).
- Conservare le bande a -20°C.
Metodologie di microbiologia e genetica
Modulo Metodologie di Genetica
Prof.ssa Antonella Furini
ESERCITAZIONE N° 4
PREPARAZIONE DEL FRAMMENTO E DEL PLASMIDE RICEVENTE
(purificazione da gel) E LIGAZIONE
2. Purificazione del frammento e del plasmide donatore da gel di Agarosio
- aggiungere 500 µL di DF Buffer e mescolare brevemente vortexando;
- incubare a 50–55 °C fino a quando il gel è completamente sciolto (10-15 min) vortexando ogni 2
min;
- inserire la colonnina DF nell’apposito tubo e applicare 800 µL della soluzione gel-DF buffer
dentro alla colonna;
- centrifugare a 10000g per 30 secondi;
- eliminare l’eluato e reinserire la colonnina nell’apposito tubo;
- aggiungere 500 µL di Wash Buffer;
- centrifugare a 10000 g per 30 secondi;
- eliminare l’eluato e reinserire la colonnina nell’apposito tubo;
- centrifugare a 10000 g per 1 minuto per asciugare la resina contenuta nella colonnina;
- trasferire la colonnina in un tubo da 1.5 mL pulito;
- aggiungere 50 µL di Elution Buffer;
- incubare 1 minuti a temperatura ambiente;
- centrifugare a 16000 g per 1 minuti, eliminare la colonnina e marcare il tubo (numero del gruppo
e contenuto);
- conservare in ghiaccio o a -20 °C;
3. Quantificazione del plasmide ricevente e del frammento
- Corsa elettroforetica su gel di Agarosio 1% di:
a. una aliquota (2 µL) di plasmide ricevente purificato;
b. una aliquota (2 µL) di frammento purificato;
c. una quantità nota di DNA (DNA del fago λ) corrispondente a 50 ng;
Preparazione dei campioni a. e b. per il caricamento su gel:
2 µL di campione;
4 µL di Loading Buffer 6X;
18 µL di H2O;
- Far correre (a 90 V) fino a quando il fronte colorato supera i 4 cm dal margine superiore del gel
(± 30min).
- Quantificare, al transilluminatore, il frammento e il plasmide ricevente tramite confronto della
fluorescenza emessa dai due campioni e quella emessa dallo standard a quantità nota (λDNA, 50
ng).
[considerando che sono stati caricati 2 µL per ognuno dei due
campioni, qual è la loro concentrazione, espressa in ng/µL?]
2. LIGAZIONE
- Si vogliono utilizzare 50 ng di plasmide ricevente (chiamato anche vettore). A quanti microlitri
(yy µL) corrispondono 50 ng, in base alla concentrazione determinata al punto precedente?
- Determinare la quantità (in ng) di frammento da utilizzare per la ligazione, secondo un rapporto
di ligazione frammento:vettore = 3:1 (si applichi la formula indicata nel riquadro sotto riportato).
- Determinare il volume (xx µL) di frammento da utilizzarsi, conoscendone la concentrazione e la
quantità necessaria (in ng).
- Allestire la reazione di ligazione come descritto sotto:
frammento
pl. ricevente
T4 ligasi (0.5U/µL)
buffer Ligasi 10X
H2O
x µL
y µL (corrispondenti a 50ng)
2 µL
2 µL
a volume
20 µL
- Incubare a 4°C overnight
PLASMIDE
RICEVENTE
LINEARIZZATO
FRAMMENTO
LIGAZIONE
Materiali:
TAE (Tris/acetate/EDTA) electrophoresis buffer 50X 242 g Tris base
57.1 mL acido acetico glaciale
100 mL 0.5 M EDTA pH8.0
Portare a 1 L con H2O
Loading buffer (6X) 0.25% Blu di bromofenolo
30% (w/v) glicerolo
Gel di agarosio 1%
guanti!!
- pesare 1 g di agarosio in una beuta;
- aggiungere 100 mL di tampone di corsa TAE 1X
- sciogliere in forno a microonde
- aggiungere 5 µL di etidio bromuro (stock 10 mg/mL)
- colare il gel