STEREOISOMERIA
Ci sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli
oggetti di forma piana, ad esempio. Così, se prendo un alchene e lo confronto
con la sua immagine allo specchio:
H
CH3
F
Cl
H3C
H
Cl
F
vedo che si tratta della stessa molecola, perché basta girarla sull’altro lato per
ottenere la sua immagine.
Ciò non è sempre vero per oggetti tridimensionali; un caso tipico è quello delle
mani:
la destra e la sinistra sono speculari fra loro, ma non sono uguali, tant’è vero che il
guanto destro e il sinistro non sono intercambiabili. Questo è perché sono oggetti
privi di elementi di simmetria: il palmo della mano e il dorso non sono uguali,
mentre le due facce dell’alchene sopra rappresentato lo sono.
Fra le molecole organiche non sovrapponibili alla loro immagine speculare ci sono
quelle in cui un atomo di carbonio, ibridizzato sp3, è legato a quattro atomi o
gruppi tutti diversi fra loro.
Ma quali sono le caratteristiche chimiche e fisiche di una sostanza di questo
genere? Una molecola non sovrapponibile alla propria immagine speculare si
dice CHIRALE, un termine che deriva dalla parola greca che significa “mano”. Un
atomo di carbonio legato a 4 sostituenti diversi è un carbonio asimmetrico; non
tutte le molecole chirali hanno un atomo di C asimmetrico (alcune sono
intrinsecamente asimmetriche per la loro forma complessiva, come si vedrà in
seguito), ma tutte le molecole con un atomo di C asimmetrico sono chirali (non è
detto che lo siano se ne hanno più di uno: vedremo anche questo).
Per quanto riguarda le caratteristiche chimiche e fisiche bisogna distinguere se la
sostanza che abbiamo è una miscela delle due immagini speculari (dette
enantiomeri) in uguale quantità, o se si tratta di un solo enantiomero puro. I due
enantiomeri puri, separati, hanno le stesse caratteristiche fisiche e chimiche,
tranne nel caso che debbano interagire con qualcosa che sia a propria volta
asimmetrico (un guanto destro e uno sinistro di uno stesso paio hanno lo stesso
colore, la stessa massa, la stessa lunghezza, ma non si infilano allo stesso modo su
una mano destra). La miscela dei due enantiomeri in quantità uguali si chiama
RACEMO o miscela racema, e non ha le stesse proprietà fisiche di ciascuno dei
due enantiomeri da solo (in genere ha comunque proprietà fisiche molto simili). La
reattività chimica con sostanze non chirali è uguale sia per ciascun enantiomero
che per il racemo. L’unico modo per distinguere due enantiomeri è quello di farli
interagire con un mezzo chirale. Un modo molto usato prevede l’utilizzo di luce
polarizzata. Normalmente la luce è composta di onde elettromagnetiche che si
propagano lungo tutti i piani; nella luce polarizzata l’onda elettromagnetica si
propaga lungo un solo piano (vedi figura):
il filtro polarizzatore 1 elimina tutte le
onde che vibrano su piani non
paralleli alle sue fenditure; il secondo
filtro 2, se ha le fenditure parallele al
primo,
lascia
passare
il
raggio
polarizzato, altrimenti lo blocca.
Se un raggio di luce polarizzata viene fatto passare attraverso un cristallo
trasparente di una sostanza chirale (un solo enantiomero) oppure attraverso una
soluzione contenente un solo enantiomero, l’effetto è quello di far ruotare di un
certo numero di gradi il piano in cui vibra la luce: un filtro 2 con le fenditure
parallele a quelle del filtro 1 a questo punto non lascerebbe più passare la luce.
Il motivo di questo è che in una molecola, gli elettroni non sono liberi di oscillare
ugualmente in tutte le direzioni (la polarizzabilità delle molecole è anisotropa).
Interagendo con gli elettroni oscillanti, le radiazioni elettromagnetiche polarizzate
ruotano sempre lievemente il proprio piano di oscillazione; in un grande insieme di
molecole achirali, però, per ogni molecola che incontra la luce ce n’è una
identica, orientata come la sua immagine speculare, che annulla esattamente il
suo effetto. In un campione puro di un solo enantiomero nessuna molecola può
servire da immagine speculare di un’altra, non c’è annullamento delle rotazioni e
si ha attività ottica.
sorgente luminosa
cella
portacampione
filtro polarizzatore
filtro analizzatore
In uno strumento in grado di analizzare questo effetto, detto polarimetro, il raggio
di luce viene ruotato di un angolo che dipende dalle caratteristiche intrinseche
della sostanza analizzata (potere rotatorio), dalla concentrazione della soluzione e
dalla lunghezza della cella. Se all’inizio i due filtri sono paralleli, si deve ruotare il
filtro analizzatore finché si vede emergere il raggio di luce: l’angolo così osservato,
α, per i due enantiomeri di una stessa sostanza ha valore uguale e segno contrario
(uno ruota la luce a destra, l’altro a sinistra di un angolo uguale). La miscela
racema non ruota la luce: i due effetti si annullano. Una miscela dei due
enantiomeri in quantità disuguali non è un racemo, ma ruota la luce di un angolo
che dipende dall’eccesso enantiomerico, cioè dalla differenza tra le due
quantità. Ogni sostanza chirale è caratterizzata da una proprietà detta rotazione
specifica [α
α]D = α / L c in cui L = lunghezza della cella (dm) e c = concentrazione
della soluzione (g cm-3). La rotazione specifica dipende dal solvente, da T e dalla
λ della luce polarizzata(D indica la lunghezza d’onda della linea D del sodio, pari
a 5893 Å). Per liquidi puri, c corrisponde alla densità.
Se una sostanza è presente in due enantiomeri, occorre un modo per denominarli
distinguendone la CONFIGURAZIONE ASSOLUTA, cioè la disposizione degli atomi
intorno al carbonio asimmetrico; la correlazione fra verso di rotazione (per
convenzione il segno + indica rotazione verso destra e – verso sinistra) e
configurazione assoluta non è ne’ ovvia ne’ immediata, ma si determina solo
sperimentalmente.
La configurazione assoluta dell’enantiomero viene specificata attraverso la
nomenclatura R-S. Si procede come segue:
• si identificano i quattro diversi gruppi legati al carbonio chirale
• si numerano in ordine decrescente di priorità in base alla massa dell’atomo
direttamente legato e, se uguale, man mano di quelli successivi
• si orienta la molecola in modo da guardarla lungo la direzione che va dal C
asimmetrico al sostituente con priorità minore.
• stabilire se gli altri tre sostituenti sono disposti in ordine decrescente in senso
orario (enantiomero R, rectus) oppure antiorario (enantiomero S, sinister).
In questo esempio, l’enantiomero è
A
R perché la sequenza A, B, C si
D
determina in senso orario. L’altro
B
enantiomero si chiama S.
C
Un modo schematico per rappresentare queste molecole è costituito dalle
PROIEZIONI DI FISCHER, molto usate per gli zuccheri. In esse le linee orizzontali
rappresentano legami diretti verso l’osservatore e quelle verticali legami diretti
lontano dall’osservatore.
B
B
A
B
C
D
A
D
C
D
A
C
In
questa
proiezione
il
sostituente a minor priorità
sarebbe C: disponendolo
come nella figura sopra, la
sequenza
A,B,D
sarebbe
antioraria, cioè sinistra, S.
Per trasformare una proiezione di Fischer in un’altra equivalente dello stesso
enantiomero si possono scambiare fra loro due coppie di sostituenti a piacere.
Scambiandone una sola si ottiene l’enantiomero opposto.
Una molecola può avere più di un atomo asimmetrico.
Nel caso in cui ne abbia due, i due carboni asimmetrici possono essere entrambi
speculari fra loro, oppure uno uguale e uno speculare:
H3C
H Cl
Br H
CH3
Cl H
CH3
H3C
H
Br
2R, 3S
2S, 3R
H3 C
Cl
H
Br H
CH3
H
Cl
H3 C
2R, 3R
CH3
H
Br
2S, 3S
enantiomeri
enantiomeri
Il 2-cloro-3-bromobutano qui illustrato, nella sua forma 2S, 3R è enantiomero della
forma 2R, 3S mentre non è ne’ enantiomero ne’ uguale rispetto alla 2R, 3R, in
quanto il C che porta il bromo è uguale mentre quello col cloro è speculare.
Queste due forme quindi si dicono fra loro DIASTEREOISOMERE: si tratta di molecole
chimicamente e fisicamente diverse, e si possono quindi separare fra loro con
normali metodi fisici o chimici, senza l’aiuto di mezzi chirali.
In generale, il massimo numero di stereoisomeri possibili per un composto che ha n
atomi asimmetrici è 2n. Vi può essere anche un numero di stereoisomeri minore del
massimo possibile, qualora alcuni siano uguali fra loro.
H3C
Cl H
HCl
CH3
Cl H
H3C
CH3
H
Cl
queste due molecole sono identiche, grazie
alla presenza di un piano di simmetria
H3C
Cl H
H3C
Cl H
Cl
H
CH3
H
Cl
H3C
HCl
CH3
CH3
H3C
Cl H
H
Cl
CH3
H
Cl
piano di simmetria
Il composto qui indicato è detto forma MESO, non è otticamente attiva perché
non è chirale, in quanto le due metà della molecola sono immagini speculari l’una
dell’altra.
COOH
COOH
H
HO
HO
OH
H
H
H
OH
COOH
COOH
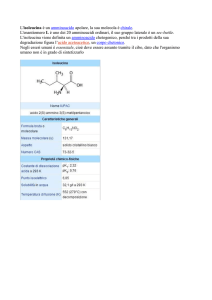
Acido (+)-tartarico, (R,R)
T.Fus. 170°C
αD = + 13,5° in acqua
Acido (-)-tartarico, (S,S)
T.Fus. 170°C
αD = - 13,5° in acqua
Acido (±)-tartarico racemo
T.Fus. ≈ 210°C (dec)
COOH
COOH
H
OH
HO
H
H
OH
HO
H
COOH
Acido meso-tartarico, (R,S)
T.Fus. 165°-166°C
αD = 0
COOH
Quindi l'acido tartarico esiste sotto forma di due coppie di enantiomeri,
diastereoisomere fra loro, una delle quali otticamente inattiva perché le due
immagini speculari sono uguali fra loro (ovvero perché la struttura possiede un
piano di simmetria).
Allo scopo di separare fra loro gli enantiomeri che compongono una miscela
racema, uno dei metodi è quello di farli reagire con un’altra sostanza chirale (un
solo enantiomero) in modo da trasformare i due enantiomeri in diastereoisomeri.
Se gli enantiomeri da separare hanno proprietà acide o basiche, si possono
salificare con una base o un acido chirale:
SO3H
O
CH3
H
acido (+)-10-canforsolfonico
NH2
S-(-)-α-(1-naftil)-etilammina
R-talidomide
sonnifero
S-carvone
cumino
S-talidomide
teratogeno
R-carvone
menta
Vi sono anche molecole inerentemente chirali, anche senza avere un carbonio
asimmetrico: sono le molecole prive di elementi di simmetria perché, ad esempio,
elicoidali, come gli eliceni:
enantiomeri dell’esaelicene