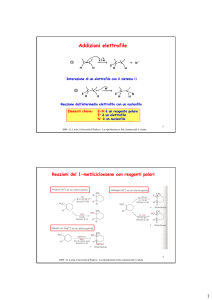
Ossidazioni e Riduzioni
Ossidazione: Perdita di elettroni da un elemento
Rid i
Riduzione:
A
Acquisto
i t di elettroni
l tt
i
Per i composti organici:
Ossidazione: Rimozione di atomi di idrogeno
g
o introduzione di
eteroatomi in una molecola
Riduzione: Addizione di atomi di idrogeno o rimozione di
eteroatomi in una molecola
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Livello di ossidazione delle molecole organiche
Scrivere il meccanismo per le trasformazioni descritte sopra
2
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Livello di ossidazione delle molecole organiche
Addizione di acqua – stato ossidazione invariato
3
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Livello di ossidazione dell’azoto
4
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
Idrogenazioni metallo catalizzate
Reazione a più stadi – stereospecifica (addizione sin)
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
5
Catalizzatori per idrogenazione:
Metallo finemente distribuito su una superficie inerte:
Platino, palladio, nickel (5(5-10%) su carbone o CaCO3
Adam’s
Adam
’s catalyst
catalyst:: PtO2.H2O (precatalizzatore
(precatalizzatore).
). In presenza di H2 si
riduce a Pt metallico sul supporto
Pd/C Pd/CaCO3
Solventi: etanolo, acido acetico, metilen cloruro, eteri. 1
1--5 atm H2.
6
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
3
Reazioni di idrogenazione: stereochimica e chemoselettività
Stereospecifica, chemoselettiva,
chemoselettiva, può essere stereoselettiva
7
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni di idrogenazione: alchini
Difficile da fermare a livello di olefina.
Se il catalizzatore viene ‘avvelenato’ diventa meno efficiente ma più
selettivo
Lindlar catalyst:
catalyst: Pd/CaCO3 + chinolina e piombo acetato
8
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
4
Esercizio: quale è il prodotto di reazione atteso per i seguenti
composti con eccesso di H2 e 5% di Pd/C?
9
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni di idrogenazione: composti azotati
Diversi gruppi funzionali contenenti azoto possono essere ridotti via
idrogenazione. Gruppi ciano e azido
azido,, facilmente inseribili in molecole via
reazioni di sostituzione possono essere trasformati in ammine
+1C
10
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
5
Reazioni di idrogenazione: Reazione di Mitsunobu
Trasformazione alcol –ammina primaria stereospecifica.
Inversione di configurazione.
Come altro potreste fare l’ammina dall’alcol?
11
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni di idrogenazione: composti azotati.
Riduzione gruppi nitro aromatici. Sintesi di aniline
Esercizio: disegnare la struttura del prodotto principale atteso
dalle seguenti reazioni
12
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
Ossidazione: Rimozione di atomi di idrogeno o introduzione di
eteroatomi (ossigeno
(ossigeno)) in una molecola.
Molecole ad elevato contenuto di ossigeno: O2, O3, RCOOOH, KMnO4,
CrO3, K2Cr2O7, OsO4, NaIO4
Ossigeno molecolare
ossigeno in stato di tripletto
tripletto,, elettroni spaiati (inerte cineticamente).
cineticamente). Ossigeno di
singoletto molto più reattivo. Si ottiene per eccitazione fotochimica in presenza di un
fotosensitizzatore
Ossigeno di singoletto
singoletto:: reagisce via reazioni di cicloaddizione (pericicliche)
pericicliche)
per fare endoperossidi
endoperossidi))
13
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni di DielsDiels-Alder (cicloaddizioni 4+2)
Stereospecifica (è un processo concertato)
14
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
7
Endoperossidi naturali: Artemisinina (antimalarico
naturale estratto dalla Artemisia annua) e suoi derivati
Artemisinina
Artemether
Artemisia annua
Acido Artenilico
Artenimolo
Artemotil
Artesunate
15
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ozono: reazioni di ozonolisi
Ozono: molecola dipolare (1,3 dipolo)
Reagisce con un alchene via un meccanismo [4+2] portando ad una
specie chiamata molozolide che è instabile e riarrangia a ozonide
ozonide..
Gli ozonidi posso essere opportunamente trattati ((work
work up ossidativo
MeSMe)) per fornire i corrispondenti
(H2O2) o riduttivo (Zn.H2O o MeSMe
16
composti carbonilici
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
8
reazioni di ozonolisi
Workup ossidativo:
H 2O 2
H
Workup riduttivo:
Zn/H
Zn
/H2O; Me2S
17
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ozonolisi riduttiva: si ottiene l’aldeide e il chetone corrispondente
alla rottura del doppio legame
Esercizio: disegnare la struttura del prodotto principale atteso
dalle seguenti reazioni con work up ossidativo e riducente
18
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
9
Osmio tetrossido:
Anche in questo caso possiamo utilizzato il meccanismo di cicloaddizione
concertato [4+2] per descrivere la reazione di ossidazione di un doppio legame
legame.. Il
prodotto finale è un diolo e la reazione di ossidazione (addizione) è stereospecifica
(cis addizione).
addizione).
19
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
L’osmio tetrossido è tossico e costoso e quindi si preferisce usarlo come
catalizzatore in presenza di altri ossidanti primari:
R
H2 O
R
R
O
O
HO
6
OH
L*
O
Primary Cycle
(High ee.s)
O Os O
O
1
R
O
R
R
Os
O L* O
9
NMM
L*
R
y
Secondaryy Cycle
(Low ee.s)
O
O
R
MNO
R
R
O
R
O Os
O
O
8
L*
O
O
R
R
10
L*
L*
O
O
Os
H2 O
R
R
R
6
HO
OH
20
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
10
Osmilazione – osmio tetrassido come catalizzatore
R
OsO4 + L* (amine) +
R
R
R
O
O
O Os
O
O
L*
R +
N
O Me
O
O Os
O
O
L*
R
O
O Os
O
O
L* O
Me
(5)
R
R
(6)
N
O
R
O
O Os
O
O
L* O
R
N
Me
O
O
O
Os
O L* O
R
R
O
O
+ H2O
R
N
O Me
+
R
OsO4.L* +
N
Me
R
+ H2O
R
HO
R
OH
(7)
(8)
OH
(9)
OsO4 + L*
O
+
O
R
R
HO
OsO4.L*
R
O
O
Os
O L* O
O
O
+
N
(10)
Me
21
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Osmilazione – reazione stereospecifica
22
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
11
Esercizio: scrivere la struttura del prodotto principale atteso dalle
seguenti reazioni evidenziandone la stereochimica.
23
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Sodio periodato: gli ioni periodato sono in grado trasformare i
dioli portando a composti aldeidici corrispondenti.
Possono essere utilizzati in concerto con l’osmio tetrossido
(Lemeiux
Lemeiux--Johnson cleavage
cleavage))
Meccanismo
24
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
12
La rottura ossidativa di un doppio legame C=C porta sempre al
corrispondente composto carbonilico se all’atomo di carbonio non
sono legati dei protoni.
Se sono legati dei protoni si può ottenete l’aldeide corrispondente
o l’acido carbossilico, a seconda delle condizioni di cleavage
utilizzate
25
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Epossidi: si possono ottenere per ossidazione di alcheni. Generalmente si
utilizzano peracidi (acido peracetico).
peracetico). Sono sostanze esplosive e sensibili anche
agli shock meccanici
Meccanismo
(reazione stereospecifica, sin addizione)
L’ossidazione è elettrofila per cui olefine elettron ricche saranno più reattive
Quale prodotto si formerà?
26
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Sintesi di Epossidi: via addizione stereospecifica e
SN2 o ossidazione con peracidi
27
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Sintesi di Dioli
Dioli:: via osmilazione o ossidazione con
peracidi/idrolisi. Controllo della stereochimica
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
28
14
Sintesi di epossidi ((ossirani
ossirani))
Stereochimica
ritenzione
inversione
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
29
Epossido (ossirani) – eteri ciclici
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
30
15
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
31
Controllo regiochimico della reazione
Sostituzione
Sost
tu o e alla
a a posizione
pos o e meno
e o sostituita
sost tu ta -meno
e o ingombrata
go b ata
32
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
16
Apertura di anello nucleofila, acido catalizzata
opposta regiochimica
33
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Controllo della regiochimica della sostituzione
pH 7
pH 3.8
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
34
17
Ossidazione di Alcoli Primari e Secondari
Eliminazione di due atomi di idrogeno per
generare il gruppo carbonilico
Analogie con meccanismi di tipo E1 o E2?
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
35
Ossidazione di Swern (E2)
H
O
C H
1. DMSO, ClCOCOCl, -78°C
2. Et3N
O
C
R
Reagente
t attivato
tti t
Meccanismo
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
36
18
Meccanismo
37
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Esercizio: Quale è il prodotto di questa reazione? Proporne un meccanismo
38
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
19
Cromo e Manganese ossidi come ossidanti di alcoli
A seconda del reagente e delle condizioni di
reazione è difficile fermare l’ossidazione di
un alcol
l l primario
i
i a livello
li ll di aldeide
ld id
L’ulteriore ossidazione del chetone è
difficile per cui la reazione è
altamente chemoselettiva
Non decorre
39
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Cromo ossido: reagenti più utilizzati
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
40
20
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reagente di Jones
41
(acido cromico e acido solforico)
Più reattivo – meno chemoselettivo con alcoli primari
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
42
21
Biossido di manganese
Ossidazione di alcoli allilici e benzilici ad aldeide
Ossidante più blando
non ossida alcoli primari e secondari alifatici
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
43
Esercizio: con quali reattivi effettuereste le ossidazioni riportate?
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
44
22
Iodo derivati altovalenti
Ossidazione di alcoli allilici e benzilici ad aldeide
Acido iodosobenzioco (IBX) Dess
Dess--Martin periodinano (DMP)
45
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Iodo derivati altovalenti
meccanismo
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
46
23
S-Adenosil Metionina - agente metilante
47
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ossidazione di alcoli in ambiente biologico:
un H- agisce formalmente da gruppo uscente
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
48
24
Nicotammide adenina dinucleotide (NAD+)
49
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
50
25
Processi coinvolti nel ciclo dell’acido citrico
(ciclo di Krebs)
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
51
26