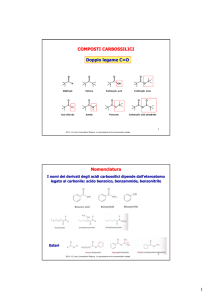
Addizioni elettrofile
Interazione di un elettrofilo con il sistema Π
Reazione dell’intermedio elettrofilo con un nucleofilo
Elementi chiave:
E-N è un reagente polare
E+ è un elettrofilo
N- è un nucleofilo
1
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
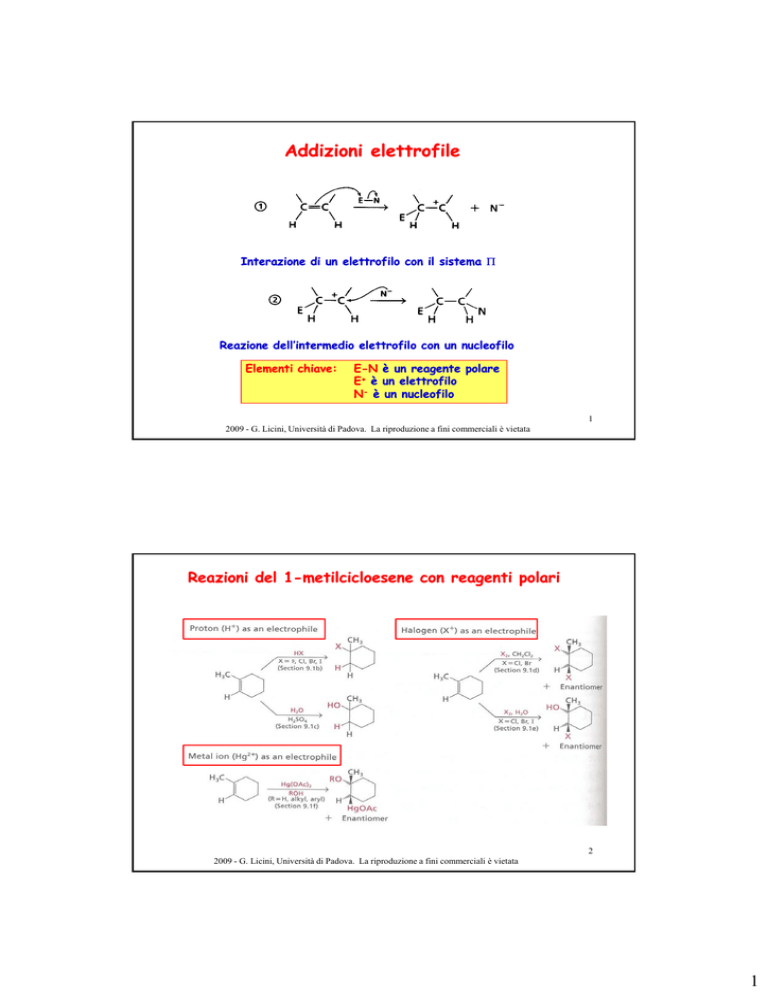
Reazioni del 1-metilcicloesene con reagenti polari
2
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Addizioni di acidi alogenidrici HX (X= Cl, Br, I)
Processo analogo alla SN1 - regiochimica
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
3
Postulato di Hammond
Regola di Markovnikov:
Markovnikov: La parte elettrofila del reagente addizione al
legame
g
P in modo da generare
g
il carbocatione p
più stabile
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
4
2
Addizioni di acqua in ambiente acido
(con base coniugata non nucleofila)
5
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Addizione di Cloro e Bromo
L’interazione del sistema Π con la molecola di bromo crea un
dipolo poiché c’è repulsione tra gli elettroni che circondano i
nuclei di bromo ed il sistema Π
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
3
7
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazione stereospecifica
Reazione stereoselettiva
8
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
4
Si ottengono i due enantiomeri 1:
1:1
1
Si ottiene un racemo (reazione stereospecifica, non stereoselettiva
stereoselettiva))
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
9
Ione bromonio dell’adamantilideneadamandano
Struttura ai raggi X
Natura ciclica dello ione bromonio
Non reattivo a causa dell’ingombro sterico
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
10
5
Addizione di X2 in acqua
Sintesi di Aloidrine
11
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Addizione di Bromo a olefine non
simmetriche
12
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
Regiochimica dell’addizione di bromo in acqua
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Regola di Markovnikov
La parte elettrofila del reagente reagisce preferenzialmente con il
carbonio che meglio stabilizza una carica positiva
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
14
7
Alcheni lineari
Reazione stereospecifica, non stereoselettiva (facce alchene enantiotopiche)
enantiotopiche)
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
15
Poiché lo iodio non addiziona ad un alchene per produrre un addotto stabile, può essere usato
in un’addizione in cui è presente un nucleofilo diverso dallo ioduro. Questa caratteristica
viene utilizzata nel processo di iodolattonizzazione, illustrato nell’equazione seguente
Proporre un meccanismo per questa trasformazione: Quale è la stereochimica attesa del
prodotto? E’ il prodotto chirale? E’ racemo?
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
16
8
Ossomercurazione - l’elettrofilo è un metallo
17
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ossomercuriazione vs addizione di H2O/acido
Il prodotto è lo stesso che si ottiene nell’addizione di acqua acido
catalizzata, non ci sono però rischi di riarrangiamento
18
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
9
Descrivere il meccanismo con cui le seguenti reazioni avvengono, la natura
dei prodotti e la relativa stereochimica
Quale è il prodotto principale delle seguenti reazioni?
19
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Se la reazione di ossimercuriazione viene condotta in metanolo anziché in
acqua il prodotto di reazione sarà l’etere
l etere metilico. Proporre un meccanismo
ragionevole per il primo stadio della reazione
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
20
10
Reazioni di addizione in sistemi biologici: biosintesi dello squalene
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
21
Gruppo uscente: pirofosfato
22
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
11
Il meccanismo di questa dimerizzazione biochimica avviene con lo stesso meccanismo della
dimerizzazione dell’isobutilene (che porta poi alla polimerizzazione). Il carbocatione si forma in modo
diverso ma il passaggio di addizione avviene con lo stesso meccanismo e regiochimica
regiochimica..
23
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni di idroborazione
organoborano
In questo caso abbiamo la reazione di un composto del boro, elettron deficiente, ottenendo
un organoborano (Herbert C. Brown,
Brown, Premio Nobel Chimica 1979).
Composti piroforici
Derivati più stabili e facili da utilizzare
24
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
12
Reazione di idroborazione con BH3.THF
25
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
I tre idruri del BH3 reagiscono con tre equivalenti di alchene.
Effetti stereoelettronici
possono compromettere
l’ l
l’ulteriore
i
reazione
i
d
deii
monoalchil o dialchil borani
Altri derivati del borano
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
26
13
Il borano reagisce in soluzione di THF con un equivalente di 2,32,3-dimetil
dimetil-2butene e forma il tesilborano (tesil sta per terzterz-esil
esil)) con formula C6H15B.
Scrivere la struttura di reagente e prodotto motivando il perché il tesilborano
è il prodotto principale di questa reazione.
Il borano reagisce in THF con il 2
2-metil
metil-2-butene a formare il dialchilborano
(sia)2BH, chiamato disiamilborano (sec-isoamil
isoamil))borano
borano,, nel quale il boro si leg al
C3 dell’alchene di partenza. Scrivere la struttura del prodotto.
27
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Stereochimica della reazione di idroborazione
Processo stereospecifico
Regiochimica
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
28
14
Effetti sterici
Scrivere la struttura del prodotto principale che si ottiene mediante trattamento
con BH3.THF (indicare quanti alcheni reagiranno e la stereochimica e regiochimica
dei prodotti)
29
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Idroborazione di alchini
La reazione procede con la stessa stereochimica e regiochimica osservata con
gli alcheni. Si ottiene una sin addizione con formazione di un legame C-boro al
carbonio terminale
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
30
15
Trasformazione degli organoborani in alcoli
Una delle trasformazioni più importanti di un organoborano è quella in cui viene trasformato in
un alcol (trasformazione di un alchene in un alcol e un alchino in aldeide)
La trasformazione avviene grazie alla natura di acido di Lewis dell’organo borano che
reagisce con un opportuno derivato (:X
(:X-Y) dormando un boronato e la relativa
trasformazione del residuo R in gruppo nucleofilo.
Il gruppo R migra dall’atomo di boro a X con uscita di Y (che deve essere un buon
gruppo uscente)
Per
P trasformare
t
f
un organo borano
b
nell’alcol
ll’ l l corrispondente
i
d t sii utilizza
tili
llo ione
i
idroperossido (HOO-)
31
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
La reazione avviene tre volte ottenendo un trialcossiborano
Idrolisi basica porta ad ottenere l’alcol
corrispondente
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
32
16
Processo di idrolisi globale
Formale addizione di H2O a doppi legami per sintetizzare alcoli
alcoli:
regiochimica opposta
Addizione anti
anti-Markonvicov
Addizione Markonvicov
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
33
Stereochimica migrazione del gruppo alchilico
La migrazione avviene con ritenzione di configurazione
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
34
17
Reattività vinil borani
Regiochimica della formale addizione di H2O ad alchini terminali
35
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Che prodotti vi attendete dalle seguenti reazioni?
Proporre un meccanismo plausibile per le seguenti reazioni.
36
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
18