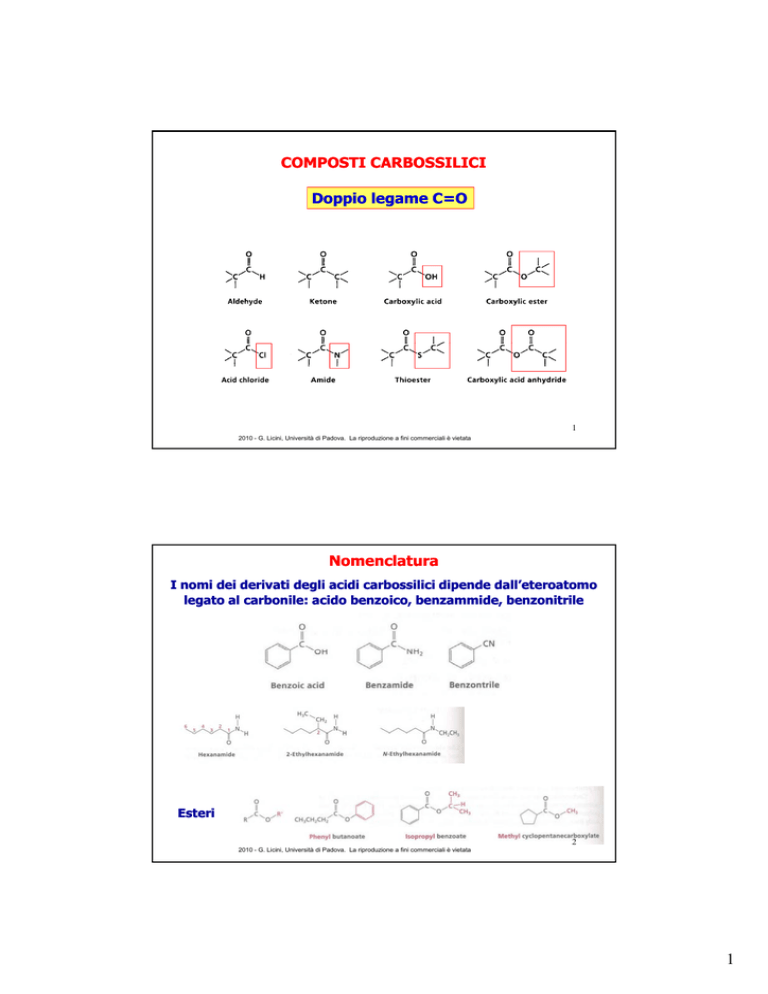
COMPOSTI CARBOSSILICI
Doppio legame C=O
1
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Nomenclatura
I nomi dei derivati degli acidi carbossilici dipende dall’eteroatomo
legato al carbonile: acido benzoico, benzammide,
benzammide, benzonitrile
Esteri
2
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Nomenclatura Cloruri degli acidi
3
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Nomenclatura Derivati acido formico e acetico
4
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
Reattività derivati acidi carbossilici:
Intermedio tetraedrico – Addizione Eliminazione
Derivati acidi carbonilici vs composti carbonilici
5
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reattività derivati acidi carbossilici:
Dipende dalla basicità del sostituente al carbonile
6
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
3
La reattività degli acidi carbossilici è
dominata dalla presenza del protone
Il protone è il centro più elettrofilo del gruppo funzionale.
Reazione con un nucleofilo. Formazione carbossilato
7
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Addizione ad un acido carbossilico in ambiente acido
Sintesi di esteri
Acido
Centro elettrofilo
Acido protonato
Centro elettrofilo
8
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
4
Nucleofilo
Deve mantenere il suo carattere nucleofilo anche in ambiente
acido e deve essere una base sufficientemente debole da non
deprotonare il carbonile attivato
ALCOLI
L’alcol si usa come solvente
9
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Esterificazione in condizioni acide
La rimozione di acqua
sposta l’equilibrio verso
destra
10
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
5
Quale è il prodotto atteso da queste reazioni?
Lattoni – esteri ciclici
11
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
γ-lattoni – più stabili
12
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
13
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
La formazione dell’intermedio
dell’intermedio tetraedrico domina il
meccanismo di reazione degli acidi carbossilici
14
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
7
Meccanismo di addizione
addizione-eliminazione
Non corretto!
15
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Acil cloruri – Preparazione
(con cloruro di tionile
tionile))
clorosolfinato
16
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
8
Completare e proporre un meccanismo per la seguente reazione
17
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Sintesi di esteri via acil cloruri
Sintesi di ammidi
18
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
9
Servono due equivalenti di ammina
(uno agisce da base)
Procedura di Schotten
Schotten--Baumann (utilizza un equivalente di NaOH
NaOH))
Lo ione idrossile è meno nucleofilo dell’ammina e non compete
19
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Esercizio
20
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
10
Anidridi (reattive quasi quanto gli acil cloruri)
21
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Idrolisi delle ammidi (condizioni basiche)
L’ammina deve uscire in forma neutra (protonata
(protonata))
perché un’ammide sarebbe un pessimo gruppo
uscente (base molto forte)
22
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
11
Idrolisi delle ammidi (condizioni acide)
La protonazione dell
dell’ammina
ammina sposta ll’equilibrio
equilibrio a destra
23
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Idrolisi di proteine enzima catalizzata
istidina
serina
Acido aspartico
Enzima
Substrato
Chimotripsina (serina proteasi)
proteasi)
Istidina – acido aspartico – serina – triade catalitica
24
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
12
Complesso EnzimaEnzima-Substrato
25
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Intermedio tetraedrico
26
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Nuovo peptide N-terminale
27
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Intermedio tetraedrico
28
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
14
29
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Alcuni dei dettagli più importanti nello studio del
meccanismo di azione della chimotripsina è stato
chiarito studiando l’idrolisi del p-nitrofenil acetato.
Scrivere i passaggi principali dell’idrolisi ad opera della
chimotripsina
30
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
15
Chimica dei nitrili
Idrolisi in condizioni acide
Idrolisi in condizioni basiche
31
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Chimica dei nitrili
32
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
16
Reazioni con i reagenti organometallici
Sintesi di chetoni
I chetoni possono reagire ulteriormente portando agli
alcoli terziari
33
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Gli organo cuprati non sono reattivi nei confronti dei chetoni e
quindi consentono di ottenere selettivamente il composto
carbonilico corrispondente
In condizioni controllate (bassa temperatura) anche i reagenti
di Grignard possono fermarsi a composto carbonilico
34
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
17
Reazioni con i reagenti organometallici
Reattività delle ammidi
La presenza di acqua acidulata consente l’uscita della ammina
un forma neutra, processo cineticamente più favorevole
35
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni con i reagenti organometallici
Reattività degli esteri
Il chetone è più reattivo dell’estere e quindi la
reazione non si blocca a livello di chetone
L’utilizzo di formiati porta ad alcoli secondari
36
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
18
Riduzione derivati degli acidi
LiAlH4 - sintesi di alcoli
NaBH4 - non è in grado di ridurre i derivati degli acidi – chemoselettivo nei
confronti dei derivati carbonilici
37
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Riduzione acidi carbossilici - LiAlH4
La riduzione prosegue fino ad alcol
38
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
19
Riduzione di ammidi - LiAlH4
39
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Riduzione di acil cloruri – LiAlH
LiAlH((tBuO
tBuO))3
La riduzione di un acil cloruro con il litio tri(terz-butil
butil))
alluminio idruro porta all’aldeide corrispondente che a bassa
temperatura non viene ridotta ulteriormente. L’idruro è più
ingombrato a causa della presenza dei t-BuO e reagisce in
modo più controllato. Il LiAlH(
LiAlH(tBuO
tBuO))3 si ottiene per reazione
del LiAlH4 con 3 equivalenti di t-BuOH
40
2010 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
20