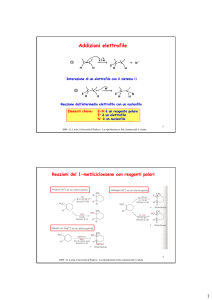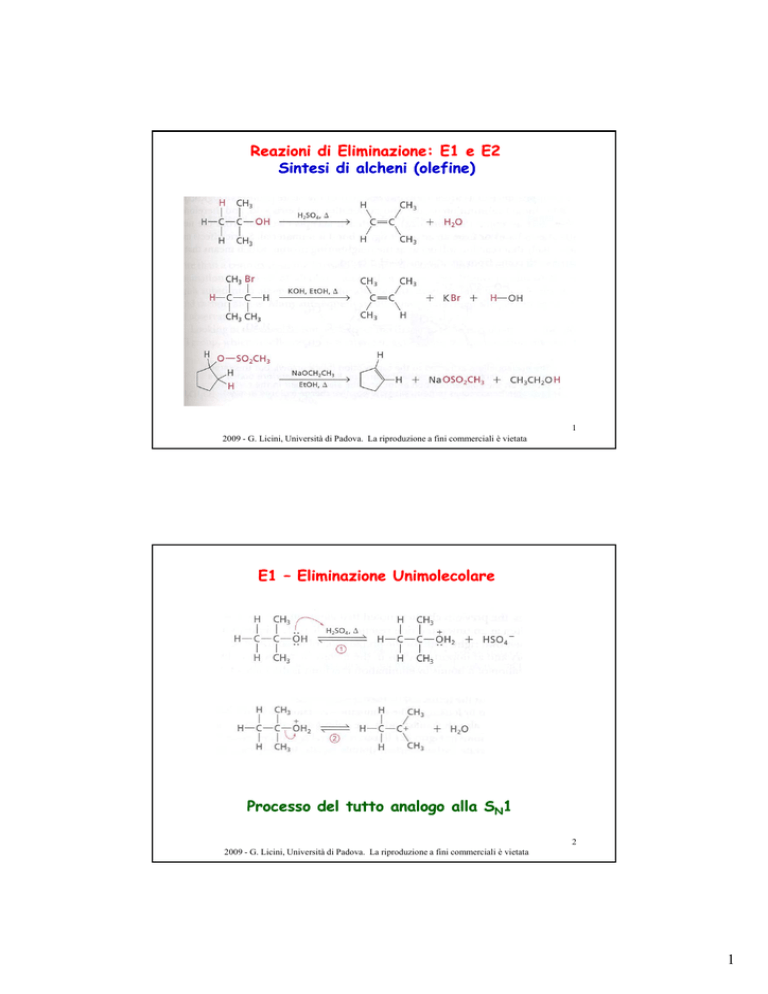
Reazioni di Eliminazione: E1 e E2
Sintesi di alcheni (olefine)
1
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
E1 – Eliminazione Unimolecolare
Processo del tutto analogo alla SN1
2
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Reattività dei carbocationi
1. Sostituzione
2. Eliminazione
3. Addizione
4. Riarrangiamento
3
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
C’è un ingombro troppo elevato per avere
attacco nucleofilo al carbocatione
Il nucleofilo è troppo debole
Avviene invece la rimozione dell’atomo di idrogeno
in α e spostamento del doppietto elettronico che
neutralizza la carica positiva
4
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
Perché la base riesce a rimuovere un protone in posizione
α? Perchè sono debolmente acidi
5
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
L’ingombro sterico favorisce la reazione di eliminazione con
basi ingombrate (HSO4-, H2PO4-)
(alcoli secondari e terziari - deidratazione
deidratazione))
Quale è il prodotto di eliminazione di queste reazioni?
6
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
3
Regiochimica delle reazioni E1
alchene terminale
alchene interno
Alchene terminale – minor ingombro sterico e statisticamente favorito
Alchene interno:Alchene terminale = 70:30
7
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Perché si forma l’alchene interno preferenzialmente?
alchene terminale – probabilmente è favorito cineticamente
8
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
4
La formazione dell’alchene è una reazione di equilibrio
La reazione procede sotto il controllo termodinamico
Prodotto Saytzeff
9
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Stabilità relativa di un alchene – Calori di idrogenazione
10
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
5
Disporre gli alcheni disegnati qui sotto in base alle quantità
crescenti di calore di idrogenazione che si liberano durante
l’idrogenazione catalizzata da Pd/C.
11
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Alcheni ciclici
Nomenclatura
12
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
Alogenuri alchilici – reazioni E1 vs SN1
13
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Quali sono i due prodotti di eliminazione che possono formarsi?
Quale sarà il maggioritario?
14
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
7
E2 – Eliminazione Bimolecolare
Eliminazione preferita alla sostituzione nucleofila
nucleofilo agisce da base
2009 - G. Licini, Università di
Padova. La riproduzione a fini
commerciali è vietata
15
Il processo viene denominato deidroalogenazione ed è concertato
La velocità dipende dalla concentrazione del substrato e
della base e quindi è una eliminazione bimolecolare E2
16
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
8
Stereochimica delle sostituzioni bimolecolari
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
17
Stereochimica delle eliminazioni bimolecolari
L’atomo di idrogeno e il gruppo uscente devono essere in
posizione antiperiplanare nello stato di transizione
18
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
9
Generalmente l’E2 produce l’alchene più sostituito
prodotto secondo Saytzeff
Nella deidroalogenazione si può però produrre
principalmente l’alchene meno stabile
19
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Processo stereospecifico
20
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
10
Stesso processo che avviene via E1
1
21
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
Dopo la rotazione i due Ph si trovano
da parti opposte
3
22
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
11
Quale è il prodotto maggioritario di questa E2?
Mostrate tutti rotameri sfalsati ed indicate quale è quello coinvolto nel processo di
eliminazione. Mostrate il meccanismo con cui avvengono i diversi passaggi
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
23
Reazioni E2 su cicloesil alogenuri
Br-H antiperiplanari
24
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
12
Per avere l’eliminazione il gruppo uscente è l’H
devono essere in anti (trans e diassiali
diassiali))
25
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Quale è il prodotto maggioritario di questa E2?
26
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Quale è il prodotto maggioritario di questa E2?
27
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Reazioni di eliminazione di alcoli primari: è una reazione E2
E2?
?
condizioni acide
28
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
14
Reazioni di eliminazione di alcoli primari con base
Trasformazione in esteri solfonici
Meccanismo E2
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
29
Quale è il prodotto principale nelle diverse condizioni di reazione?
Quale è la stereochimica dei prodotti?
30
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
15
Reazioni di sostituzione ed eliminazione per
alogenuri alifatici ed alcoli sono processi correlati
Substrati primari
1.
2.
3.
4.
5.
Substrati primari reagiscono via SN2 e E2
In presenza di un buon nucleofilo prevale la SN2 sulla E2
Basi forti come OH- o MeO- possono dare la SN2
Basi forti ingombrate
g
forniscono E2
Elevate temperature favoriscono reazioni E2
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
31
Substrati secondari
1.
2.
3.
4.
Substrati secondari possono reagire via SN1, SN2, E1 e E2
Forti nucleofili e basse temperature favoriscono la SN2
In condizioni di solvolisi si ottengono SN1 e E1
Alcoli
l l secondari in condizioni acidi reagiscono via E1
E in
presenza di basi coniugate non nucleofile
5. Elevate temperature favoriscono reazioni E2
Substrati terziari
1. Substrati terziari reagiscono
g
prevalentemente
p
via E1 se
viene usato un debole nucleofilo.
2. In condizioni di solvolisi possiamo avere SN1.
3. Un alcol terziario reagisce solo in acido forte. Ad elevata
temperatura il prodotto è E1.
32
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
16
Eliminazione verso sostituzione (alogenuri o solfonati)
33
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Eliminazione verso sostituzione (alcoli)
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
34
17
Esercizi
35
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Eliminazione in sistemi biologici
• Il substrato deve avere un buon gruppo uscente
o che possa essere trasformato facilmente in
un buon gruppo uscente
• Deve essere presente una base per rimuovere il
protone in beta
substrato
strato deve legarsi
gars al
a sito
s to attivo
att o con la
a
• Il su
corretta conformazione
36
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
18
Proporre un meccanismo che spieghi la formazione dell’1dell’1-etilcicloesene.
Come possiamo ottenere il derivato esociclico
esociclico?
?
Disegnare le strutture dei prodotti attesi. Indicare la stereochimica, se
necessario, indicando se si ottiene un composto racemo o enantiopuro.
enantiopuro.
Se la reazione non decorre indicare NR
2009 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
37
19