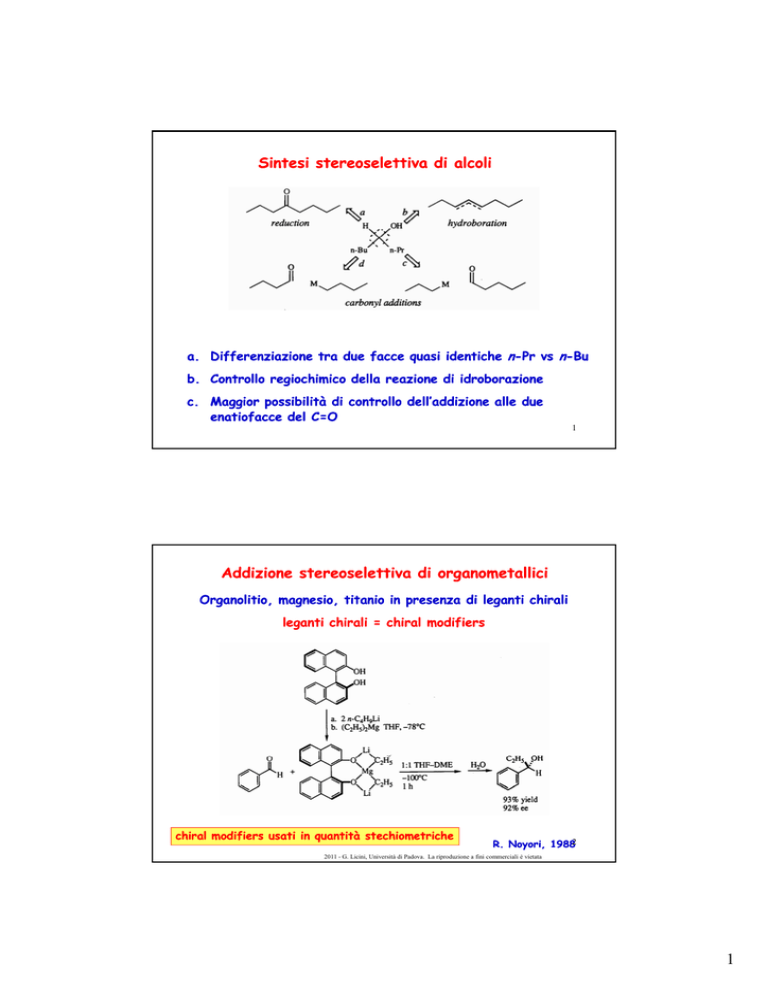
Sintesi stereoselettiva di alcoli
a. Differenziazione tra due facce quasi identiche n-Pr vs n-Bu
b. Controllo regiochimico della reazione di idroborazione
c. Maggior possibilità di controllo dell’addizione alle due
enatiofacce del C=O
1
Addizione stereoselettiva di organometallici
Organolitio, magnesio, titanio in presenza di leganti chirali
leganti chirali = chiral modifiers
chiral modifiers usati in quantità stechiometriche
R. Noyori, 19882
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
1
Alchilazioni stereoselettive con leganti chirali aprotici
3
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Alchilazioni stereoselettive con leganti chirali protici
4
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
2
Addizione C=O catalizzata di organometallici
Sistema stereoselettivo catalitico
organometallico chirale
5
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Sistema stereoselettivo catalitico
1. Addizione R
R-M-X* / Aldeide: stati di transizione
diastereoisomerici ad energie sufficientemente diverse
2. Effetto accelerante del legante
3. X* deve staccarsi del prodotto e rientrare nel ciclo catalitico
4. Sistema multivariabile (configurazione organometallico, numero
di coordinazione, polarità dei legami) – forte influenza delle
proprietà stereo
stereo-elettroniche
5. Possibile
P
b l formazione
f
di
d aggregati
6
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
3
Sistema stereoselettivo catalitico con organolitio
bassa cataliticità
elevata reattività organometallico di partenza (basso LAE)
7
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Addizione di dialchilzinco ad aldeidi
in idrocarburi o eteri
la reazione non avviene
in presenza di additivi
il sistema diventa reattivo
(ligand accelerating effect)
8
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
4
Screening sistematico di ammine/alcoli
rese in prodotto di addizione
R. Noyori
9
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Screening sistematico di ammine/alcoli
1. Non solo leganti protici incrementano le velocità dei
reazione ma anche diammine aprotiche
2 β
2.
β-ammino alcoli non sono buoni leganti.
leganti La loro reattività
aumenta se N-alchilati e stericamente tensionati
10
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
5
(-)-3-exo
exo-(dimetilammino)isoborneolo
β-dialchilammino alcol ad elevato controllo sterico
11
R. Noyori
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Sintesi di alcoli secondari via alchilazione
stereoselettica catalizzata da ((-)-DAIB
12
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
6
Altri leganti tipo ((-)-DAIB
Relazione configurazione stereocentro alcol legante/prodotto
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
R. Noyori
Configurazione legante/prodotto: Regola empirica
14
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
7
Sintesi di un intermedio dell’ α-tocopherol
15
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Modelli di stato di transizione
Stechiometria aldeide:R2Zn:DAIB
notevole influenza sulla reattività
16
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
8
Modelli di stato di transizione
Catalizzatore: alchil zinco alcossido
Specie attiva: complesso dinucleare di zinco
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
17
K. Houk
Meccanismo di reazione
18
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
9
Origine dell’elevata stereoselezione
19
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Relazione ee legante/ee prodotto
Perché non è lineare se la specie attiva ha solo
una molecola di legante coordinata?
20
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
10
Andamento non lineare
(deviazione positiva)
AMPLIFICAZIONE
DELLA CHIRALITA’
21
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Meccanismo di reazione
22
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
11
Legante enantiopuro:
dimero omochirale enantiopuro
Legante racemo: dimero omochirale racemo + dimero eterochirale
23
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Dimero omochirale (C2) e eterochirale (Ci, meso)
Raggi X
24
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
12
Dimero omochirale + dimero eterochirale:
reazione con R2Zn/ArCHO
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
25
Dimero eterochirale + R2Zn/ArCHO (1H NMR)
Scarsa reattività
26
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
13
Dimero omochirale + R2Zn/ArCHO (1H NMR)
Più reattivo
27
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Legante non enantiopuro (ee=15%)
L’enantiomero minoritario viene ‘sequestrato’ come dimero
eterochirale che non dissocia. Il legante enantiopuro in eccesso
fornisce il catalizzatore via formazione del dimero omochirale
28
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
14
Ossazaborolidine chirali (catalizzatore bifunzionale)
bifunzionale)
Corey-Bakshi-Shibata (CBS) Reduction
Coordinazione BH3
Doppia attivazione:
Base di Lewis (N…BH3)
Acido di Lewis (C=O….B )
favorito
sfavorito
29
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ossazaborolidine chirali (meccanismo proposto)
30
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
15
Ossazaborolidine/BH
Ossazaborolidine
/BH3
i due diastereoisomeri portano ai due alcoli enantiomerici
31
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
Ossazaborolidine:: Ottimizzazione del catalizzatore
Ossazaborolidine
32
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
16
Ossazaborolidine:: substrato
Ossazaborolidine
β-agonisti
33
34
17