15. Soluzioni_a.a. 2009/2010
SOLUZIONI
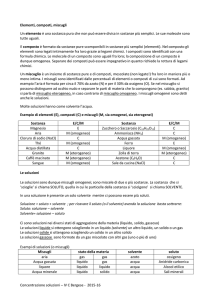
Una soluzione è una dispersione omogenea di due o più specie chimiche: il
soluto si scioglie nel solvente.
Il componente presente nello stato di aggregazione della soluzione o quello
presente in quantità maggiore è il solvente, gli altri componenti sono i
soluti.
Due sostanze si dicono miscibili se sono solubili l’una nell’altra in
qualsiasi proporzione.
La solubilità è la quantità massima di soluto che si scioglie in una quantità
fissa di solvente a una data temperatura. Può essere espressa in g/L, moli/L
etc.
Il processo di passaggio in soluzione avviene quando le interazioni
soluto/solvente sono più intense delle interazioni soluto/soluto e
solvente/solvente. C’è quindi la tendenza alla minima energia del sistema
e, nello stesso tempo, al raggiungimento di un grado maggiore di
disordine.
In termini termodinamici, la misura del grado di disordine di un sistema è
rappresentata da una funzione di stato detta entropia (S).
Le interazioni intermolecolari che si instaurano tra soluto e solvente sono
le stesse che esistono nelle sostanze pure e possono essere riassunte dal
seguente schema (tra parentesi sono indicati i valori delle forze in kJ/mol) :
1
15. Soluzioni_a.a. 2009/2010
Le particelle di soluto sono circondate da molecole di solvente in un
guscio di solvatazione (idratazione quando il solvente è acqua).
I componenti di una soluzione possono essere separati con soli mezzi fisici
(cristallizzazione, distillazione etc.) in quanto sono legati da interazioni più
deboli dei legami chimici.
Soluzioni gassose
Gas in Gas: sono le miscele gassose già esaminate. Le loro proprietà sono
definite dalle leggi dei gas (equazione di stato, legge di Dalton).
Tutti i gas sono miscibili.
Soluzioni liquide
Gas in Liquido: deboli interazioni soluto/solvente, la formazione della
soluzione è favorita da alta P e bassa T. Ad es. per O2 in H2O o CO2 in
H2O le molecole di gas sono racchiuse da una gabbia di molecole di acqua
unite tra loro da legame idrogeno.
Liquido in Liquido: H2O in etanolo (CH3CH2OH)
Solidi in Liquidi: NaCl in H2O
Soluzioni solide
Gas in Solido: le molecole di gas si dispongono negli interstizi del solido
(es. H2 in Pd)
Liquido in Solido: più rare, un esempio è Hg in Cd.
Solido in Solido: a causa della scarsa mobilità delle particelle che
costituiscono i solidi vengono generalmente preparate fondendo i due
componenti, miscelandoli e lasciandoli poi nuovamente solidificare.
Esempi sono le leghe metalliche. Queste possono essere sostituzionali (gli
atomi di un elemento sostituiscono quelli dell’altro nel reticolo) o
interstiziali (gli atomi di un elemento occupano gli interstizi) del reticolo
dell’altro elemento.
2
15. Soluzioni_a.a. 2009/2010
Al passaggio in soluzione è associata una variazione di entalpia ∆Hsoluz,
data dalla somma di tre fattori:
1. separazione delle particelle di soluto (∆Hsoluto)
2. separazione delle particelle di solvente (∆Hsolvente)
3. mescolamento di particelle di soluto e solvente (∆Hmescol)
∆Hsoluz = ∆Hsoluto + ∆Hsolvente + ∆Hmescol
Il processo può essere esotermico (∆Hsoluz < 0) se la somma dei termini
endotermici (∆Hsoluto + ∆Hsolvente) è minore del termine esotermico
(∆Hmescol) (ad esempio H2SO4 in H2O).
Viceversa, il processo è endotermico (∆Hsoluz > 0) se la somma dei termini
endotermici (∆Hsoluto + ∆Hsolvente) è maggiore del termine esotermico
(∆Hmescol) (ad esempio NH4NO3 in H2O).
3
15. Soluzioni_a.a. 2009/2010
La somma dei fattori entalpici dovuti al solvente e al mescolamento è il
calore di solvatazione (nel caso in cui il solvente è l’acqua calore di
idratazione):
∆Hsoluz = ∆Hsoluto + ∆Hsolvatazione
Nel caso della dissoluzione di un solido ionico il processo di idratazione
sostituisce ai molti legami idrogeno tra le molecole d’acqua, numerose
interazioni forti ione-dipolo, perciò il calore di idratazione di uno ione è
sempre positivo (processo esotermico).
I calori di idratazione saranno maggiori per ioni di carica maggiore e, a
parità di carica, saranno maggiori per ioni più piccoli.
Come le transizioni tra fasi, il processo di dissoluzione è,
microscopicamente, un processo di equilibrio dinamico: continuamente
specie disciolte ricristallizzano (precipitano) e si ridisciolgono: finché la
velocità di dissoluzione è maggiore della velocità di ricristallizzazione la
concentrazione rimane costante. Se, aggiungendo altro soluto, le due
velocità diventano uguali il soluto non disciolto (corpo di fondo) rimane in
equilibrio con la soluzione e il sistema è costituito dalle due fasi in
equilibrio: soluzione e corpo di fondo. Una tale soluzione è detta soluzione
satura.
4
15. Soluzioni_a.a. 2009/2010
Effetto di Temperatura e Pressione sulla Solubilità.
La solubilità della maggior
parte dei solidi aumenta
con la temperatura.
Il solfato di cerio (e altri
solfati) presentano un
diverso andamento: la
solubilità diminuisce con T
fino a raggiungere un
valore costante. L’effetto
della T sulla solubilità non
può direttamente essere
dedotto dal segno del ∆H
che si riferisce allo stato
standard di soluzione 1 M.
La concentrazione di una
soluzione satura è infatti
spesso molto diversa da
questo valore.
Nel caso dei gas invece, la solubilità diminuisce all’aumentare della
temperatura. Il contributo ∆Hsoluto al ∆Hsoluzione è infatti nullo perché le
particelle del gas sono già separate. Aumentando la T, aumenta l’energia
cinetica delle particelle di gas disciolte che si separano dalla soluzione e
tornano in fase gassosa.
La pressione non ha praticamente
effetto sulla solubilità dei solidi
poiché liquidi (solvente) e solidi
(soluto)
sono
praticamente
incompressibili. Nel caso dei gas
invece, la solubilità aumenta con la
pressione secondo la Legge di
Henry:la solubilità di un gas (Sgas) è
direttamente
proporzionale
alla
pressione parziale del gas sopra la soluzione (Pgas) tramite una costante di
proporzionalità (kH) specifica per ogni combinazione gas-solvente.
Sgas = kH ∙ Pgas
Un aumento della pressione parziale del gas aumenta infatti la probabilità
di urto tra le molecole del gas e la soluzione.
5
15. Soluzioni_a.a. 2009/2010
Unità di concentrazione
Due tipi principali:
a) rapporti massa/massa (peso/peso) indipendenti da T
b) rapporti massa/volume o volume/volume dipendenti da T
%w/w: percentuale in massa = g soluto / 100 g di soluzione (a)
%v/v: percentuale in volume = mL soluto / 100 mL soluzione (b)
X = frazione molare = n soluto / n soluto + n solvente (a)
m = molalità = n soluto / 1000 g solvente (a)
M = molarità = n soluto / 1 L soluzione (b)
Quando si miscelano due soluzioni o si diluisce una soluzione con il
solvente, la massa finale è data dallo somma delle masse miscelate (le
masse sono additive). Non così i volumi: la somma dei volumi iniziali può
essere diversa dal volume finale. La differenza, per soluzioni diluite di uso
comune, è però piccola e si considerano approssimativamente additivi
anche i volumi.
Si deve inoltre ricordare che:
V ∙ M = n = costante
Perciò quando un volume V1 di una soluzione a concentrazione M1 viene
diluito con il solvente fino ad un volume V2 la soluzione finale avrà
concentrazione M2 data da:
M2 = V1 ∙ M1 / V2
In tutti quei fenomeni che coinvolgono variazioni di T è opportuno
utilizzare la molalità che è indipendente dalla T ed è facilmente
determinabile sperimentalmente.
6
15. Soluzioni_a.a. 2009/2010
PROPRIETA’ COLLIGATIVE
Si tratta di una serie di proprietà delle soluzioni che non dipendono dalla
natura del soluto ma solo dal numero di particelle (molecole, ioni) di
soluto. Nel caso di soluti ionici si deve quindi considerare che il numero di
ioni dipenderà dalla stechiometria del composto: così ad esempio 1 L di
una soluzione 1 M di NaCl conterrà 2 moli di ioni, un L di soluzione 1 M
di CaCl2 conterrà 3 moli di ioni, mentre 1L di soluzione 1 M di glucosio
(C6H12O6, un composto covalente) conterrà 1 mole di molecole.
La previsione del numero di particelle in una soluzione di elettroliti deboli
(solo parzialmente dissociati in soluzione) verrà trattata successivamente.
Nel passare dal solvente puro a una soluzione si osservano i seguenti
fenomeni:
•
•
•
•
abbassamento della pressione di vapore
abbassamento della temperatura di congelamento
innalzamento della temperatura di ebollizione
osmosi
Proprio perché le proprietà colligative non dipendono dalla natura del
soluto ma solo dal numero di particelle, se due soluzioni hanno uguale
valore di una proprietà colligativa, avranno ugual valore di tutte le altre.
7
15. Soluzioni_a.a. 2009/2010
Abbassamento della Pressione di Vapore (∆P)
In una soluzione la probabilità che
una molecola di solventi evapori è
inferiore a quanto si osserva per il
solvente puro perché inferiore è la
superficie a disposizione del solvente
(parte di essa è occupata da particelle
di soluto).
Si osserva che la pressione di vapore del solvente (Psolvente) che insiste su
una soluzione in cui la frazione molare del solvente è Xsolvente è data dal
prodotto di tale frazione molare per la pressione di vapore del solvente
puro (P°).
Psolvente = Xsolvente ∙ P°
LEGGE DI RAOULT
Una soluzione ideale è una soluzione che segue la Legge di Raoult in tutte
le sue composizioni. Naturalmente i casi reali mostrano deviazioni dalle
legge, che però si possono trascurare per soluzioni diluite.
Poiché la concentrazione delle soluzioni è solitamente espressa in funzione
della quantità di soluto e non di quella di solvente, la Legge di Raoult
viene spesso espressa nel seguente modo:
Xsolvente + Xsoluto = 1
Xsolvente = 1 - Xsoluto
Psolvente = (1 - Xsoluto) ∙ P°
Ovvero:
P° - Psolvente = ∆P = Xsoluto P°solvente
Nel caso in cui il soluto sia un elettrolita forte, l’espressione va
moltiplicata per un coefficiente i , coefficiente di van t’Hoff, che tiene
conto del numero effettivo di particelle in soluzione. Come già detto i vale,
ad esempio, 2 per NaCl o KBr, 3 per CaCl2 eccetera.
8
15. Soluzioni_a.a. 2009/2010
Nel caso di soluti volatili, cioè di soluzioni di liquidi in liquidi (ad esempio
liquido A e liquido B) la Pressione totale che insiste sulla soluzione sarà
data dalla somma dei contributi dovuti ai due componenti, ovvero:
P = P A + PB
Per ognuno di essi si avrà, secondo la legge di Raoult:
PA = P°A XA
PB = P°B XB
In tal caso la Legge di Raoult può essere espressa graficamente mediante
un diagramma ternario in cui si ha in ordinate la composizione della
soluzione espressa in frazioni molari dei due componenti e in ascisse le
loro tensioni di vapore.
Per XA = 1 si ha il liquido A puro e il valore di pressione di vapore sarà
P°A, per XB = 1 si ha il liquido B puro e il valore di pressione di vapore
sarà P°B. Si noti che poiché P°B > P°A, il liquido B sarà più volatile del
liquido A.
Psoluzione
P°B
P°A
PB
Le due linee piene danno i valori di
pressione parziale di A e B sulla
soluzione, mentre la linea tratteggiata
(la somma delle due) dà il valore della
tensione di vapore della soluzione ad
ogni composizione.
PA
XA = 1
XB = 0
XA = 0
XB = 1
9
15. Soluzioni_a.a. 2009/2010
Si può dunque calcolare, in base alla Legge di Raoult e a quella di Dalton,
la relazione che esiste tra la composizione di una soluzione e quella del
vapore in equilibrio con essa.
Indichiamo con X’A e X’B le frazioni molari in fase vapore dei due
componenti A e B. Per la legge di Dalton:
X'A =
PA
P
=
PA
P°A XA + P°B XB
=
PA / P°A
XA + XB P°B/P°A
Ovvero
XA
X'A =
XA + XB (P°B/P°A)
Se P°B > P°A , cioè B è più volatile di A, allora sia avrà che P°B/P°A > 1 e,
poiché XA + XB = 1, il denominatore della frazione sarà >1 e X’A < XA
ovvero la quantità relativa di A in fase vapore sarà minore della quantità
relativa di A in fase liquida. Come peraltro ragionevole, il vapore sarà
dunque più ricco del componente più volatile.
Su queste considerazioni sono basati i processi di purificazione e
separazione dei liquidi per distillazione.
10
15. Soluzioni_a.a. 2009/2010
Ebullioscopia e Crioscopia (∆Teb, ∆Tcr,): innalzamento della T di
ebollizione e abbassamento della T di congelamento.
Il punto di ebollizione di un liquido è quello in cui coesistono in equilibrio
liquido e vapore. Poiché possa esistere l’equilibrio la P di vapore del
liquido deve essere uguale a P esterna.
Poiché la pressione di vapore di una soluzione è sempre minore di quella
del solvente puro, la sua T di ebollizione sarà maggiore: sarà infatti
necessaria una maggior quantità di energia per far evaporare un numero di
molecole sufficiente perché il valore della pressione di vapore raggiunga il
valore della pressione esterna e si abbia ebollizione.
La variazione della temperatura di ebollizione è proporzionale alla
molalità della soluzione tramite una costante di proporzionalità, la costante
ebullioscopia molale Keb, caratteristica di ogni solvente:
∆Teb = Keb m
In cui Keb = RT2/ΔHvap n
e sarà una caratteristica per ogni solvente.
Questa espressione può essere derivata applicando l’equazione di
Clausius-Clapeyron relativamente al passaggio di stato liquido/vapore al
sistema soluzione.
Un’analoga trattazione applicata al passaggio di stato liquido/solido, porta
all’espressione dell’abbassamento della T di solidificazione della
soluzione, anch’essa proporzionale alla molalità tramite la costante
crioscopia molale, Kcr, caratteristica di ogni solvente.
∆Tcr = Kcr m
11
15. Soluzioni_a.a. 2009/2010
La formazione della soluzione porta a un nuovo diagramma di stato, di
seguito rappresentato nel caso di una soluzione acquosa:
Anche in questo caso le espressioni vanno moltiplicate per i nei casi in cui
il soluto sia un elettrolita forte.
Dai dati di proprietà colligative, in particolare ebullioscopia e crioscopia
può essere calcolato il peso molecolare incognito di un soluto.
12
15. Soluzioni_a.a. 2009/2010
Osmosi
Il fenomeno dell’osmosi, ovvero la generazione di una pressione osmotica,
si applica solamente al caso delle soluzioni acquose.
Supponiamo di avere due recipienti, in uno è contenuto il solvente puro,
nell’altro una sua soluzione. Ognuno sarà caratterizzato da un suo valore di
P di vapore.
Se i recipienti vengono posti in una camera sotto vuoto, si stabilirà
l’equilibrio liquido/vapore per entrambi i campioni, ma poiché potrà
raggiungersi l’equilibrio per un UNICO valore della P, si avrà completa
evaporazione del solvente nella soluzione.
Se lo stesso esperimento viene ripetuto con due soluzioni a diversa
concentrazione, il solvente distillerà in quella più concentrata fino a che le
due concentrazioni non sono uguali.
Su questi principi si basa il fenomeno dell’osmosi.
13
15. Soluzioni_a.a. 2009/2010
Si origina quando due soluzioni, o una soluzione e solvente puro, sono
separate da una membrana semipermeabile, attraverso la quale possono
passare molecole di acqua (solvente) ma non molecole di soluto. Il
meccanismo di funzionamento di tali membrane può essere basato su
diversi fenomeni:
a) solubilità selettiva: solo il solvente è solubile nella membrana che
scambia molecole di solvente tra i suoi due lati per moti termici;
b) setaccio molecolare: la membrana lascia passare solo molecole di
determinate dimensioni o proprietà;
c) poiché le soluzioni ai due lati della membrana hanno diversa
concentrazione, esse hanno anche diversa tensione di vapore e si può
immaginare che il solvente distilli nella quella con tensione di vapore
minore (la soluzione più concentrata) .
L’apparecchio più semplice per mettere in evidenza il fenomeno
dell’osmosi è un tubo ad U i cui due rami sono separati da una membrana
semipermeabile:
Si ha passaggio di solvente e conseguente generazione di una pressione
idrostatica. Per impedire l’aumento di volume è necessario applicare una
pressione opposta alla pressione osmotica π.
La pressione osmotica dipende dalla Molarità della soluzione secondo la
relazione:
π = M RT
14
15. Soluzioni_a.a. 2009/2010
Analogie tra gas e soluzione:
1. all’equilibrio sia il soluto che il gas occupano tutto il V a
disposizione
2. in soluzioni ideali ciascun soluto si comporta come se fosse l’unico
soluto presente
3. alla P dei gas corrisponde una pressione osmotica, p, legata a T, n e
V da una relazione analoga all’equazione di stato dei gas:
π = n RT /V
Anche in questo caso le espressioni vanno moltiplicate per i nei casi in cui
il soluto sia un elettrolita forte.
La π è numericamente uguale alla P gassosa che il soluto eserciterebbe se
fosse allo stato gassoso con uguali valori di V e T.
Se una soluzione ha una proprietà colligativa uguale a quella di un’altra,
allora tutte le proprietà colligative saranno uguali.
15