ELEMENTI DI
EZIOPATOGENESI
DELLE
MALATTIE UMANE
Corso di Laurea
Magistrale in Farmacia
Il fegato è il principale organo metabolico
del nostro organismo, interviene in
numerosi processi di sintesi e di
trasformazione dei carboidrati, lipidi e
proteine e di eliminazione dei loro prodotti
terminali.
LE FUNZIONI DEL FEGATO
IL FEGATO HA TRE FUNZIONI FONDAMENTALI
FUNZIONE VASCOLARE, per il deposito del sangue
FUNZIONE SECRETORIA, secrezione bile canale
FUNZIONE METABOLICA MULTIPLA
L’unità funzionale è il LOBULO EPATICO
Presente in 50.000 – 100.000 unità
nel fegato umano
LE FUNZIONI DEL FEGATO
Le principali sostanze metabolizzate, immagazzinate
e secrete dal fegato sono:
- glucosio
- proteine
- bile
- lipidi
La funzione fondamentale esplicata dal fegato
nel metabolismo dei carboidrati è quella di
immagazzinare scorte di zucchero sotto forma
di glicogeno, oppure di scindere rapidamente
questa molecola, immettendo nel sangue
glucosio, in relazione alle esigenze che di volta
in volta l’organismo presenta.
La maggior parte delle proteine plasmatiche (a esclusione degli anticorpi
che sono prodotti dalle cellule del sistema immunitario) vengono
sintetizzate e secrete dal fegato.
Una delle proteine seriche più importanti è l’albumina.
Patologie epatiche che comportano una ipoalbuminemia possono portare
alla formazione di edema (gonfiore dovuto al ristagno di liquidi nello spazio
interstiziale).
Il fegato produce anche la maggior parte delle proteine responsabili della
coagulazione del sangue (fattori della coagulazione). Nel caso di carente
produzione di questi fattori possono verificarsi fenomeni emorragici.
La bile è un fluido di colore verdastro, sintetizzato dagli
epatociti ed escreto nei dotti biliari.
Defluisce dal fegato e viene temporaneamente immagazzinata
nella colecisti, per poi passare nell’intestino tenue.
La bile è composta principalmente da colesterolo, fosfolipidi,
bilirubina e sali biliari.
Il colesterolo è una sostanza che si trova nelle membrane cellulari e
aiuta a mantenere la normale struttura della cellula.
Il colesterolo viene sintetizzato dal fegato, e viene successivamente
distribuito nell’organismo per essere utilizzato; viene escreto nella bile.
Un aumento della concentrazione di colesterolo può predisporre alla
formazione di calcoli biliari.
Il fegato sintetizza anche le lipoproteine, costituite da colesterolo,
trigliceridi (contenenti acidi grassi), fosfolipidi e proteine. Le
lipoproteine circolano nel sangue e trasportano colesterolo e acidi
grassi (fonte di energia) tra il fegato e i tessuti corporei e viceversa.
Il fegato è strutturato in modo
da immagazzinare sostanze di
notevole importanza biologica, come
ad esempio il glucosio sottoforma di
glicogeno,
vitamine
liposolubili
(vitamine A, D, E e K), folati, vitamina
B12 e minerali, come rame e ferro.
Il fegato rimuove dal sangue sostanze tossiche, per esempio
l’ammoniaca, e successivamente le catabolizza o le trasforma
in composti meno dannosi per l’organismo.
Inoltre il fegato svolge un ruolo chiave nel metabolismo della
maggior parte degli ormoni e dei farmaci.
Le proteine sono costituite da aminoacidi. Quando questi ultimi vengono
metabolizzati producono azoto, che l’organismo converte in ammoniaca
(NH3), importante per mantenere un corretto equilibrio acido-base
nell’organismo.
Il fegato collabora a regolare i livelli di ammoniaca convertendola in
urea, che viene eliminata con l’urina.
In presenza di gravi malattie epatiche l’ammoniaca si accumula nel
sangue. Elevate concentrazioni di ammoniaca possono risultare tossiche,
specialmente per il cervello, e possono essere implicate nello sviluppo
della encefalopatia porto-sistemica.
Dato che il fegato svolge una funzione cruciale nel metabolismo
ormonale, le malattie epatiche croniche possono causare squilibri
ormonali. Per esempio, il testosterone e gli estrogeni vengono
metabolizzati e inattivati a livello epatico.
Molti farmaci vengono metabolizzati dal fegato. Per far sì che i farmaci
assunti per via orale raggiungano la circolazione sistemica, essi devono
essere assorbiti dall’intestino e trasportati attraverso il circolo portale al
fegato.
Il metabolismo epatico può attivare o inattivare un farmaco.
Il fegato è generalmente responsabile della detossificazione da agenti
chimici e tossici, sia ingeriti sia inalati.
Malattie epatiche pre-esistenti possono inibire o alterare i processi di
detossificazione, accrescendo l’effetto tossico di questi agenti.
Inoltre i prodotti chimici o le tossine possono lesionare direttamente
il parenchima epatico, con effetti che vanno da una moderata
alterazione della funzionalità del parenchima epatico a un danno
grave che può mettere a rischio la sopravvivenza stessa del paziente.
1 - PRINCIPALI FUNZIONI DEL FEGATO
Metabolismo di carboidrati,
lipidi e proteine
• regolazione del livello di glucosio del sangue
(glicogenosintesi)
• trasformazione degli zuccheri in eccesso in grassi
(liponeogenesi)
• rimozione dei lipidi dal sangue e accumulo nel tessuto
adiposo
• produzione di aminoacidi non essenziali
• eliminazione delle proteine in eccesso.
• gli aminoacidi in eccesso subiscono la deaminazione:
Escrezione cataboliti azotati
• l’ammoniaca (tossica) è trasformata in urea:
• l’urea quindi passa nel sangue e viene eliminata attraverso i
reni.
Produzione di proteine
• es. fibrinogeno, fattori della coagulazione, ecc..
• albumine, globuline specifiche
2 - PRINCIPALI FUNZIONI DEL FEGATO
molte sostanze tossiche vengono neutralizzate
Detossificazione
Inattivazione di ormoni
Termoregolazione
Produzione di bile
Produzione del colesterolo
Eritropoiesi
Accumulo di Vitamine e sali
dopo aver svolto la loro funzione vengono inattivati:
- es. insulina, glucagone, tiroxina, ormoni steroidei, ecc..
grazie all’elevato tasso metabolico, all’elevata massa e al notevole
flusso sanguigno diffonde energia termica a tutto l’organismo (anche
durante il sonno).
• serve ad emulsionare i grassi (sali biliari);
• contiene bilirubina (dalla demolizione dell’emoglobina).
• costituente delle membrane cellulari:
• quello in eccesso viene secreto con la bile;
• se in eccesso può formare dei calcoli nella cistifellea
• solo nella vita fetale
• nell’adulto partecipa a tale funzione in quanto è sito di accumulo
della vitamina B12
• Vitamine del gruppo B (es. B12); Vitamine A e D;
• Fe, Cu.
PRINCIPALI FUNZIONI DEL FEGATO
RIASSUMENDO:
- metabolismo delle proteine
1) deaminazione degli aminoacidi, affinché possano essere utilizzati a scopi energetici
2) produzione di urea, per rimuovere l'ammonio prodotto dai batteri intestinali
3) sintesi delle proteine del plasma
4) sintesi di aminoacidi e altri prodotti chimici
- metabolismo dei glucidi (mantenimento dell'omeostasi glucidica)
1) sintesi e immagazzinamento (gluconeogenesi e glicogenosintesi)
2) mobilizzazione dai depositi (glicogenolisi)
- metabolismo dei lipidi
1) nei confronti di acidi grassi (degradazione, esterificazione con glicerolo a trigliceridi
2) sintesi del colesterolo
- deposito e sintesi
1) deposito di vitamine e ferro
2) sintesi di fattori della coagulazione (fibrinogeno, protrombina, fattori V, VII, IX, X)
IL FEGATO
LA BILIRUBINA E I SALI BILIARI
Le cellule epatiche secernono la bile, la quale
attraverso i canalicoli biliari giunge ai dotti biliari
e poi via via, verso dotti sempre più grandi,
fino al dotto epatico ed al coledoco.
La bile è composta da acqua per l'82%, quindi
da acidi biliari (12%), lecitina ed altri fosfolipidi (4%) e colesterolo non esterificato
(0,7%).
I sali biliari primari (colico e chenodesossicolico) vengono sintetizzati dalle cellule
epatiche a partire dal colesterolo endogeno, coniugati con glicina e taurina, ed in parte
riassorbiti con la circolazione enteroepatica.
Gli acidi biliari primari sono metabolizzati nel colon ad opera dei batteri e vengono
trasformati negli acidi biliari secondari.
Nell'intestino i sali biliari esplicano la loro funzione emulsionante o detergente sulle
particelle di grasso alimentare, frammentandole in particelle più piccole e rendendole
idrosolubili.
E’ un pigmento di colore giallastro, derivato dall’emoglobina quale
prodotto della degradazione dei globuli rossi.
La milza, che degrada i vecchi eritrociti, rilascia nel sangue bilirubina non
coniugata, che viene trasportata dall’albumina.
Il fegato normalmente capta la bilirubina circolante e la trasforma,
coniugandola con acido glucuronico, in una sostanza solubile che viene
riversata nella bile, con la quale viene escreta nell’intestino.
IL FEGATO
LA BILIRUBINA E I SALI BILIARI
La bilirubina circolante, prodotta per l'80-90% dalla lisi dei globuli rossi, giunge al
fegato legata all'albumina (non idrosolubile). Le cellule epatiche provvedono a "catturarla" ed
a renderla solubile legandola a sostanze particolari (acido glucuronico e ione solfato).
Viene poi secreta nei canalicoli biliari e attraverso le vie biliari extraepatiche, giunge nel duodeno
dove, per azione della flora batterica intestinale, viene trasformata ed eliminata con le feci come
stercobilinogeno ed in parte riassorbita ed eliminata per via urinaria come urobilinogeno.
I sali biliari favoriscono l'assorbimento intestinale degli acidi grassi, dei monogliceridi,
del colesterolo e di altri lipidi. Mancando i sali biliari viene perduto dall'intestino circa il 40% dei
lipidi che si "portano dietro" anche le vitamine liposolubili (vit.A,D,E,K)
Circa il 94% dei sali biliari viene riassorbito dalla mucosa intestinale insieme coi lipidi, coi quali hanno
formato un legame, e dai quali si staccano non appena penetrati nel circolo ematico. Passano poi ai
vasi portali e ritornano al fegato, ove vengono riassorbiti a livello dei sinusoidi dalle cellule epatiche e
trasportati infine nei dotti biliari.
La secrezione giornaliera di bile è di circa 500-600 ml e gli acidi biliari ricircolano
mediamente dalle 5 alle 10 volte al giorno nel circolo entero-epatico.
IL FEGATO
LA BILIRUBINA
ORIGINE
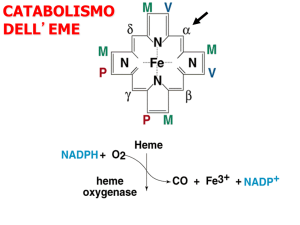
Emoglobina, mioglobina, citocromi → EME (gruppo prostetico)
Degradazione dell'EME → bilirubina
CATABOLISMO
DELL’EMOGLOBINA
La bilirubina si forma dalla degradazione dell' emoglobina.
L'emoglobina contenuta negli eritrociti viene catabolizzata, con rottura del suo
caratteristico anello protoporfirinico e l'eme che viene liberato grazie all'emeossidasi viene convertita in biliverdina.
La biliverdina a sua volta viene trasformata in bilirubina grazie ad un enzima
citosolico detto biliverdina-reduttasi.
Questa bilirubina è detta non coniugata (o indiretta) ed è insolubile, quindi per
essere trasportata all'interno del sangue deve essere legata ad una proteina
serica prodotta dal fegato, l'albumina. La bilirubina legata all'albumina viene
definita bilirubina indiretta o libera.
La bilirubina indiretta viene inviata al fegato dove all'interno delle cellule epatiche si
distacca dall'albumina e viene coniugata con acido glucuronico con formazione
della bilirubina diretta o coniugata. La bilirubina indiretta raggiunge il fegato dove viene
internalizzata grazie alla presenza di una proteina vettrice epatica chiamata ligandina.
Il deficit ereditario di questa proteina vettrice si manifesta con un'iperbilirubinemia
congenita benigna, la Sindrome di Gilbert.
Per indirizzare la bilirubina verso l'intestino, il fegato deve prima coniugarla (ossia
legarla) a una sostanza che la rende solubile nella bile: l'acido glucuronico trasforma la
bilirubina liposolubile non coniugata (bilirubina indiretta) in bilirubina idrosolubile
coniugata (bilirubina diretta).
Questo processo è catalizzato da un enzima microsomiale detto uridina difosfoglucuronil
transferasi (UDPGT): il deficit ereditario di questo enzima è la causa della sindrome di
Crigler-Najjar, che si manifesta con ittero severo e persistente.
IL FEGATO
LA BILIRUBINA
prodotto di degradazione dell’emoglobina (200-300 mg/dl)
principale pigmento della bile
si forma nei macrofagi di milza e midollo dalla emoglobina (Fe riciclato!)
bilirubina insolubile (bilirubina indiretta) veicolata dall’albumina
raggiunge il fegato, viene coniugata con ac. glucuronico (bilirubina
diretta) ed escreta nella bile intestino feci
batteri intestinali ossidano la bilirubina a urobilinogeno
urobilinogeno è in parte riassorbito dal circolo entero-epatico e finisce
nelle urine (urobilina)
urobilinogeno è in parte trasformato dai batteri intestinali in
stercobilinogeno ed eliminato come stercobilina
indiretta
diretta
IL FEGATO
LA BILIRUBINA
IL FEGATO
LA BILIRUBINA
IL FEGATO
LA BILIRUBINA
IL FEGATO
LA BILIRUBINA
I PIGMENTI BILIARI
Dopo 120 giorni
Milza, organi linfatici,
midollo osseo e fegato
Biliverdina Bilirubina
“libera”
combinata con
l’albumina plasmatica
Azione
batterica
Colore
bruno delle
feci
La bilirubina, a cui
è dovuto il colore
giallo-verde della
bile epatica, costituisce la quasi
totalità dei pigmenti presenti nella
bile
L’urobilinogeno
e l’urobilina danno
il colore alle urine
La stercobilina conferisce
il colore alle feci
IL FEGATO
LA BILIRUBINA
FUNZIONI DELLA BILE
-ruolo chiave nella digestione dei lipidi: assorbimento intestinale dei lipidi,
sostanze lipofile e vitamine per azione dei sali biliari
-veicolo attraverso cui vengono eliminati: la bilirubina, alcuni metalli
pesanti (Cu, Fe, Mn, Zn) e altre sostanze potenzialmente tossiche e
numerosi anioni e cationi organici (ormoni, farmaci, ecc), il colesterolo
(regolazione della quantità di colesterolo presente nell’organismo,
attraverso la sintesi di sali biliari e l’escrezione biliare del colesterolo)
-protezione da infezioni intestinali, attraverso l’escrezione di IgA e di
citochine
-protezione dell’epatocita e delle cellule dei duttuli e della mucosa
intestinale dall’azione tossica dei sali biliari
Un’aumentata produzione o una diminuita clearance di
bilirubina portano all'accumulo della stessa e quindi a
ittero (pigmentazione gialla visibile a livello cutaneo e
nella sclera, cioè la parte bianca dell’occhio) che
rappresenta un comune sintomo di epatopatia.
IL FEGATO
LA BILIRUBINA
VALORI EMATICI DI RIFERIMENTO
– Totale: 0.4 - 1.0 mg / dl
– Diretta: 0.0 - 0.4 mg / dl
– Indiretta: 0.4 - 1.0 mg / dl
CLASSIFICAZIONE DELL’ITTERO
– Iperproduzione bilirubina
– Diminuita captazione bilirubina
– Ridotta coniugazione epatica
– Diminuita escrezione biliare per cause epatiche o extraepatiche
Ittero pre-epatico (da emolisi)
Ittero epatocellulare
Ittero post-epatico (ostruttivo o colestatico)
In presenza di bilirubina le urine assumomo colore marsala scuro.
Normalmente la bilirubina non deve essere presente nell’urina, se non in piccolissima
quantità (0,02 mg/100ml).
La presenza nell’urina può essere causata da :
-anemia emolitica, talassemia
-anemia perniciosa,
-avvelenamento da arsenico, fosforo e piombo,
-calcoli delle vie biliari,
-carcinoma del pancreas,
-cirrosi epatica, infiammazione delle vie biliari all’interno del fegato (colangite), epatite
acuta virale,
-malattia infettiva di breve durata e di gravità variabile, provocata da un virus trasmesso
dalle zanzare (febbre gialla),
-ipotermia,
-malaria (grave malattia parassitaria trasmessa dalla puntura della zanzara Anopheles;
-sepsi
Per colesterolo si intende precisamente non una sola sostanza, bensì un
gruppo di composti di tipo amidaceo presenti in tutte le parti del corpo,
compreso il sistema nervoso, la pelle, i muscoli, il fegato, l'intestino e il
cuore.
Queste sostanze sono prodotte dal corpo umano e sono anche assunte
con gli alimenti attraverso i prodotti d'origine animale come, ad esempio,
uova, latticini, carne, etc. Gli alimenti d' origine vegetale non contengono
colesterolo.
Il colesterolo è sintetizzato nel fegato per le normali funzioni
dell’organismo, compresa la produzione di ormoni, bile e vitamina D.
Il colesterolo è trasportato nel sangue per essere utilizzato in
ogni parte del corpo.
Si misura il livello di colesterolo totale nel siero per valutare il
quadro generale dei grassi nel sangue. In particolare, sono
misurati tre particolari tipi di colesterolo, ossia, il colesteroloHDL, LDL, VLDL e i trigliceridi.
Il valore di colesterolo totale è la somma dei valori di
colesterolo-HDL, LDL, VLDL.
Alti livelli di colesterolo-HDL sembrano essere protettivi contro le malattie
coronariche tanto che è indicato come colesterolo "buono“, perchè le
molecole HDL hanno una struttura molto grande e tali dimensioni
consentono loro di "spazzare“ fisicamente le arterie e di ripulirle dai
depositi arteriosclerotici.
Una persona che ha un colesterolo totale alto ma un HDL ad un livello
maggiore di 35 non è a rischio, quanto una persona che insieme a un
colesterolo totale alto, presenta un livello di HDL basso, inferiore a 35.
Il colesterolo-LDL è una lipoproteina a bassa densità (Low Density
Lipoprotein) e il colesterolo-VLDL è una lipoproteina con densità ancor
inferiore alla precedente (Very Low Density Lipoprotein).
La funzione principale del colesterolo-LDL e -VLDL sembra essere il trasporto
del colesterolo in senso inverso a quello del colesterolo-HDL, ossia dal sangue
ai vari tessuti e organi e per questo motivo a volte è indicato come
colesterolo "cattivo".
Elevati livelli di colesterolo-LDL sono legati alla presenza di malattie
coronariche; valori compresi tra 160-189 mg/dl sono considerati alti e valori
uguali o superiori a 190 mg/dl sono considerati molto alti.
ghiandola tiroide non perfettamente attiva
dieta alimentare
troppo ricca di grassi
fattori
ereditari
diminuita funzione renale
diabete scarsamente controllato
IL FEGATO
IL COLESTEROLO
IL FEGATO
LE RELAZIONI … EPATICHE
IL FEGATO
LE RELAZIONI … EPATICHE
SECREZIONI DELL’INTESTINO TENUE
Nell’intestino tenue la digestione alimentare avviene per l’azione di tre succhi:
SUCCO PANCREATICO prodotto dal Pancreas esocrino;
BILE prodotta dal Fegato;
SUCCO ENTERICO secreto dalle ghiandole intestinali (cripte del Lieberkuhn in tutta la mucosa)
e dalle ghiandole di Brunner presenti nella mucosa duodenale.
PANCREAS ESOCRINO
Produce gli enzimi pancreatici digestivi e ioni bicarbonato (funzione esocrina). Riceve molte
fibre nervose parasimpatiche attraverso i nervi vaghi; questi segnali parasimpatici, modulati da
recettori colinergici muscarinici, hanno carattere eccitato-secretorio. Dai gangli celiaci
giungono al Pancreas anche fibre ortosimpatiche adrenergiche destinate al controllo
vasomotorio.
IL FEGATO
PATOLOGIE INFETTIVE
PATOLOGIE TOSSICHE
PATOLOGIE VASCOLARI
PATOLOGIE DA ABUSO (Alcool)
PATOLOGIE NEOPLASTICHE
PATOLOGIE AUTOIMMUNI
Colestasi
Alterazioni dei test di funzionalità epatica
Insufficienza epatica
Epatiti virali acute
Steatosi epatica e epatite alcolica
Epatiti croniche
Cirrosi
Epatiti tossiche
epatopatie congestizie
cirrosi biliare primitiva
epatocarcinoma
metastasi epatiche
epatopatie autoimmuni
morbo di Wilson
amiloidosi
sarcoidosi
linfoma
emocromatosi
cisti o malattia policistica
DANNO EPATICO
Ridotto e/o limitato nel
tempo
Rigenerazione
(microrigenerazione)
Persistente e/o
esteso
Riparazione
Fibrosi
Cirrosi
INSUFFICIENZA EPATOCELLULARE (riduzione del parenchima oltre
il 60 – 70%) Metabolismo - Detossificazione
A) Dismetabolismo protidico
Fegato → sintesi proteine plasmatiche (escluse Ig)
- Insufficienza epatica → ipoalbuminemia → edema (partecipa alla produzione di ascite)
- Insufficienza epatica → deficit fattori coagulazione → diatesi emorragica
- Insufficienza epatica → deficit deaminazione aminoacidi e trasformazione ammoniaca in urea
B) Dismetabolismo glucidico
- Insufficienza epatica → gluconeogenesi → ipoglicemia (più evidente nelle forme acute)
C) Insufficiente detossificazione
Coniugazione con glucuronidi, solfati, aminoacidi → detossificazione molti agenti → escrezione
- Farmaci (depressivi, morfina, ecc.) → rischio di coma
- Aldosterone → alterato riassorbimento di sodio → edemi, ascite
- Inattivazione ormonale → eccesso di estrogeni → ginecomastia, atrofia testicolare, amenorrea
- Encefalopatia
D) Malattie epatiche croniche
- Deterioramento intellettivo
E) Shunt porta-cava → grave tossicità → necessità di dieta ipoproteica per ridurre le sostanze azotate
NECROSI
EPATOCELLULARE
LIBERAZIONE
ENZIMATICA
↑ AST
↑ ALT
INSUFFICIETE
METABOLISMO
BILIRUBINA
(SOPRATTUTTO
PROVE DI LABORATORIO
ITTERO
CONIUGATA)
INSUFFICIETE
DETOSSIFICAZ.
SOSTANZE
AZOTATE
INSUFFICIETE
SINTESI
PROTEICA
ENCEFALOPATIA EPATICA
SINTOMI EMORRAGICI
(Fatt. II VII IX X)
SHOCK
(multieziologico)
↓ Filtrazione
glomerulare
INSUFFICIENZA RENALE
ANAMNESI
RICERCA DEI SINTOMI
ESAME OBIETTIVO
ESAMI EMATOCHIMICI
RICERCA DEI SINTOMI
L’ANAMNESI E L’ESAME OBIETTIVO POSSONO ESSERE SILENTI ED IL PAZIENTE GIUNGERE ALLA
OSSERVAZIONE IN PIENO BENESSERE PER OCCASIONALI CONTROLLI EMATOCHIMICI
Il paziente epatopatico si può presentare con sintomatologia aspecifica o addirittura assente
Nausea, vomito,
diarrea, dolore in
ipocondrio dx
Febbre o
Febbricola
Astenia, inappetenza,
malessere generale
Ittero
Perdita di
peso
Prurito
RICERCA DEI SINTOMI
Dolore ipocondrio dx
Febbre
Astenia
Artralgie
Malessere generale
Prurito
Perdita di peso
Rash cutanei
Anoressia
Fenomeni emorragici
Nausea
Riduzione della libido
Vomito
Irregolarità mestruali
Edemi
ESAMI EMATOCHIMICI
Tre livelli di test
1.Test di 1° livello di funzionalità
2.Test di 2° livello specifici “semplici”
3.Test di 2° livello specifici “complessi” ed eziologici
di patologia epatica
4. Test particolari
ESAMI EMATOCHIMICI
Test 1° livello
Valutazione della capacità di sintesi e di metabolismo
Es.: Proteine totali, albumina, profilo elettroforetico, pseudocolinesterasi,
fattori della coagulazione (fattore VII, TP, fibrinogeno)…
Test di escrezione
Es.: bilirubina totale, diretta, indiretta, ammoniemia …
Test di citolisi
Es.: enzimi plasmatici (AST, ALT, fosfatasi alcalina…)
ESAMI EMATOCHIMICI
Test di 2° livello (specifici e aspecifici)
Test specifici indiretti di tipo infettivologico;
Test aspecifici (marcatori):
1) Ricerche anticorpali (Ep. A, B, C, …, CMV, ecc.)
2) Ricerca di marcatori di patologie autoimmuni
3) Ricerca di marcatori tumorali (AFP, CEA, ecc..)
ESAMI EMATOCHIMICI
2. Test specifici/eziologici di patologia
Test
specifici diretti e indiretti di diagnosi eziologica
epatica
epatopatia:
Ricerca in biologia molecolare dell’agente eziologico
Es.: PCR – DNA CMV
Ricerca Anticorpi di autoimmunità d’organo o sistemica
Es.: ANA, LKM, ASMA, ecc..
Ricerca tossicologica
Es.: veleni, vernici, intossicazioni da funghi, ecc..
di
Test 1° livello
Valutazione della capacità di sintesi e di metabolismo
La concentrazione plasmatica può risultare alterata sia per condizioni che modificano il
metabolismo proteico che per alterazioni della volemia.
PROTEINE, GLICOPROTEINE, LIPOPROTEINE
ORIGINE: prevalentemente dal fegato, immunoglobuline dalle plasmacellule, alcuni
componenti del complemento dai macrofagi, alcune lipoproteine dalle cellule
intestinali, ecc..
FUNZIONI: nutritiva (albumina), tampone (non fra i più importanti), coagulazione e
fibrinolisi, trasporto (bilirubina, ormoni, lipidi, calcio) pressione osmotica, ecc…
ELETTROFORESI SIEROPROTEICA
PROTIDEMIE SPECIFICHE
Test 1° livello
Valutazione della capacità di sintesi e di metabolismo
SINTESI PROTEICA PIÙ EVIDENTE NELLE FORME CRONICHE.
Test 1° livello
Albumina
Sintetizzata dalle cellule parenchimali del fegato, vita media 20 giorni, responsabile
della pressione oncotica, trasporta: bilirubina, ormoni, calcio, farmaci, ecc..
Ipoalbuminemia per varie cause:
• perdita da sindrome nefrosica, perdita da ustioni o dermatiti, ecc..
• apporto inadeguato di proteine (vomito, diarrea, malassorbimento, pancreatiti,
ecc..)
• diminuita sintesi epatica (si ritiene comunque che il fattore che influenza in modo
significativo l’albuminemia nelle malattie epatiche croniche non è la funzione
epatocellulare ma la ritenzione idrica) eventualmente associata a diminuita
alimentazione, ascite, malassorbimento
• aumentato catabolismo (ipertiroidismo, traumi, sindrome di Cushing).
• in alcune condizioni fisiologiche (gravidanza, lattazione)
• infiammazione acuta e cronica con necrosi tissutale
Quando le strutture cellulari
vengono danneggiate gli
enzimi cellulari si liberano e si
riversano nel circolo
sanguigno.
In questo modo, un aumento della loro concentrazione nel
campione può rappresentare un indice abbastanza preciso
di un danno cellulare.
Test 1° livello
Pseudocolinesterasi (CHE)
E’ un parametro di sintesi non molto “specifico”.
E’ un enzima di secrezione presente nel plasma, da usarsi come indice di ridotta sintesi
proteica del parenchima epatico. Nelle epatiti croniche e nelle cirrosi i livelli diminuiscono
proporzionalmente al danno.
Esistono due forme chimiche circolanti; normale ed atipica. Soggetti omozigoti per la
forma atipica hanno ridotti livelli circolanti non in grado di idrolizzare alcuni miorilassanti
(es.: succinilcolina) che possono essere usati in anestesia (oggi poco utilizzati).
Si ha diminuzione in caso di:
• Avvelenamento da insetticidi
• Ipoalbuminemia, da malnutrizione o cirrosi, o da infezioni acute
Test 1° livello
Pseudocolinesterasi (CHE)
EZIOLOGIA DELLA DIMINUZIONE DELLA PSEUDOCOLIESTERASI
FEGATO
epatite virale, necrosi epatica acuta, cirrosi, ascessi, stasi
INFEZIONI
fase acuta
CUORE
ima
SANGUE
anemia
GRAVIDANZA
tossicosi
IATROGENA
trattam. con succinilcolina, intoss. da esteri fosforici
COLLAGENOPATIE
dermatomiosite
Test 1° livello
Tempo di protrombina e coagulazione
E’ una delle indagini più sensibili per misurare la funzionalità nelle forme acute e
croniche
Il fegato sintetizza il fibrinogeno, i fattori vit. K-dipendenti (II, V, VII, IX, X)
anomalie della via estrinseca e intrinseca
con un prolungamento del tempo di
protrombina (PT)
Marcati aumenti del tempo di PT (non corretto da trattamento con
Vit K) sono un segno negativo sia nelle forme acute che croniche.
Test 1° livello
Test di escrezione - Ammonio
Eliminazione fisiologica circa 10-20g di azoto al giorno
dall’alimentazione o da aminoacidi (AA) non riutilizzabili attraverso:
(provenienti
AA → L-glutammato → NH3 → ciclo di Krebs → Urea
L’NH3 liberata dagli AA, a causa della sua tossicità, è rapidamente allontanata
dall’organismo (es.: come urea o glutammina) AMMONIEMIA
L’Urea nel sangue è generalmente indice di funzionalità renale (nella valutazione dei
valori aumentati), ma diminuisce in seguito ad una grave insufficienza epatica o in
soggetti con alimentazione povera di proteine.
L’AMMONIEMIA è utile in caso di sospetta encefalopatia epatica (sindrome caratterizzata da
alterazioni neurologiche conseguenti a grave insufficienza della funzionalità epatica e/o
cortocircuiti venosi fra vena porta e circolo sistemico).
Il danno cerebrale sarebbe conseguente all’accumulo di sostanze tossiche (ammoniaca etc..)
assorbite dall’intestino, non metabolizzate dal fegato.
Le transaminasi (o amminotransferasi) sono una classe di enzimi,
appartenenti alla classe delle transferasi, che intervengono nella
transaminazione, più precisamente sono predisposti a catalizzare la
reazione di trasferimento del gruppo amminico α da un amminoacido a un
α-chetoacido.
La reazione di transaminazione è la prima tappa del catabolismo degli
amminoacidi e serve ad incanalare gruppi amminici verso l’α-chetoglutarato
al fine di trasformarlo in glutammato, il quale poi verrà sottoposto ad una
reazione di deaminazione ossidativa per formare uno ione ammonio che
sarà utilizzato per generare urea.
La reazione catalizzata dalle transaminasi è la seguente:
Amminoacido 1 + α-Chetoacido 1 ⇔ α-Chetoacido 2 + Amminoacido 2
Le transaminasi comprendono:
la glutammato-ossalacetato transaminasi, GOT, detta
anche aspartato aminotransferasi, AST.
La glutammato-piruvato transaminasi, GPT, detta
anche alanina aminotransferasi, ALT.
Le transaminasi sono usate in medicina soprattutto al fine di
evidenziare la presenza o meno di un danno epatico, e i loro
valori normali indicati nei referti di laboratorio variano a
seconda della metodica analitica adottata.
FEGATO
Test 1° livello
Test di citolisi (necrosi)
ENZIMI INDICATORI DI DANNO EPATOCELLULARE: TRANSAMINASI
AST – GOT
(aspartato-amminotrasferasi, glutamato-ossalacetato transaminasi)
enzima principalmente legato ai mitocondri (80%) (fegato, miocardio, rene, eritrociti, cervello,
muscolo)
ALT – GPT
( alanina-amminotrasferasi, glutamato-piruvato transaminasi)
enzima citoplasmatico presente nel fegato in quantità maggiori che negli altri tessuti
aumentano, principalmente, per necrosi dell’epatocita ma, anche se in
maniera minore, per danneggiamento funzionale cellulare
sono indicatori sensibili, anche in pazienti asintomatici
Test 1° livello
Test di escrezione - bilirubina
Ittero pre-epatico (da emolisi)
Ittero epatocellulare
Ittero post-epatico (ostruttivo o colestatico)
TRANSAMINASI
PATOLOGIE CHE DETERMINANO AUMENTO DELLE TRANSAMINASI
CUORE
Infarto miocardico acuto, Miocarditi, Pericarditi, Insufficienza cardiaca,
Aritmie, Post-intervento.
FEGATO
Epatiti virali, CMV, MNI, Epatopatie da farmaci, Epatopatia alcoolica,
Epatiti croniche, Colestasi, Cirrosi, Carcinoma epatico, Metastasi,
Malattia di Wilson, Avvelenamento da Amanita Falloide, Fegato da
shock, Fegato da stasi
MUSCOLO
Miositi, Distrofie muscolari, Trichinosi, Delirium tremens, Traumi
muscolari, Interventi chirurgici
SANGUE (GOT)
Anemie emolitiche, Leucemie, (aumento di LDH)
CERVELLO
Infarto cerebrale (aumento di LDH)
PANCREAS
Pancreatite acuta e cronica
MALATTIE SISTEMICHE
Vasculiti, Lupus ed altre collagenopatie
ESEMPIO di
PATOLOGIA EPATICA
COLESTASI:
Litiasi?
Patologia funzionale?
Patologia pancreatica?
Altro?
Condizione
patologica
rappresentata dal ristagno
di
bile
all’interno
della colecisti o dei canali
biliari intra-epatici o extraepatici (ad esempio, il
coledoco) per malattie acute
o croniche del fegato e anche
del sistema biliare.
Test 1° livello
Test di colestasi
ENZIMI INDICATORI DI STASI PATOEPATICA: FOSFATASI ALCALINA
ALP
(fosfatasi alcalina)
enzima diffuso in vari tessuti ad organi come isoenzimi epatici, osseo, intestinale e placentare.
In caso di neoplasie maligne la frazione placentare è sostituita dall’ isoenzima detto Regan
aumento fisiologico:
- bambini (per l’accrescimento osseo)
- gravidanza (isoenzima circolante di origine placentare)
aumento patologico:
- farmaci epatotossici
- nelle epatopatie
- in tutte le forme di ostruzione delle vie biliari
Gli isoenzimi sono quelle proteine che catalizzano la stessa
reazione, ma presentano diverse proprietà molecolari e talvolta
funzionali:
- diversa carica elettrica
- diversa solubilità
- diversa resistenza ad agenti chimici
- diversa resistenza ad agenti fisici
- diverso pH di ambiente della reazione
- diversa affinità
Le fosfatasi sono una classe di idrolasi che catalizzano la rimozione di
gruppi fosfato.
R-O-PO3H2 + H2O
ROH + H3PO4
In pratica, rappresentano i catalizzatori biochimici della reazione
di defosforilazione.
In relazione al pH in cui operano, si distinguono due tipi di fosfatasi:
la fosfatasi acida (ACP) e la fosfatasi alcalina (ALP).
Livelli elevati di ALP si trovano in tutte le cellule in fase di proliferazione o con attivo
metabolismo
(epatociti,
osteoblasti,
cellule
epitelio
intestinale,
reni, leucociti e placenta).
L’attività enzimatica nei diversi tipi cellulari è il prodotto di diversi geni e quindi si
possono distinguere gli isoenzimi organo-specifici (metodo elettroforetico o
immunologico):
- ossa
- placenta
- fegato
- intestino
Il fegato produce due isoenzimi (cellule epiteliali dei canalicoli biliari ed epatociti)
che normalmente sono escreti con la bile.
Il polimorfismo della fosfatasi alcalina dipende sia da fattori genetici
che da modificazioni post-traduzionali.
E’ stato dimostrato che esistono tre distinti loci che codificano le
diverse ALP: un locus per l’ALP intestinale, uno per l’ALP placentare e
uno per l’ALP ”tessuto aspecifica” prodotta in vari tessuti, ma in
particolar modo nel tessuto osseo, nel fegato e nel rene. Solo queste
tre forme possono essere considerate veri e propri isoenzimi, le altre
forme molecolari deriverebbero da questi isoenzimi in seguito a
modificazioni post-traduzionali e post-sintetiche.
Tra i metodi più comunemente usati per lo studio degli
isoenzimi della ALP , quello elettroforetico su acetato di
cellulosa si è rivelato il più idoneo.
In base al loro comportamento su questo supporto gli
isoenzimi osteo-epatico, placentare e intestinale vengono
denominati rispettivamente ALP1, ALP2 e ALP3.
FOSFATASI ALCALINA
MALATTIE CHE DETERMINANO AUMENTO DELLA FOSFATASI ALCALINA
FEGATO
cirrosi biliare primitiva, colestasi extraepatica, epatite alcolica, epatite
virale, cirrosi, colangite, colestasi iatrogena
OSSA
osteite deformante, sarcoma osteogenico, iperparatiroidismo, mts
ossee, rachitismo, paget, cushing
MALATTIE INFETTIVE
mononucleosi - CMV
GRAVIDANZA
SANGUE
plasmocitoma
RENE
neoplasie
Test 1° livello
Test di colestasi
ENZIMI INDICATORI DI STASI EPATICA: GAMMA GLUTAMILTRANSFERASI
γgt - GGT
(gamma glutamil transferasi)
enzima legato alla membrana plasmatica responsabile della sintesi intracellulare di
glutatione. L’alcol etilico ne stimola la sintesi epatica
aumento:
- forte negli alcolisti cronici
- anche per la sola assunzione di alcool, senza epatopatie associate
- colestasi
- danno epatocellulare
- induzione da farmaci (rifampicina, antiepilettici)
Enzima presente nella membrana cellulare di organi diversi, ma l’enzima sierico
è principalmente di origine epatica. Promuove il trasferimento del gruppo
chimico g-glutamilico dal glutatione ad altri aminoacidi: si trova in tutto il fegato
(parenchima epatico e vie biliari) e in altri tessuti (intestino, pancreas, cervello,
cuore e rene).
Il glutatione (L-g-glutamil-cisteinil-glicina) è un tripeptide formato da tre unità
alfa amminoacidiche.
Incrementi notevoli di questo enzima si verificano, in realtà, soltanto in
corso di colestasi: tuttavia, elevate concentrazioni possono essere
osservate anche in corso di somministrazione di alcuni farmaci
(difenilidantoina, barbiturici oltre a tutti i farmaci in grado di provocare
colestasi), nell’infarto del miocardio, nelle metastasi epatiche e
nefrosi.
Questo enzima, è particolarmente sensibile all'azione dell'alcool di cui
può quindi rilevare la epatotossicità. In fase di guarigione da una
epatite acuta, la g-GT è l'ultima attività enzimatica che si normalizza.
FEGATO
Pur essendo considerato indicativo di epatopatia cronica, va
ricordato che la sua specificità non è assoluta, potendosi
riscontrare aumenti della g-GT anche in corso di malattie renali,
pancreatiche, polmonari e metaboliche (diabete mellito e
ipertiroidismo).
A causa di questi aumenti l’enzima viene considerato sensibile, ma
poco specifico e il valore predittivo della g-GT per malattia epatica
è del 30%.
GAMMA GT
MALATTIE CHE DETERMINANO AUMENTO DELLE GAMMA GT
FEGATO
Epatopatie Alcoliche, Metastasi Epatiche, Colestasi Intraepatica,
Colestasi Extraepatica, Patologie Iatrogene, Fegato da Stasi, Epatiti,
Cirrosi Biliare Primitiva
RENE
Neoplasie, Nefropatia Diabetica, Sindrome Nefrosica
PANCREAS
Carcinoma, Pancreatite Cronica
Test 1° livello
SCHEMA RIASSUNTIVO PER LE EPATOPATIE
AUMENTO
TRANSAMINASI
X
GAMMA GT
FOSFATASI ALCALINA
X
X
BILIRUBINA
X
SALI BILIARI
X
PSEUDOCOLINESTERASI
TEMPO DI QUICK
DIMINUZIONE
X
X
COMPLEMENTO
X
ALBUMINA
X
COLESTEROLO
X
X
Test 1° livello
L’enzima lattato deidrogenasi (LDH)
catalizza la trasformazione
dell'acido piruvico in acido lattico, sostanze che vengono prodotte nei
muscoli quando si utilizza il glucosio. E' infatti un enzima della glicolisi,
presente nella maggior parte dei tessuti e in concentrazione più elevata
nel cuore, fegato, muscolo scheletrico, rene, eritrociti.
L’enzima lattato deidrogenasi (o LDH) catalizza la seguente reazione:
L’enzima LDH consente di ossidare il NADH a NAD+ utilizzando come
molecola ossidante, al posto dell'ossigeno, il prodotto stesso della
glicolisi, l'acido piruvico, che viene ridotto ad acido lattico secondo la
reazione
L'LDH è un test poco specifico: considerato isolatamente non ha un importante
valore diagnostico.
Può essere misurato per valutare la presenza di un danno a livello tissutale.
L‘enzima LDH aumenta in tutte le condizioni di necrosi tissutale e di malattie a
carico del cuore, fegato, polmone, rene, muscoli (es. distrofie muscolari e
traumi) e in alcuni tipi di anemie e di tumore (metastasi epatiche).
Si conoscono 5 diversi isoenzimi della lattato deidrogenasi, che vengono
analizzati quando i valori di LDH sono elevati: essi permettono infatti di
interpretare in modo più accurato e specifico l'eventuale danno tissutale
subito dal paziente.
LDH è un tetramero formato
da due tipologie di monomeri:
il tipo H, maggiormente
presente nel cuore, e il tipo
M, caratteristico del fegato.
Dalla diversa composizione
monomerica, si hanno cinque
forme isoenzimatiche: LDH1,
LDH2, LDH3, LDH4, LDH5 che
differiscono
tra
loro
per composizione strutturale,
proprietà
biochimiche
e
diffusione tissutale.
Distribuzione degli isoenzimi
LDH1 è prevalente nel miocardio e nei globuli
rossi. Presente anche nella corteccia renale e
nel muscolo scheletrico.
LDH2 è prevalente nel miocardio e nelle
emazie, oltre ad essere presente nel
pancreas, corteccia renale, polmone e
muscolo scheletrico.
LDH3 è presente nei polmoni, placenta,
muscolo scheletrico e pancreas.
LDH4 si trova nella zona midollare renale,
muscolo scheletrico, polmone e placenta.
LDH5 è caratteristico del fegato. Presente
anche nella zona midollare renale, muscolo
scheletrico e pancreas.
Test 2° livello
PATOLOGIE VARIE ED ESAMI SPECIFICI
Test 2° livello
EPATITI AUTOIMMUNI
ESAMI EMATOCHIMICI
Test di 3° livello - valutazione preoperatoria
Test di valutazione quantitativa di specifici aspetti di funzionalità epatica.
(specifici)
Test complessi utilizzati per ricerche in particolare per il trapianto di
fegato o per monitorare l’efficacia di nuovi farmaci in corso di
epatopatia…
Clearance di xenobiotci
Una adeguata valutazione pre-operatoria
è essenziale per il trattamento di tutti i
pazienti con indicazione ad interventi
chirurgici di qualsiasi tipo soprattutto se
cirrotico.
La valutazione dell'efficienza del fegato
può essere effettuata col metabolismo
degli xenobiotici
Clearance antipirina
Clearance aminopirina
Clearance galattosio
Clearance verde indocianina
Clearance caffeina
Metabolismo lidocaina